В научной литературе артериальному давлению и его патологическим вариациям посвящено множество статей, как фактору риска, имеющего прямое влияние на выживаемость пациентов как в общей популяции, так и на программном гемодиализе. При этом полагают, что имеет значение повышение пульсового давления (ПД), как суррогатного маркера эластичных свойств сосудистой стенки, что является одной из важнейших характеристик состояния сердечно-сосудистой системы и тесно связано с выживаемостью больных. Повышенный уровень ПД, как суррогатный маркер жесткости сосудов, является независимым предиктором смертности и сердечно-сосудистых событий [5-8]. В общей популяции у пожилых лиц с артериальной гипертензией продемонстрировано негативное влияние повышенного ПД на выживаемость, с высокой клинической значимостью данного показателя [1-3]. Значение ПД в клинической практике особенно высоко у пациентов с хронической болезнью почек 5Д (ХБП 5Д), находящихся на программном гемодиализе (ПГД). У данной категории больных наблюдается неблагоприятное сочетание как традиционных факторов риска (перегрузка давлением и объемом, дисфункции эндотелия, утолщение интимы-медии), так и специфических факторов, присущих уремии (медиакальциноз артерий при минерально-костных нарушениях, вторичном гиперпаратиреозе, нарушении синтеза окиси азота). В результате процессы, ведущие к нарушению упругоэластических свойств сосудов, у диализных пациентов существенно ускоряются. Потеря эластичности сосудистой стенки ведет к усилению патологических колебаний АД во время диализной сессии и расширению границ АД, что наиболее выражено у пациентов с высокой скоростью ультрафильтрации (УФ), вызывая ещё большие осложнения [27]. У пациентов, находящихся на ПГД, уровень ПД повышен, в отличие от людей, с нормальной функцией почек [4]. Варианты ремоделирования сосудов у пациентов на диализе, такие как атеросклероз (нарушение проводящих свойств артерий) и артериосклероз (утолщение стенки и снижение эластичности), способствуют повышению смертности от сердечно-сосудистых заболеваний [10]. В структуре общей смертности кардиоваскулярные осложнения является ведущей причиной смерти больных на ПГД - не менее чем 50% всех случаев смерти, значительно опережая онкологические заболевания и гнойно-септические осложнения [9]. Атеросклероз вызывает стенотические поражения участка артерии, что ведет к обструкции просвета сосуда и ишемии органов-мишеней. Артериосклероз способствует повышению жесткости сосудов, увеличению скорости пульсовой волны (СПВ), систолического АД (САД) и ПД, что со временем приводит к гипертрофии левого желудочка (ГЛЖ), диастолической дисфункции, снижению коронарной перфузии и сердечной недостаточности [11]. У диализных пациентов значимую роль играет гипергидратация, которая негативно влияет на изменение пульсового давления (ΔПД) во время процедуры ГД [12]. Ранее уже была выявлена связь между перегрузкой жидкостью пациента с ГЛЖ и повышением смертности диализных пациентов [13,14]. Так же было продемонстрировано, что коррекция гиперволемии и применение ингибиторов ангиотензинпревращающего фермента (иАПФ) снижает СПВ у пациентов, находящихся на ПГД [15]. Снижение СПВ может улучить выживаемость диализных пациентов [16]. Было доказано, что снижение ПД во время гемодиализа связано со снижением риска госпитализации или смерти [17]. В ранних исследованиях наблюдения ограничены регрессионными моделями, которые предполагают линейную зависимость между изменением ПД и смертностью, однако эта связь между изменением ПД во время гемодиализа и смертностью недостаточно изучена в больших проспективных когортных исследованиях, чему и было посвящено данное исследование.
Целью исследования явилась оценка влияния интрадиализных вариаций ПД, а также известных факторов риска на выживаемость пациентов, получающих лечение ПГД. В задачи исследования входило: оценить влияние преддиализного уровня ПД на выживаемость, оценить связь вариаций ПД с выживаемостью больных в модели Каплана-Мейра и в регрессионной модели Кокса; вариаций ПД в группах преддиализного и постдиализного САД; а также в группах, разделенных по скорости ультрафильтрации (УФ); преддиализного и постдиализного среднего артериального давления.
Материалы и методы. В ретроспективный анализ включено всего 3704 больных, находящихся на ПГД в центрах диализа с 2011 по 2016 год. 52% пациентов начали получать диализ впервые, остальные ранее 2011 г. Средний возраст больных составил 54 года, средний срок пребывания на диализе 5,3 года, (мин. 0,8 макс. 32,7 года), доля женщин 45%, доля мужчин 55%. Обеспеченная доза диализа по формуле Даугирдаса составила 1,6±0,23 (spKt/V). Средняя скорость УФ составляла 7,6±2,9 мл/кг/ч. АД перед сеансом составляло 140±15,8 и 84±9,8 мм.рт.ст. Уровень гемоглобина составлял 105±12 г/л. Уровень альбумина 38,3±8,7 г/л. Для решения поставленных задач был проведен статистический анализ связи ПД с выживаемостью больных ГД в пропорциональной регрессионной модели Кокса. В исследовании были использованы усредненные данные ПД, измеренные до и после ГД за весь период наблюдения, после чего больные были разделены на группы <35, 35-55, 55-75 и более 75 мм.рт.ст. Вариации ПД были разделены на группы <-25, ≥-25 - <-15, ≥-15 - <-5, ≥-5 - <5, ≥5 - <15, >15 мм.рт.ст. Результаты выживаемости оценивали по кривым Каплана-Мейера и в регрессионной модели Кокса. Регистрировалось преддиализное АД, измеренное перед началом подключения пациента к аппарату, далее АД измерялось регулярно в ходе сеанса диализа (у гемодинамически стабильных пациентов с АД в целевом диапазоне один раз в час, у нестабильных пациентов с АД вне целевого диапазона один раз в полчаса или чаще). В оценке выживаемости в качестве переменных использовались усредненные значения измерений за весь период наблюдений. Измерение проводилось с помощью встроенного блока автоматического измерения АД на аппарате искусственная почка Б. Браун Диалог +. Смертность определялась по дате смерти, если она произошла в период исследования когорты (09 сентября 2001 года - 30 июня 2016 года). Если пациенты выбыли из исследования по причине трансплантации почки или перехода в другой гемодиализный центр, такие случае расценивали как цензурируемые. Статистический анализ был проведен с помощью статистической программы SPSS 22.0.
Результаты. Во время исследования было зарегистрировано 393 смертельных исхода. Результаты первичного однофакторного анализа показаны на кривых Каплана-Мейера. Как видно из представленных данных, по сравнению с остальными группами, наихудшая выживаемость была выявлена в группе больных с самым высоким преддиализным ПД (> 75 мм рт. cт., n = 207; 35 смертей) - рис. 1. Во всех остальных случаях (группы до 75 мм.рт.ст.) уровень смертности достоверно не различался.
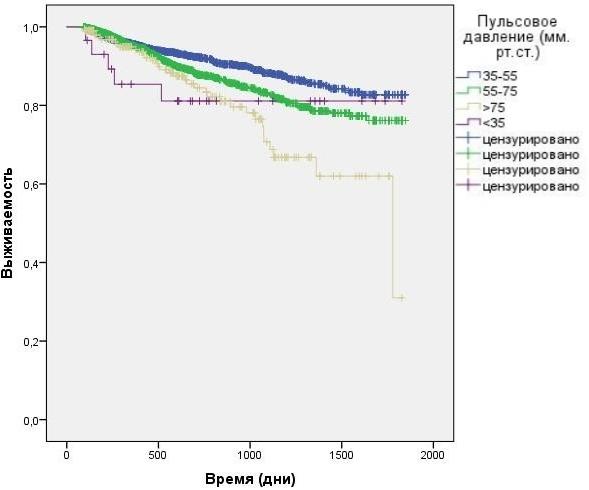
Рис. 1. Зависимость выживаемости больных от преддиализного уровня пульсового АД (анализ Каплана-Мейера).
Анализ влияния интрадиализных колебаний ПД показал значительное повышение смертности у тех больных, которые имели наибольшее падение интрадиализного ПД: в группе со снижением ПД более чем на 25 мм.рт.ст. (n = 35; 9 смертей) - рис. 2.
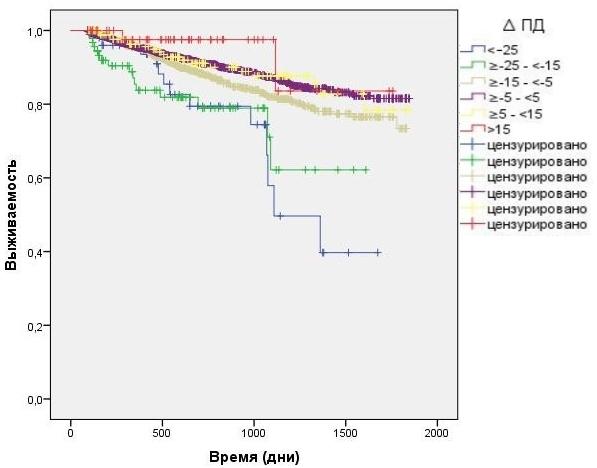
Рис. 2. Зависимость выживаемости больных от интрадиализных колебаний пульсового АД (анализ Каплана-Мейера).
При вторичном анализе в регрессионной модели Кокса была выявлена достоверная связь высокого преддиализного ПД (>75 мм.рт.ст.) с выживаемостью (HR=1,7 CI=1.3 - 2.6 p<0,001). В группах с разделением по интенсивности колебаний интрадиализного ПД во время процедуры ГД наибольшая смертность была выявлена в группах со снижением ПД более чем на 25 и в группе со снижением ПД в пределах от 15 до 25 мм.рт.ст. (HR=6,6 CI=1.34 - 26.16 p=0,037 и HR=6,2 CI=1.2 - 23.5 p=0,028). В группах со снижением ПД в пределах от 5 до 15 мм.рт.ст. была выявлена меньшая смертность, но она все равно оставалась высокой. (HR=5,6 CI=1.034 - 19.5 p=0,045). Умеренное снижение ПД, а также его небольшой рост во время ГД не показали достоверной связи с выживаемостью. Постдиализное ПД также не оказывало достоверного влияния на выживаемость больных.
Анализ данных выживаемости больных при разделении в зависимости от пред- и постдиализного уровня САД без корректировки на влияние ПД продемонстрирован на рис. 3-4. Наименьшая выживаемость была в группе с преддиализным САД>160 мм.рт.ст. (HR=1,6 CI=1.27 - 1,95 p<0,0001), тем не менее данные постдиализного САД в группе >160 мм.р.ст и в группе 140-159 мм.рт.ст. не показали статистической достоверности. При исследовании преддиализного и постдиализного САД с корректировкой на вариации ПД (рис. 5-6) наихудшую выживаемость демонстрировали пациенты в группах с преддиализным и постидиализным САД> 160 мм.рт.ст. HR=1,9 CI=1.04 - 2,95 p=0,024 и HR=1,84 CI=1,21 - 2,43 p=0,026, а так же преддиализным САД< 120 мм.рт.ст. HR=1,2 CI=1.01 - 1,89 p=0,007.
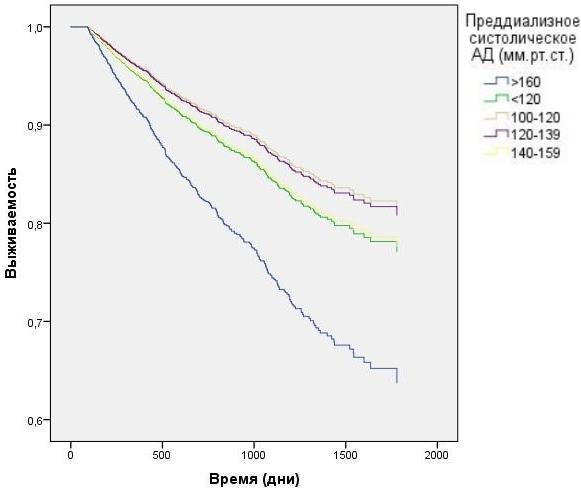
Рис. 3. Зависимость выживаемости ГД пациентов от преддиализного АД (модель Кокса).
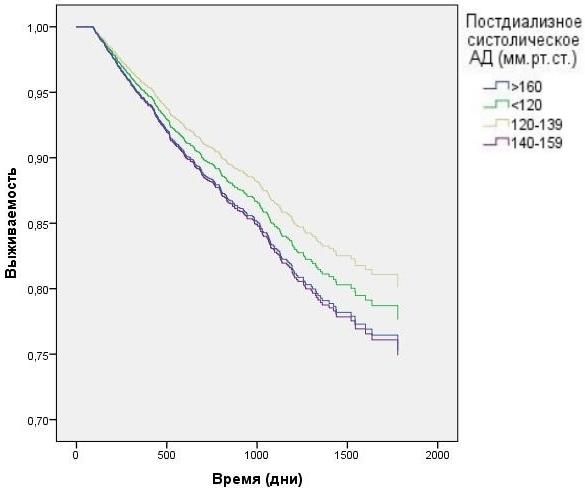
Рис. 4. Зависимость выживаемости ГД пациентов от постдиализного АД (модель Кокса).
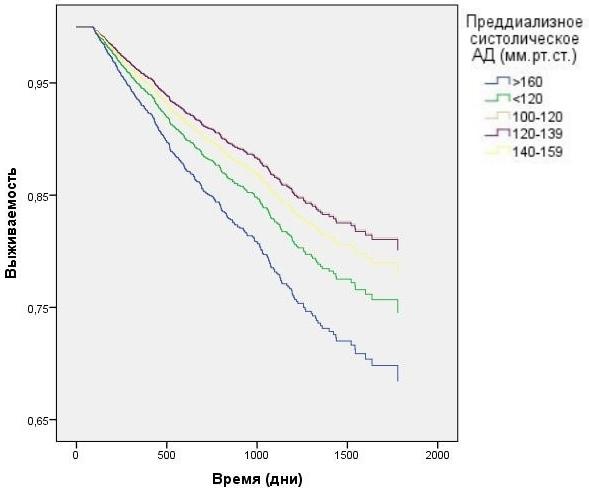
Рис. 5. Зависимость выживаемости ГД пациентов от преддиализного АД с учетом влияния вариаций ПД (модель Кокса).
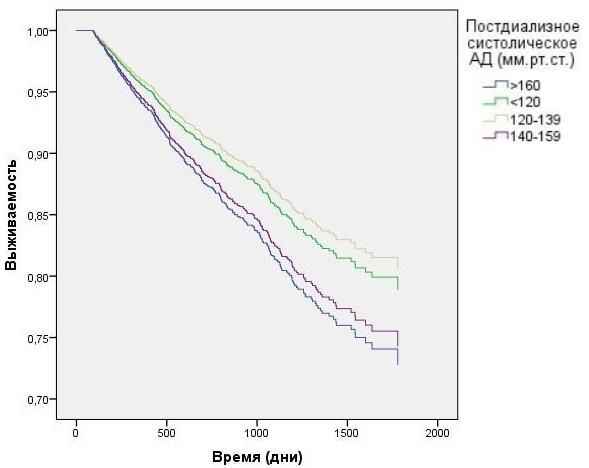
Рис. 6. Зависимость выживаемости ГД пациентов от постдиализного АД с учетом влияния вариаций ПД (модель Кокса).
Исследование среднего преддиализного АД с корректировкой на вариации ПД выявило наихудшую выживаемость у пациентов с преддиализной артериальной гипертензией (в группе со среднем АД, превышающим 105 мм.рт.ст.), по сравнению с группами, где отмечалось меньшее среднее АД (рис. 7) HR=1,3 CI=1.11 - 1,61 p=0,042. Скорость УФ, превышающая 13 мл/кг/час показала наихудшую выживаемость (рис. 8) HR=2,4 CI=1.51 - 4,36 p=0,001.
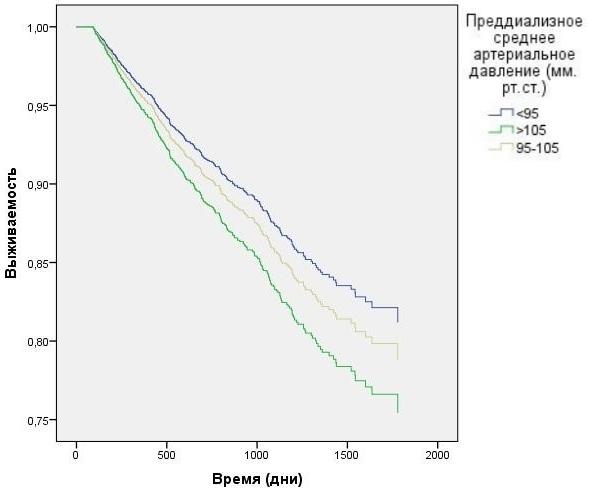
Рис. 7. Зависимость выживаемости ГД пациентов от преддиализного среднего АД с учетом влияния вариаций ПД (модель Кокса).
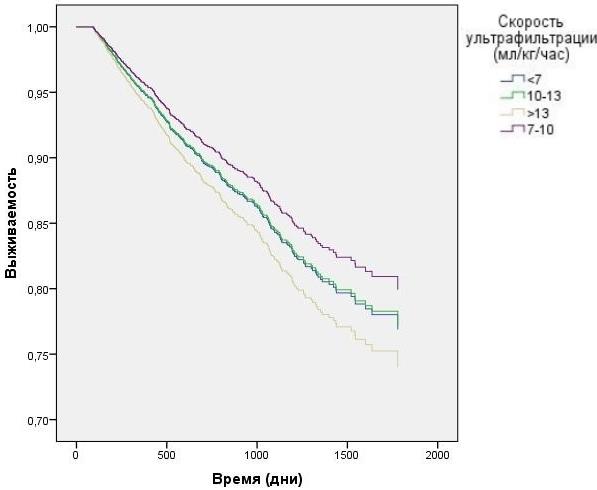
Рис. 8. Зависимость выживаемости ГД пациентов от скорости УФ с учетом влияния вариаций ПД (модель Кокса).
Обсуждение. Связь ПД с выживаемостью гемодиализных больных остается недостаточно изученной на сегодняшний день. В нашем исследовании мы установили связь между повышенным уровнем ПД и его вариациями на выживаемость больных, получающих ПГД, что совпадает с ранними исследованиями [26]. Нами уже было продемонстрировано влияние значительного снижения (>30 мм.рт.ст.) и повышения САД более, чем на 10 мм.рт.ст. во время гемодиализа на увеличения риска смерти [18, 19], вместе с тем, исследование влияния ПД, а также его колебаний во время процедуры ГД на выживаемость могут иметь еще большую прогностическую значимость. В ранних исследованиях было показано, что ПД является предиктором неблагоприятных исходов, не зависящих от САД в общей популяции. К примеру, при исследовании большой когорты лиц старше 50 лет повышенный уровень ПД был связан с увеличением сердечно-сосудистой смертности даже среди пациентов с нормальным САД [20]. Несколько других исследований также показали, что ПД является предиктором неблагоприятных сердечно-сосудистых событий и смертности у пациентов на ПГД [4,11], а недавние исследования свидетельствуют о том, что ПД является лучшим предиктором смерти и сердечно-сосудистых событий, чем другие параметры АД у больных на гемодиализе [21]. Мы установили связь между снижением ПД и улучшением краткосрочного прогноза выживаемости. В когортном исследовании с участием 438 ГД пациентов выявлено снижение смертности на 20% каждые 10 мм.рт.ст [17], что в целом согласуется с нашими результатами. Однако, снижение ПД может быть также следствием высоких темпов УФ, и тогда приводить к ухудшению исходов. В исследовании Boss W.J. такое снижение ПД на процедуре гемодиализа было прямо связано со скоростью УФ [22], что приводило к росту неблагоприятных исходов (сердечно-сосудистых событий), вследствие «оглушения миокарда», ухудшению перфузии миокарда, нарушению локальной сократимости миокарда и повышение смертности [23]. Вопреки данным Boss. W.J. мы не выявили наличие связи между темпами УФ и снижением ПД на диализе. Это можно объяснить различным составом пациентов, в частности возрастных различий, большей доли больных сахарным диабетом в цитируемой работе. Удаление жидкости во время процедуры ГД сильнее влияет на САД, чем на ДАД, что приводит к снижению ПД [24,25]. В наше исследование были включены все больные, как новые, так и ранее получавшие диализ, а его основные результаты в целом совпадают с ранее опубликованными литературными данными. Данное исследование проведено в большой когорте пациентов без предварительного отбора, с длительным периодом наблюдения, что приближает его результаты к реальной клинической практике.
Заключение. Достоверное влияние на выживаемость пациентов с ХБП 5Д имеют высокое преддиализное значение ПД, и его интрадиализное снижение более, чем на 25 мм.рт.ст., а также высокое как пред-, так и постдиализное САД, и низкое преддиализное САД (< 120 мм.рт.ст.) Установлено влияние среднего АД: высокое преддиализное среднее АД статистически значимо ухудшает прогноз пациентов на программном ГД. Продемонстрирована зависимость между высокими темпами ультрафильтрации и выживаемостью: выживаемость достоверно снижалась при темпах ультрафильтрации более чем 13 мл/кг/час.
