Установление факта тесной взаимосвязи простагландинов (ПГ) с внутриклеточными рецепторами - циклическими нуклеотидами (циклическим аденозинмонофосфатом (цАМФ) и циклическим гуанозинмонофосфатом (цГМФ)) и другими субстратами открыло реальную возможность управлять тонкими биохимическими механизмами и приступить к разработке новых принципов фармакотерапии [1, 2].
Привязка разрабатываемой нами тематики к ПГ связана с тремя причинами. Первая - альвеолярная гипоксия приводит к повышению синтеза ПГ, углубляясь в результате бронхоспазма. Вторая - повышение давления в малом круге кровообращения (при формировании хронического легочного сердца) при адаптации к условиям высокогорья находится под влиянием ПГ [3, 4]. И третья причина - под действием выскогорной гипоксии формируется тромбогеморрагический синдром, вызванный активацией процесса агрегации и адгезии тромбоцитов и что одним из наиболее эффективных ингибиторов агрегации тромбоцитов является простагландины группы Е (ПГЕ) [5-7].
Материал и методы исследования. Эксперименты проводились на 2 видах животных - 200 кроликах породы «шиншилла» в естественных условиях высокогорья на перевале Туя-Ашу (3200 м над уровнем моря).
Животным вводился простагландин ПГЕ2 внутривенно в дозе 0,25 мг/кг и определялись следующие показатели: осмотическое давление (ОД) мочи, крови, спиномозговой жидкости (СМЖ); содержание катехоламинов в плазме крови (адреналина, норадреналина, дофамина), состояние системы гемостаза, гистологические показатели, содержание жидкости в головном мозге и в ряде других органов, которые были ранее описаны [8].
Весь полученный фактический материал подвергнут компьютерной обработке с помощью пакета прикладных программ Microsoft Excel с расчетом критерия Стьюдента.
Результаты и обсуждение. Внутривенное введение ПГЕ2 животным в условиях низкогорья (770 м) задерживает жидкость во всех изучаемых органах и системах. Так, сухой остаток крови уменьшается на 14,8%, легких на 27,0% мышечной ткани на 19,4%. Аналогичная ситуация наблюдается также с тканями надпочечников и почек, сухой остаток которых снижается на 15,6% и 22,2% соответственно. Несколько меньшее количество жидкости задерживается в сером и белом веществе головного мозга (снижение составляет 12,4% и 14,4%). Тенденция к уменьшению сухого остатка наблюдается и в тканях гипоталамуса, мозжечка и продолговатого мозга.
Инфузия ПГЕ2 животным, находящимся в условиях высокогорья приводит к отечному состоянию практически всех органов и систем. По отношению к контрольной группе (3200 м) сухой остаток крови меньше на 33% тканей легких на 20,9% (Р<0,05), мышечной ткани на 4,4% (Р<0,05). По сравнению с опытной группой (770 м) сухой остаток в этих органах, напротив, возрастает (на 1,6%, 14,3% и 13,2% соответственно). Сходная картина имеет место в отношении тканей почек и надпочечников.
Наиболее значительное накопление жидкости наблюдается в сером и белом веществе головного мозга; если в условиях предгорья при введении ПГЕ2 сухой остаток снизился на 11,4% и 14,4%, то в условиях высокогорья (3200 м) уже 20,9% и 23,2% соответственно.
Падает величина сухого остатка гипоталамуса, мозжечка и продолговатого мозга: по отношению к контрольной группе (3200 м) - группой (770 м) - 11,4%, 20,6%, 13,6% соответственно.
Оценивая вышеприведенные показатели в абсолютных цифрах, это состояние можно квалифицировать как отек мозга.
Морфология. На гистологических препаратах видно, что инфузия простостиндина Е2 в условиях низкогорья приводит местами к сладжу эритроцитов и неоднородности кровенаполнения капилляров.
У кроликов опытной серии при инфузии ПГЕ2 отмечается значительная лейкоцитарная и микроглиальная реакция в белом и сером веществе мозга, в сосудах появляются тромбы, сосудистые изменения - большинство вен и капилляров подвергаются растяжению, эндотелиальные клетки окрашены слабо, отмечаются все стадии ишемического перерождения, в том числе вздутие, хроматолизис и образование фантомных клеток.
Таким образом, внутривенное введение ППЕ2 и в условиях низкогорья, и в условиях высокогорья приводит к задержке жидкости в организме, при этом факторы высокогорья углубляют отечные явления головного мозга.
Инфузия ППЕ2 снижает уровень катехоламинов в плазме крови. Так количество дофамина в плазме крови падает на 70,1%, норадреналина на 51,2%, а адреналина на 7,4% (табл.1).
Таблица 1. Показатели содержания катехоламинов плазмы крови и уровня осмотического давления у кроликов в условиях низкогорья и высокогорья при введении ПГЕ2 (М±m)

Примечание: здесь и далее * - Р<0,05.
Подъем животных в горы приводит к увеличению, в сравнении с интактной группой, концентрации адреналина, норадреналина и дофамина в плазме крови 254,7%, 132,8% и 23,8%. ПГЕ2 существенно модифицирует обмен катехоламинов организма в горах. Резко увеличивается уровень норадреналина и дофамина в плазме крови: по отношению к опытной группе концентрация их выше на 450,3% и на 538,1%.
В сравнении с контрольной группой (3200) уровень норадреналина больше на 15,5%, дофамина на 54,0%, а уровень адреналина меньше на 35,1%.
Таким образом, если введение ПГЕ2 в условиях низкогорья снижает концентрацию всех изучаемых катехоламинов, то при гипоксии уменьшается лишь уровень адреналина, а содержание норадреналина и дофамина увеличивается почти в 2 раза, что становится дополнительным неблагоприятным фактором, усугубляющим развитие отека мозга в горах.
Инфузия ПГЕ2 животным в условиях низкогорья сопровождается ростом ОД плазмы крови на 25,6%, снижением ОД мочи на 44,9% при постоянстве показателя СМЖ (табл. 1).
Сравнивая эти данные с показателями распределения жидкости в организме, можно отметить определенную закономерность. Задержка жидкости в организме связана с динамикой ОД. Видимо, высокое ОД плазмы крови увеличивая объем жидкости в сосудистом русле, обуславливает также снижение диуреза, тем самым препятствуя в некотрой степени накоплению жидкости в тканях.
При подъеме животных в горы и введении ПГЕ2 ОД плазмы крови их по отношению к интактной группе больше на 18,6%, мочи меньше на 18,1%, а СМЖ - на 13,9%.
По отношению к опытной группе (770м) значительно возрастает ОД мочи (на 48,8%) и отмечается снижением ОД СМЖ на 14,6%, плазма крови не меняется. При сравнении с контрольной группой ОД практически остается без динамики.
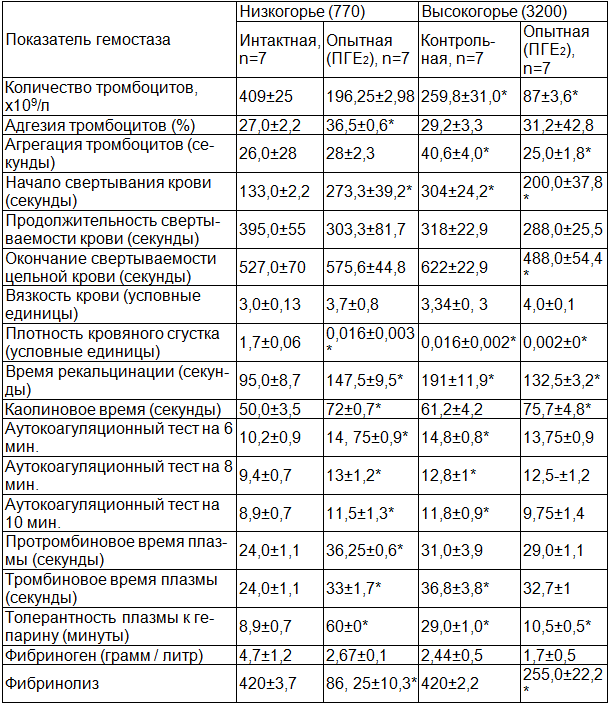
Свертывающая система крови. Внутривенное введение ПГЕ2 в условиях низкогорья (770 м) почти в 2 раза снижает уровень тромбоцитов (на 42,1%) с одновременной статистически достоверной интенсификацией процессов их адгезии (на 35,1%, при Р<0,05), что, видимо, связано с перераспределением циркулирующей крови и усилением ангитрофической функции тромбоцитов. При этом не происходит повышения агрегационных свойств тромбоцитов (табл. 2). Существенно удлиняется время начала свертывания крови, и, в меньшей степени, окончания свертывания, а продолжительность свертывания крови уменьшается. Вязкость крови достоверно не меняется. Плотность кровяного сгустка повышена.
Таблица 2. Состояние системы гемостаза у кроликов в условиях низкогорья и высокогорья при введении ПГЕ2 (М±m)
* - p < 0,05.
Эти изменения указывают на сдвиги в системе гемостаза в сторону гипокоагуляции, что подкрепляется значительным замедлением процесса рекальцификации и уменьшением показателей каолинового теста. На 6, 8 и 10 минутах наблюдается более медленное нарастание активности тромбопластина и тромбина. Анализ аутокоагуляционного теста позволяет, сравнивая состояние прокоагуляционного и антикоагуляционного звеньев гемостаза, сделать вывод о перевесе последнего.
Аналогичную динамику имеют и процессы вторичного гемостаза - удлиняется протромбиновое и тромбиновое время. Характерно, что на фоне этих изменений наблюдается увеличение времени толерантности плазмы крови к гепарину, указывающее на избыток в плазме крови антитромбина III.
Значительный сдвиг системы гемостаза в сторону гипокоагуляции, видимо, является следствием развивающегося диссеминированного внутрисосудистого свёртывания (ДВС). Это находит отражение в снижении количества тромбоцитов, концентрации фибриногена, который заблокирован продуктами фибринолиза. Содержание фибриногена уменьшается на 43,2%, а активность эуглобулинового фибринализа на 79,5% повышается, этаноловый тест не изменяется, протаминсульфатный тест становится положительным.
Таким образом, внутривенное введение ПГЕ2 в условиях низкогорья изменяет состояние первичного гемостаза, приводя к развитию реакции гипокоагуляции - второй фазы ДВС-синдрома.
У животных в условиях высокогорья с инфузией простагландина гp. E2 падает количество тромбоцитов на 78,2% в сравнении с интактной группой, но увеличивается процесс их адгезии. По отношению к опытной группе (770 м) количество тромбоцитов снижается в несколько меньшей степени (на 55,7%), процессы адгезии и повышены на 14,6% (Р<0,05) и агрегации 10,8% (Р<0,05). В сравнении с контрольной группой при введении ПГЕ2 более значительно уменьшается количество тромбоцитов (на 69,5%) и ускоряется процесс агрегации (на 38,5%). По отношению ко всем остальным группам укорачиваются все три фазы свертывания крови. Так при сопоставлении с опытной группой (770 м) начало свертывания крови уменьшается на 73,0 сек, продолжительность свертывания крови на 15,0 сек, окончание свертывания крови на 108,8 сек. При сравнении с контрольной группой уменьшаются 104,0; 33,0 и 134,0 сек. соответственно.
Вязкость крови имеет тенденцию к снижению, но это является достоверным. По сравнению с интактной группой время рекальцификации при введении ПГЕ2 ускоряется, а у каолинового времени, по сравнению с опытной группой (770 м), динамика незначительна. По отношению к контрольной группе введение ПГЕ2 меньше отражается на продолжительности времени рекальцификации, но способствует увеличению каолинового времени.
В ранжире с другими группами аутокоагуляционный тест политически не изменяется.
По отношению к контрольной группе, при введении ПГЕ2, в условиях высокогорья соответственно увеличиваются протромбиновое и тромбиновое время, а в контрольной группе динамика направлена в сторону гиперкоагуляционных изменений.
Подтверждается это при сравнении с опытной (770 м) и контрольной группами (3200 м), когда отмечается уменьшение показателя толерантности плазмы крови к гепарину.
Уровень фибриногена в сопоставлении с интактной группой снижается на 63,8%, с опытной (770 м) и контрольной (3200 м) примерно одинаково - на 30%.
В сравнении с интактной группой эуглобулиновый фибринолиз уменьшается на 39,7%, с контрольной группой (3200 м) на 40% увеличивается, по отношению к опытной группе (770 м) заторможен. Становятся положительными этаноловый и протамин-сульфатный тесты, возрастая в обоих случаях на 50%.
Таким образом, в условиях высокогорья введение ПГЕ2 вызывает изменение системы гемостаза, способствуя ускорению свертывания крови и увеличению вязкости крови, а судя по снижению количества тромбоцитов, концентрации фибриногена, появлению продуктов паракоагуляции (положительный этаналовый и протамин-сульфатный тест), эти изменения протекают по типу ДВС-синдрома. Активация фибринолиза носит вероятно, защитный характер.
