Введение. Известно, что монооксид азота (NO) является биорегулятором, обладающим многогранной биологической активностью в отношении различных процессов в живых системах (регуляция сосудистого тонуса [1, 5], нейротрансмиссия [9], апоптоз [7] и др.). В то же время показана и негативная роль данного соединения, преимущественно реализуемая через образование пероксинитрита [1, 5, 6]. Также продемонстрирована возможность развития в организме нитрозативного стресса [6]. В связи с этим принципиальную значимость приобретает вопрос о физиологическом уровне NO в биосистемах.
На протяжении последнего десятилетия отечественными и зарубежными учеными предпринимаются многочисленные попытки его определения прямыми и непрямыми методами [7, 8], однако на данный момент эта задача не решена. С учетом этого, проблема коррекции уровня соединения в биотканях и субстратах путем его экзогенного введения является дискутабельной [1, 2, 5, 9, 10], а вопрос дозозависимости эффекта NO в литературе практически не рассматривается. Кроме того, несмотря на возрастающий интерес исследователей к физиологии и биохимии оксида азота, имеются лишь единичные сведения о характере его влияния на энергетический обмен клеток [9]. С учетом этого целью работы служило изучение влияния различных концентраций NO на параметры энергетического обмена эритроцитов in vitro.
Материал и методы исследования. Объектом исследования явились образцы цельной крови здоровых доноров (n=14). Каждый образец был разделен на пять порций (по 5 мл), первая из которых являлась контрольной. Три другие порции обрабатывали NO-содержащей холодной плазмой (100 мл), генерированной на трех имеющихся мощностях использованного аппарата «Плазон» (минимальной - NOmin, средней – NOnorm и максимальной - NOmax, отличающихся скоростью газового потока: 1; 1,5 и 2 л/мин соответственно) путем барботажа в пробирке. Пятую пробу барботировали 100 мл газовой смеси, в которой поток NO-содержащей плазмы был предварительно разведен атмосферным воздухом (1:9).
Согласно инструкции прибора в выбранных условиях (расстояние, проходимое газом от сопла аппарата, 10 мм) концентрация NO в газовом потоке составила 800 мкг/л. Продолжительность барботажа – 2 минуты.
В донорской консервированной крови спектрофотометрически определяли активность лактатдегидрогеназы (ЛДГ) в прямой и обратной реакциях по методу Г.А. Кочетова (1980) [11]. Содержание белка устанавливали по модифицированному методу Лоури. Уровень лактата в плазме крови и эритроцитах определяли с помощью анализатора SuperGL Ambulance.
Для оценки сдвигов энергетического метаболизма использовали ряд параметров: коэффициент баланса энергетических реакций (КБЭР) и субстратной обеспеченности (КСО) [9, 12].
Полученные данные были обработаны в программном пакете Statistica 6.0.
Результаты и обсуждение. Первым компонентом проведенного анализа являлась оценка активности ЛДГ в прямой и обратной реакциях при действии различных концентраций NO (рис. 1). Установлено, что рассматриваемое соединение способствует активации обратной реакции фермента на фоне угнетения прямой вне зависимости от дозы агента. В то же время исходный газовый поток, содержащий NO, обусловливает существенно более выраженные изменения активности энзима, чем его десятикратное разведение (p<0,05). Однако следует подчеркнуть, что даже при использовании указанного разведения сдвиги рассматриваемого параметра относительно контрольного образца остаются значимыми (p<0,05). Это свидетельствует о наличии дозозависимого эффекта оксида азота на изучаемые показатели энергетического обмена.
Интересно заметить, что, несмотря на заявляемую производителем аппарата одинаковую концентрацию NO вне зависимости от мощности аппарата, выраженность сдвигов активности ЛДГ существенно варьирует при изменении режима генератора. С наших позиций, скорость прохождения газового потока через зону создания холодной плазмы, в которой непосредственно происходит электросинтез NO, является параметром, непосредственно обуславливающим действующую концентрацию последнего.
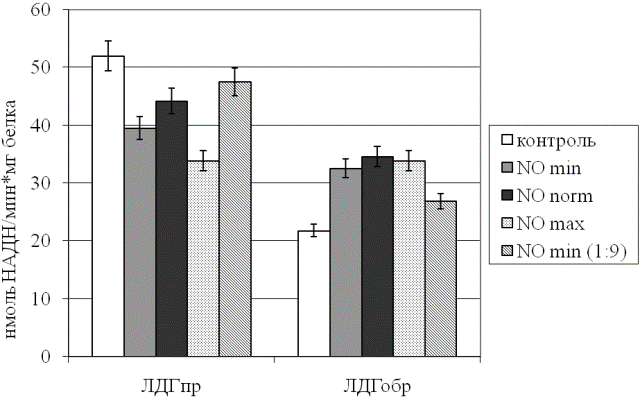
Рис. 1. Активность лактатдегидрогеназы эритроцитов в прямой (ЛДГпр) и обратной (ЛДГобр) реакциях при действии различных концентраций монооксида азот.
Изменения активности ЛДГ четко согласуются с результатом определения уровня его субстрата в эритроцитах (рис. 2). Несмотря на то, что он более стабилен, чем изучаемые энзиматические параметры, максимальное его отклонение от контрольных значений наблюдали при барботировании крови неразведенным потоком, содержащим оксид азота. В наименьшей степени уровень лактата эритроцитов повышался при обработке крови газовым потоком с десятикратно уменьшенной дозой NO, оставаясь значимо выше контрольных цифр (p<0,05 относительно интактного образца).
Для комплексной оценки характера сдвигов энергетического метаболизма при действии различных концентраций изучаемого агента были применены производные коэффициенты, одновременно учитывающие и активность ЛДГ в обеих реакциях, и уровень лактата (рис. 3 и 4).
Выявлено, что по КБЭР различные примененные дозы NO оказывают сопоставимое влияние на указанный параметр (рис. 3), тогда как десятикратное разведение газового потока демонстрирует более физиологичный уровень показателя (p<0,05 относительно контрольного образца и неразведенного потока).
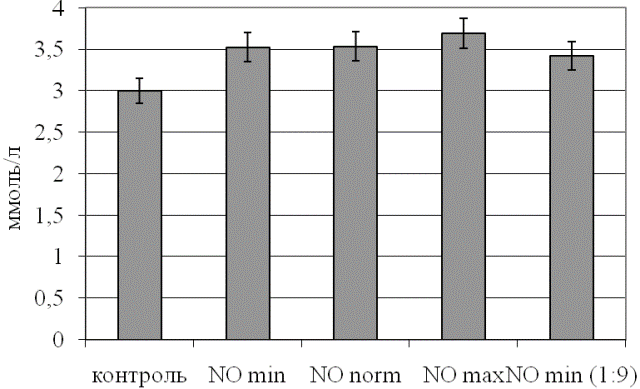
Рис. 2. Уровень лактата в эритроцитах при действии различных концентраций оксида азота.
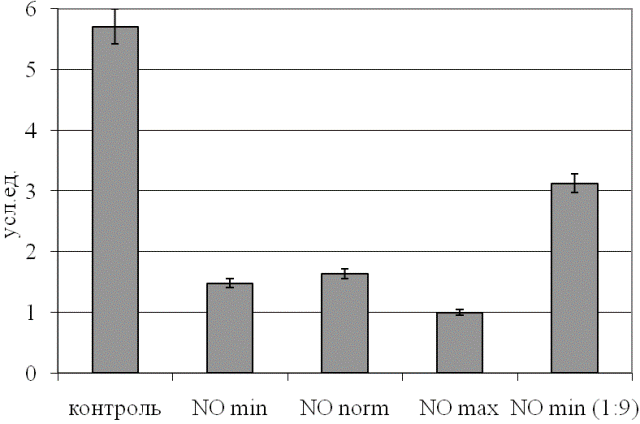
Рис. 3. Уровень коэффициента баланса энергетических реакций эритроцитов при действии NO.
Данная тенденция указывает на то, что реализованная в использованном аппарате концентрация NO является крайне высокой для крови, приводя к угнетению энергетического обмена эритроцитов, а снижение концентрации агента на порядок снижает интенсивность негативного эффекта.
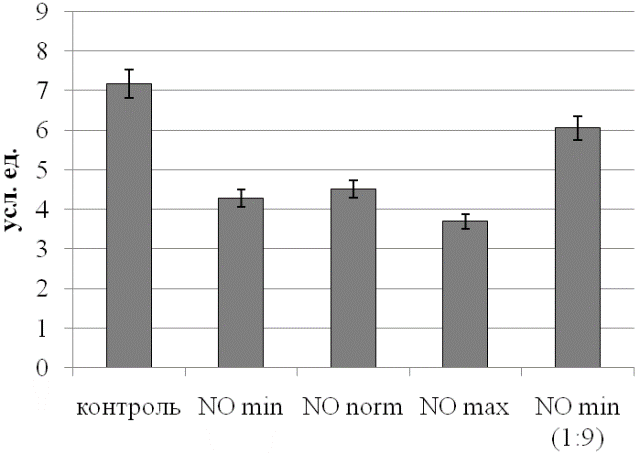
Рис. 4. Уровень коэффициента субстратного обеспечения эритроцитов при действии NO.
Аналогичная динамика просматривается и по коэффициенту субстратного обеспечения, характеризующему баланс ЛДГ и одного из его субстратов (рис. 4). Следует отметить, что по этому параметру контрольный и обработанный разведенным газовым потоком образцы отличаются минимально в абсолютных значениях, но статистически значимо (p<0,05).
Заключение. Таким образом, обработка крови газовым потоком, содержащим монооксид азота в концентрации 800 мкг/л угнетает энергетический метаболизм эритроцитов, но десятикратное его разведение снижает интенсивность воздействия, что свидетельствует о наличии дозозависимости эффекта. Эти данные позволяют предположить, что для оптимального воздействия NO на биологические жидкости более предпочтительным по сравнению с непосредственным нитроксилированием является введение агента в депонированной форме (например, в виде динитрозильных комплексов железа [10, 13]).
