Введение. Исследование генетических маркеров, отвечающих за наследственную предрасположенность к мультифакториальным заболеваниям, является одной из важнейших задач предиктивной (предсказательной) медицины и медицинской науки в целом [4,5,11].
Ряд эпидемиологических исследований на территории Бурятии показали этнические особенности в распространении многих многофакторных заболеваний и предрасполагающего к ним генетического полиморфизма. Особое место в таких исследованиях принадлежит изучению разнообразия генов, вовлеченных в сердечно-сосудистые заболевания, которые являются главной причиной смерти во всем мире [1,3,7].
Проблема цереброваскулярной патологии достаточно актуальна для Забайкальской популяции из-за относительно высокой и постоянно растущей заболеваемости (175,9 в 2009 г. до 200, 4 на 100 тыс. населения в 2012 г.) и смертности (с 48,1 в 2009 г. до 62,6 на 100 тыс. населения в 2012 г.).
Основными факторами, участвующими в развитии и прогрессировании сосудистой патологии мозга являются липидный дисбаланс, артериальная гипертензия и нарушения в системе гемостаза, в частности активация его сосудисто-тромбоцитарного звена. Полиморфизм генов тромбоцитарных рецепторов играет важнейшую роль в регуляции межклеточных взаимоотношений, а также степени активации тромбоцитов в кровотоке в норме и при воздействии естественных индукторов адгезии и агрегации, особенно это значимо при соматической патологии, требующей назначения дезагрегантов [2,10]. Однако эпидемиологические данные о носительстве полиморфизма основных белков тромбоцитарных рецепторов в различных этнических субпопуляциях на Забайкальских территориях весьма скудные.
Цель. Изучить характер распределения генотипов и аллелей генетического полиморфизма основных белков тромбоцитарных рецепторов (GpIa-807С>Т, GpIIIa-1565Т>С, GpIβα-434С>Т, P2RY12-Н1/Н2, SELP-1087 G>A) среди здоровых резидентов различных этнических групп наблюдаемой открытой популяции Забайкальского края.
Материалы и методы. В группу наблюдения вошли резиденты Забайкальского края различных этнических субпопуляций (русские (n=168), буряты (n=126)), в возрасте 41,6±11,7 лет. Данные об этической принадлежности получали путем опроса, включающего указание на национальную принадлежность предков до третьего поколения.
Методом исследования послужила полимеразная цепная реакция с детекцией продукта амплификации в агарозном геле (PCR-Ef) либо в режиме реального времени (PCR-RT) (амплификаторы «MAXYGENE», Германия; «ДТ-96», Россия) на геномной дезоксирибонуклеиновой кислоте (ДНК) лейкоцитов периферической крови (ДНК-экспресс кровь, НПФ «Литех», Москва) с использованием комплекта реагентов «КардиоГенетика тромбофилия» (ООО «ДНК-Технология», Москва) и отдельных SNP-наборов, соответствующих заявленному полиморфизму (НПФ «Литех», Москва).
Для оценки соответствия распределений генотипов ожидаемым значениям при равновесии Харди-Вайнберга и для сравнения распределений частот генотипов и аллелей в двух субпопуляциях и проверки нулевой гипотезы использовали критерий χ2, для сравнения аллелей - с поправкой Йетеса. Значения уровня p<0,05 рассматривались как статистически значимые. Статистическая обработка данных проводилась с использованием программного пакета Statistica 6.1 (StatSoft, USA).
Проведение исследования одобрено локальным этическим комитетом ГБОУ ВПО «Читинская государственная медицинская академия», протокол №2 от 06.11.2009 г.
Результаты и обсуждение. В ходе работы обнаружены все искомые мутации в гомо- и гетерозиготном состоянии. Для большинства полиморфизмов распределение генотипов соответствовало равновесию Харди-Вайнберга. Отклонение было показано в славянской этнической группе для варианта GpIa-807С>Т и в обеих исследуемых группах для GpIIIa-1565Т>С преимущественно за счет разности наблюдаемой и ожидаемой гетерозиготности.
Генетические особенности индивида в значительной степени определяются его принадлежностью к определенному географическому региону, этнической группе, популяции [11]. Бурятская группа с позиции этногенетики сегодня изучается довольно широко. У населения, проживающего на территории Республики Бурятия (бурят, русских) найдены территориальные и этнические особенности носительства полиморфных вариантов генов, показавших ассоциации с такими многофакторными заболеваниями как артериальная гипертензия, преэклампсия, хроническая обструктивная болезнь легких, сахарный диабет и т.д. [4,12].
Забайкальский край является довольно разнообразным в этническом отношении, однако основными группами все же являются фенотипические славяне, преимущественно русские (европеоиды) и буряты (монголоиды).
В работе Рябовой Т.И. (2003), касаемой эпидемиологии инсульта в популяции Читы, к сожалению, не выделен этнический фактор [9], однако, по данным литературы известно, что ишемический инсульт чаще регистрируется у европейцев, а геморрагические формы острого нарушения мозгового кровообращения – у представителей центрально-азиатского антропологического типа [6,8].
В силу этого в исследование включены полиморфизм генов-регуляторов работы тромбоцитов (исходя из того, что основной теорией развития ишемического инсульта является атеротромбоз).
Свои основные функции тромбоциты реализуют через многочисленные рецепторы, генетический полиморфизм которых способствует изменению поведения пластинок в целом. Гликопротеиновый комплекс GPIb/IX/V является основным тромбоцитарным рецептором для фактора Виллебранда [15,16]. К настоящему времени описаны полиморфные варианты гена в двух локусах. Так замена С на Т в положении 3550 гена GPIbα приводит к замене на метионин в позиции 145 (Thr145Met) [2,15], что, в свою очередь, вызывает конформационные изменения в области, примыкающей к месту связывания фактора фон Виллебранда с GPIbα и увеличивает степень и скорость адгезии. Комплекс GPIa/IIa (другое название – интегрин α2/β1) играет основную роль при адгезии тромбоцитов коллагену [10,14]. Нуклеотидная замена С на Т в позиции 807, не приводящая к замене аминокислоты, влияет на количество экспрессируемого GPIa. Оказалось, что 807Т вариант гена GPIa ассоциирован с повышением плотности рецептора на тромбоците и увеличением индуцируемой коллагеном агрегации тромбоцитов [2]. Гетеродимер GPIIb/IIIa (другое название – интегрин αIIb/β3) является поверхностным рецептором тромбоцитов, который активируется в результате передачи сигнала от рецепторов адгезии GPVI и GPIb/IX/V, рецепторов, связанных с G-белком (например, рецепторы тромбина PAR-1 и PAR-4), и рецепторов АДФ (P2Y1и P2Y12) и обеспечивает взаимодействие тромбоцита с фибриногеном плазмы крови. Мутация 33Р приводит к повышенной склонности тромбоцитов к агрегации с часто пониженной эффективностью аспирина [2,10]. В гене P2Y12 описано 4 мутации: 3 аминокислотные замены С139Т, T744С, G52Т и одну вставку ins801A. Все 4 варианта полиморфизма наследуются сцеплено и обуславливают формирование двух гаплотипов Н1 (С139, T744, G52 и отсутствие вставки) и Н2-гаплотип (139Т, 744С, 52Т , ins801A). Частота гаплотипов Н1 и Н2 в популяции составляет 0,86/0,14. Гаплотип Н2 ассоциируется с гиперактивностью тромбоцитов и снижением внутриклеточной концентрацией цАМФ [16]. В гене P-селектина идентифицировано 13 полиморфизмов: пять в 5'-фланкирующей области гена и восемь в экзонах, четыре из которых определяют замену аминокислот (ser290asn, asn562asp, leu599val, thr715pro, T741T (A/G)). Полиморфизм P-селектина (thr715pro) ассоциирован с увеличенным риском преждевременных коронарных заболеваний сердца [13].
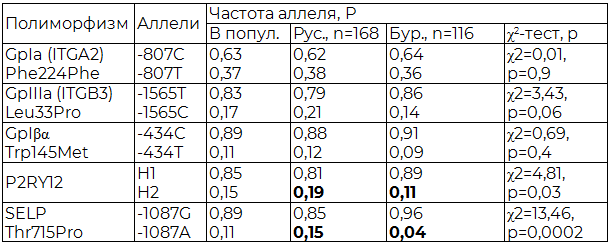
При изучении заявленного полиморфизма генов основных белков тромбоцитарных рецепторов обнаружено: наиболее часто встречаемый полиморфизм GpIa-807С>Т в популяции был найден с распределением генотипов: -807СС – 44,8%, -807СT – 36,9%, -807TТ – 18,3% и аллелей: -807С – 0,63, -807Т – 0,37.
По данным литературы аллель 807Т встречается у 35% представителей кавказской расы, чуть реже среди афроамериканцев и более характерен для коренного населения Америки [16]. В нашем исследовании в этнических субпопуляциях частотных различий в носительстве не выявлено (р>0,05) (табл. 1, 2).
Таблица 1. Частота встречаемости аллелей изучаемых полиморфизмов у резидентов Забайкальской популяции в этническом аспекте, n=294
Примечание: здесь и далее жирным шрифтом помечена достоверная вариабельность носительства аллелей в группах.
SNP-мутация ITGB3-33Leu>Pro зарегистрирована в Забайкалье со следующим соотношением генотипов: -33LeuLeu – 74,6%, -33LeuPro – 16,4%, -33ProPro – 9% и аллелей: -33Leu – 0,83, -33Pro – 0,17.
Среди исследуемых европейской национальности отмечалось некоторое преобладание лиц-носителей мутантного гомозиготного генотипа в сравнении с частотой последнего среди бурят (ITGB3-33ProPro 11% и 7% соответственно) с увеличением частоты аллеля ITGB3-33Pro (0,21 и 0,14 соответственно (р=0,06)).
Полиморфизм GP1BA-145Thr>Met наблюдался нами у исследуемых со следующей частотой генотипов: -145ThrThr – 79,1%, -145ThrMet – 20,4%, -145MetMet – 0,5%, и аллелей: -145Thr - 0,89, -145Met – 0,11. При сравнении показателей (частоты генотипов и аллелей) между изучаемыми подгруппами различия незначительны (р>0,05), однако носителем мутантного гомозиготного генотипа явились представители только европейской субпопуляции (табл. 1, 2).
Таблица 2. Частота встречаемости генотипов изучаемых полиморфизмов у резидентов Забайкальской популяции в этническом аспекте, n=294
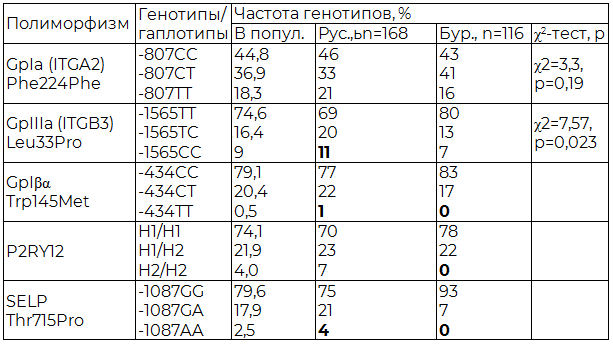
Частотное распределение SELP-7666G>A в рассматриваемой группе следующее: генотипов -7666GG - 79,6%, -7666GA – 17,9%, -7666AA – 2,5%; аллелей: -7666G – 0,89, -7666A – 0,11. Обращает внимание тот факт, что носительство гомозиготного генотипа SELP-7666AA зарегистрировано лишь у фенотипических славян - 4%, со значительным преобладанием частоты аллеля SELP-7666G в этой же подгруппе (р<0,0002).
При изучении распределения частот P2RY12-H1/H2 полиморфизма в Забайкалье получены следующие данные: H1/H1 – 74,1%, H1/H2 – 21,9%, H2/H2 – 4%; аллелей H1 – 0,85, H2 – 0,15. При сравнении в субпопуляциях значимо различалось лишь носительство мутантного генотипа P2RY12-H2/H2, так среди европеоидов он зарегистрирован в 7% случаях, среди бурят не выявлен (р<0,04).
Выводы. При изучении частот генетического полиморфизма основных белков тромбоцитарных рецепторов у резидентов Забайкальского края выявлены сравнимое с общепопуляционными данными распределение генотипов и аллелей. Между этническими группами Забайкальского края в носительстве изучаемых SNP существенных различий не обнаружено, однако обращает на себя внимание выявление гомозиготного состояния по мутантному аллелю генетического полиморфизма GpIβα-434ТТ, P2RY12-Н2/Н2, SELP-1087AА лишь у представителей европеоидной субпопуляции, что, вероятно, может быть причиной сравнительно наиболее часто регистрируемого у них ишемического нарушения мозгового кровообращения.
