Как известно, эритроциты млекопитающих несут на внешней поверхности своей мембраны отрицательный электрический заряд, создаваемый расположенными в гликокаликсе карбоксильными группами сиаловой кислоты. Общая величина электрического заряда эритроцита составляет, по расчетным данным, от 4 до 15 миллионов элементарных зарядов. [6, 12]
В то же время, было установлено, что адсорбция на поверхности эритроцита любых иных молекул, помимо сиаловых кислот, может изменять величину электрического заряда мембраны [3, 25].
В настоящее время доказана роль отрицательного заряда мембраны эритроцита в предотвращении спонтанной агрегации клеток. Удаление сиаловых кислот с поверхности эритроцита приводило к самопроизвольной или легко индуцируемой крупномолекулярными белками агрегации, причем эти изменения не зависели от выбранного буферного раствора [17, 19, 21, 26].
Известно, что типоспецифичность эритроцитов по системе групп крови АВО обеспечивают мукополисахаридные фрагменты, различные для разных групп крови. Так, первая группа крови характеризуется лишь базовым антигеном H, вторая группа определяется дополнительным антигеном: N-ацетил-D-галактозамин, третья – D-галактозой, а для четвертой свойственно наличие на мембране антигенов как второй, так и третьей групп крови [1, 4]
Распределение групповых антигенов на поверхности мембраны эритроцита неодинаково, по отношению к молекулам сиаловой кислоты. Так, сиаловая кислота может распределяться диффузно, или скоплениями с находящимся в центре или на периферии скопления типоспецифичным антигеном. Предполагается, что подобное взаиморасположение может определять стабильность сиаловой кислоты, что имеет значение в ряде патологических процессов [15]. Не исключено, что указанные структурные особенности могут влиять на электрические свойства эритроцита.
Целью настоящего исследования была исследование различий в электрическом заряде мембран эритроцитов, относящихся к разным группам крови системы АВО.
Материалы и методы
Прямое измерение заряда мембраны эритроцита представляется сложной задачей ввиду малых размеров клетки, сложностью ее геометрической формы и чувствительностью к условиям проведения опыта.
В качестве одного из методов изучения электрических свойств эритроцитов ранее предлагалось измерение их подвижности в постоянном электрическом поле. Было установлено, что скорость движения клеток в растворе электролита под воздействием электрического поля зависит от многих факторов, среди которых: величина pH, ионная сила раствора, структура мембраны клетки, в том числе расположенные на ней молекулы, температура среды и пр. От размеров, формы эритроцита, скорость его движения в электрическом поле не зависит, но значимо уменьшается при старении клеток, на основании чего было выдвинуто предположение о ведущей роли снижения электрического заряда мембраны эритроцита и уменьшения ее пластичности в процессах элиминации старых клеток из кровеносного русла [13, 14, 18, 27].
В настоящем исследовании был использован косвенный метод измерения различий в величине электрического заряда мембраны эритроцитов, посредством индуцированной агрегации эритроцитов хлористым лантаном
Положительно заряженные ионы лантана, обладают способностью связываться с карбоксильными группами сиаловых кислот, расположенных на мембране, инактивируя, таким образом, их отрицательный заряд. Потеря заряда эритроцитами приводит сначала к более плотному их взаиморасположению в растворе, а затем к агрегации. Подобный вариант агрегации маловероятен в условиях кровотока, но применим в экспериментах in vitro [9, 16, 22, 23].
Предполагается, что количество раствора хлористого лантана, необходимое для появления стойкой агрегации, будет зависеть от изначального электрического заряда поверхности эритроцита.
На метод индуцированной агрегации эритроцитов хлористым лантаном ранее был получен патент [5]. В данном исследовании методика автора патента была частично изменена: осаждение эритроцитов достигалось путем отстаивания, не центрифугирования, во избежание повреждения клеток и не использовались стабилизаторы мембран, поскольку в ряде работ отмечалось их влияние на электрический заряд мембраны клетки [10, 20, 24].
В работе использовались образцы крови здоровых доноров, все участвующие в исследовании лица предупреждены о характере и целях проводимого исследования, получено необходимое согласие. Дифференциация крови по группам системы АВО производилась с помощью стандартного набора цоликлонов, производства ООО «Медиклон», в условиях лицензированной клинической лаборатории ОГАУЗ «Санаторий Юбилейный»; для работы использовались группы крови О, А, В, АВ не содержащие антигенов систем Резус и Kell. Всего в опыте участвовало 9 образцов О (I) группы крови, 8 – второй А (II), 9 – третьей B (III) и 5 – четвертой AB (IV) группы крови.
Взятая кровь консервировалась посредством 3,8% раствора цитрата натрия, а затем дважды отмывалась десятикратным объемом раствора 0,9% раствора хлорида натрия.
Кровь хранилась при температуре 4-5оС. Опыт производился при комнатной температуре, на третий день после забора крови. Применялся реактив LaCl3*7H2O, производства ООО «Нева-реактив» г. Санкт-Петербург.
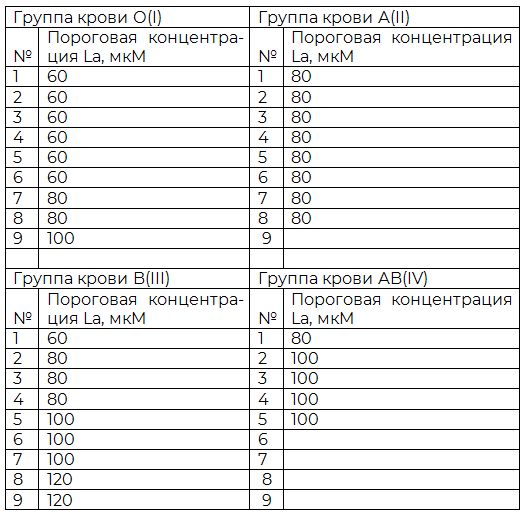
Во взвесь отмытых эритроцитов, разведенных физиологическим раствором 1:20, добавлялся реактив хлористого лантана, различных концентраций: 20, 40, 60, 80, 100, 120мкМ, затем отмечалось время наступления агрегации эритроцитов.
Оценка результатов индуцированной агрегации интактных эритроцитов производилась по различию во времени, необходимом для отчетливой агрегации в повышающихся концентрациях раствора хлорида лантана, для разных групп крови. Пороговым значением концентрации хлористого лантана принималась такая концентрация, при которой агрегация эритроцитов, наблюдаемая визуально и в микроскоп, наступала в течение 5 (пяти) секунд.
Результаты и обсуждение
Результаты индуцированной агрегации эритроцитов разных групп крови приведены в табл. 1.
Таблица 1. Результаты La-индуцированной агрегации эритроцитов
Оценка достоверности полученных различий производилась с помощью непараметрического критерия Манна-Уитни для малых выборок. Расчеты проводились с помощью программы STATISTICA.
Результаты сравнительной оценки индуцированной агрегации, попарно между группами крови, приведены далее, в ряде табл. 2.1 – 2.6. Серым цветом выделены критерии, соответствующие уровню значимости p≤0,05.
Таблица 2.1. Сравнение O (I) и A (II) групп
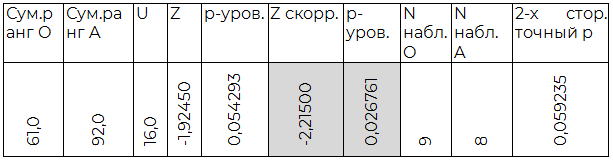
Таблица 2.2. Сравнение O (I) и B (III) групп
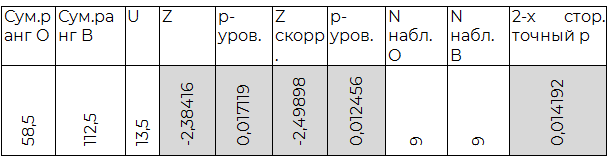
Таблица 2.3. Сравнение O (I) и AB (IV) групп
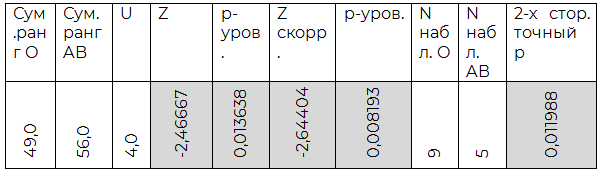
Таблица 2.4. Сравнение A (II) и B (III) групп
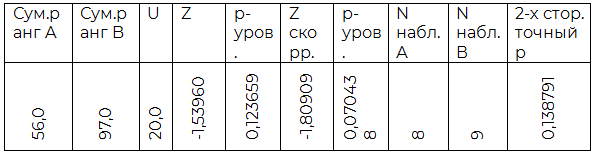
Таблица 2.5. Сравнение A (II) и AB (IV) групп
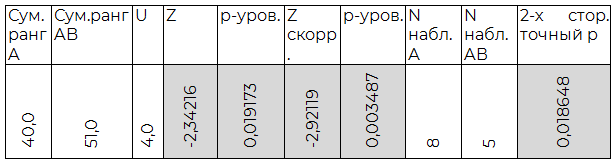
Таблица 2.6. Сравнение B (III) и AB (IV) групп
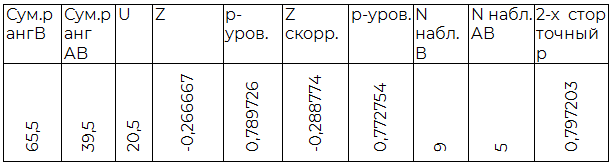
По результатам индуцированной хлористым лантаном агрегации O (I) группа крови достоверно отличается от всех прочих. Также, достоверным являются полученные различия между A(II) и AB(IV) группами крови. B(III) группа крови не показала существенных отличий в агрегации от прочих, кроме O (I).
Исходя из полученных данных, было предположено, что электрический заряд эритроцитов, относящихся к разным группам крови, неодинаков, причем наиболее нестойкими к воздействию ионов лантана выглядят эритроциты O (I) группы, а обладающие наиболее значительным зарядом мембраны – эритроциты AB (IV) группы.
Наиболее вероятной причиной полученных различий в индуцированной агрегации эритроцитов, принадлежащих к разным группам крови системы АВО, можно полагать различное содержание молекул сиаловой кислоты на поверхности клетки. Здесь также вероятно участие структурных особенностей расположения сиаловой кислоты на поверхности эритроцитов разных групп крови системы АВО.
Принимая во внимание, что силы электроотталкивания, возникающие между форменными элементами крови и сосудистой стенкой, имеют значение для агрегационной устойчивости эритроцитов в кровотоке, нельзя исключить значение данного стабилизирующего механизма для патологических состояний, сопровождающихся стазом, тромбозом и ишемией тканей. В подтверждение данного предположения, стоит отметить, что ранее, независимыми исследователями была выявлена определенная взаимосвязь частоты возникновения таких заболеваний, как ишемический инсульт и ишемическая болезнь сердца с групповой принадлежностью крови человека [2, 5, 8].
Эта взаимосвязь, не исключая иных причин, может быть обусловлена неодинаковым риском тромбообразования, за счет различий в электрическом заряде эритроцитов у лиц с различными группами крови системы АВО, в условиях патологически измененного кровотока и нарушения функции эндотелия сосудов.
