В развитии плацентарной недостаточности (ПН) важную роль играют инфекционные заболевания у женщин репродуктивного возраста [2-5,7,10]. Инфекция потенцирует развитие заболеваний у беременных женщин и новорожденных, способствуя развитию неблагоприятных перинатальных исходов. Удельный вес антенатальных потерь на протяжении последних лет остается на высоком уровне, без тенденции к снижению [1-3,6,8,9].
Целью настоящего исследования явилась попытка выявления ультразвуковых и клинико-морфологических маркеров-предикторов внутриутробной инфекции у плода (ВУИ).
Проведен ретроспективный анализ 467 ультразвуковых исследований в 59 случаях беременностей, сопровождавшихся верифицированной ВУИ плода - основная группа. Контрольная группа сформирована из 30 женщин с физиологически протекающей беременностью. В анализе случаев использованы: данные ультразвуковой диагностики ПН и ВУИ у плода, клиническая оценка состояния новорожденных, морфологическое и иммуногистохимическое исследование последа у женщин. Критериями исключения в исследовании явились: многоплодная беременность, беременность с наличием хромосомных заболеваний или пороков развития у плода, тяжелая преэклампсия.
Гестационный возраст, основной и контрольной группы варьировал от 23 до 40 недели. Основная группа разделена на 2 подгруппы: I подгруппа – беременные родившие на сроках 23-27,5 недель гестации (28 случаев), II подгруппа на сроках 28-40 недель гестации (31 женщина). Средний возраст беременных в обеих группах значимо не различался и составил 31,5±1,6 и 28,8±1,7 года, соответственно группам. Эхографическое обследование плодов произведено при помощи различных ультразвуковых приборов с использованием трансабдоминального и трансвагинального доступов, датчиками частотой 3,5-7,5 МГц. Контроль состояния фетоплацентарного комплекса проводился с помощью инструментальных методов исследования, которые включали в себя: ультразвуковое исследование (фетометрию, плацентометрию, оценку количества околоплодных вод), допплерометрическое исследование кровотока в артериях пуповины (АП), средней мозговой артерии (СМА), венозном протоке (ВП). Исследования проводились на сроках 6, 12, 19-21 и 32-33 неделях беременности. Состояние плодово-плацентарного кровотока определяли с помощью систолодиастолического соотношения (СДО) в указанных выше сосудах. Нарушения кровотока в основной группе диагностировались при выявлении увеличения численных значениях СДО выше 95% перцентиля его нормативных значений. Нарушение кровотока в СМА плода диагностировалось при выявлении снижения численных значений СДО менее 5% перцентили нормативных показателей [1,4].
Макроскопическое изучение последов провели по стандартной методике. После макроскопического изучения последов из центральной зоны плаценты вырезали кусочки ткани, которые фиксировали в 10% нейтральном формалине. Гистологическое исследование произвели на парафиновых срезах, окрашенных гематоксилином и эозином. При иммуногистохимическом исследовании последа для изучения процессов апоптоза и пролиферации были рассмотрены показатели: антиапоптозный белок Bcl-2 (B-cell lymphoma 2) и ядерный антиген пролиферирующих клеток Ki-67 (фактор пролиферации с индексом пролиферации 67). Иммуногистохимическое исследование материала проводили на парафиновых срезах. В качестве статистической обработки полученных результатов использованы стандартные методы описательной и вариационной статистики с применением линейного регрессионного анализа. Как достоверный критерий различий рассматривали р < 0,05. Статистическая обработка материалов проводилась с использованием статистических функций программы MS Excel’2000.
В I подгруппе основной группы синдром задержки роста плода (СЗРП) I степени выявлен у 5(17,9%) плодов, СЗРП II степени выявлен у 4(14,3%) плодов. Маловодие отмечено в 16(57,1%) наблюдений. В 14(46,2%) наблюдениях маловодие явилось первичным маркером ПН, следовательно, данный маркер, возможно, рассматривать в качестве предиктора нарушений, происходящих в плацентарном комплексе (табл. 1). В I подгруппе у 15 (53,6%) плодов выявлено снижение кровотока в АП. У 2(7,2%) плода выявлен реверсный кровоток в АП, в сочетании с наличием реверсного кровотока в ВП у 1(3,6%) плода. Централизация кровотока отмечена у 4(14,3%) плодов.
В I подгруппе у 2(7,2%) отмечено наличие тромбоза межворсинчатого пространства с локализацией по плодной поверхности плаценты. В 7(25%) наблюдениях I подгруппы отмечена неоднородность плаценты с участками повышенной эхогенности, расцененная нами как инфаркты. Данные участки имели различные размеры, варьируя от 0,5 см до 3,5 см в диаметре. Истончение плаценты для данного срока гестации отмечалось в 4(14,3%) наблюдениях у беременных I подгруппы. При проведении эхографического исследования у плодов I подгруппы, определялись различные сочетания ультразвуковых признаков, характерных для ВУИ. Выявлены: неиммунная водянка плода (отеки подкожной клетчатки, гидроторакс и гидроперикард, асцит) в 21,4% наблюдений, кальцификаты в паренхиматозных органах - 7,2%, нейроинфекция - 17,9%, гиперэхогенный кишечник - 25% и кардиомегалия в сочетании с кардиопатией - 25%. В большинстве наблюдений, отмечены различные сочетания приведенных ультразвуковых признаков (рис. 1, 2). В нашем исследовании СЗРП во всех случаях (100%) сочетался с маловодием.
Таблица 1. Состояние фетоплацентарной системы у беременных основной и контрольной групп по данным ультразвукового исследования
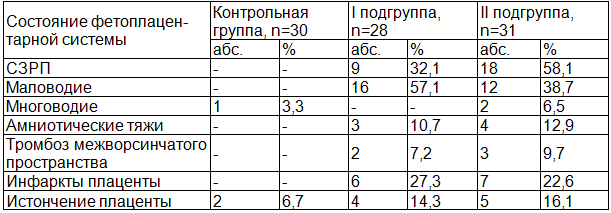
Во II подгруппе СЗРП I степени выявлен у 48,4% плодов, СЗРП II степени выявлен у 9,7% плодов. Маловодие отмечено в 38,7% наблюдениях, при этом в 29% данное осложнение являлось первичным маркером ПН. Многоводие отмечено в 2(6,5%) наблюдениях. У 13 (41,9%) плодов выявлено снижение кровотока в АП, а у 2(6,5%) - реверсный кровоток в АП, в сочетании с централизацией кровотока в СМА.
В II подгруппе в 9,7% наблюдениях отмечено наличие тромбоза межворсинчатого пространства, с локализацией по плодной поверхности плаценты. Истончение плаценты выявлено в 16,1% случаях. В 22,6% наблюдениях II подгруппы отмечена неоднородность плаценты с участками повышенной эхогенности 0,5 - 4 см в диаметре. Во время проведения ультразвукового исследования у плодов во II подгруппе определялись различные сочетания ультразвуковых признаков, характерных для ВУИ. К данным признакам отнесены: гидроцефалия - 9,7%; кальцификаты в перивентрикулярной области мозга плода - 9,7%, неимунная водянка плода - 12,9%, кальцификаты в паренхиматозных органах - 6,5%, кардиопатия -19,4%, гидроторакс - 9,7%, гиперэхогенный кишечник 29%, минерализационная васкулопатия в 9,7%, субэпендимальные кисты в передних рогах боковых желудочков мозга (от 0,5 до 0,8см) - 6,5% в сочетании с наличием септы в полости Верге.
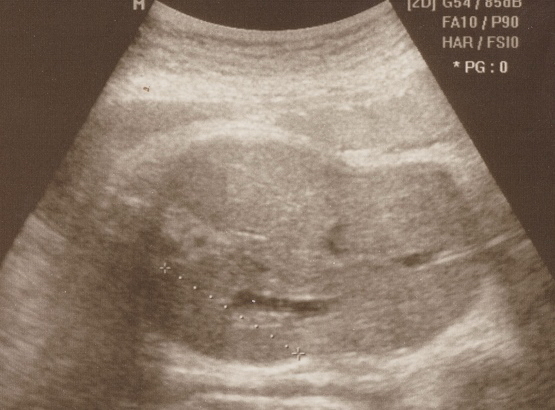
Рис. 1. Эхограмма. Внутриутробная вирусная инфекция. Беременность 27 недель. Поперечное сканирование плода. Маловодие. Спленомегалия. Гепатомегалия.
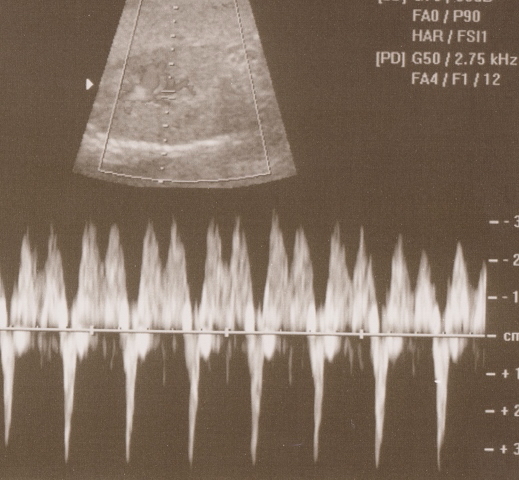
Рис. 2. Эхограмма. Внутриутробная инфекция. Плацентарная недостаточность. Ретроградный кровоток в венозном протоке.
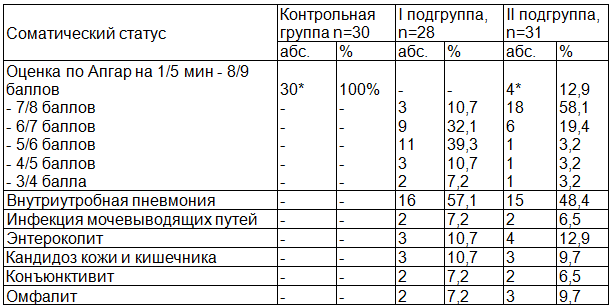
При анализе данных инфекционного анамнеза, нами отмечено, что для обеих подгрупп характерен высокий процент перенесенных детских инфекций (60,7% и 51,6% соответственно), что достоверно больше, чем в контрольной группе (p<0,05). У беременных основной группы выявлена высокая частота экстрагенитальных заболеваний: органов дыхания (35,7% и 48,4%), мочевыделительной систем (25% и 32,3%) по сравнению с контрольной группой (p<0,05). Особенности соматического анамнеза пациенток анализируемых групп представлены в табл. 2.
Таблица 2. Особенности соматического статуса беременных основной и контрольной групп
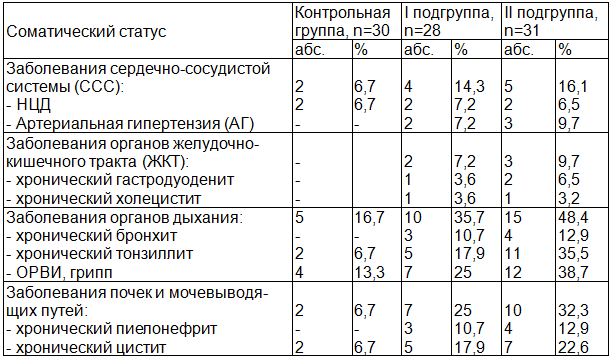
Характерна высокая частота прерывания беременности у женщин основной группы в анамнезе, в сравнении с контрольной группой (p<0,05). У 46,4% беременных I подгруппы в анамнезе имели место искусственные аборты, при этом более 2 абортов отмечено у 17,9% женщин, у 10,7% неразвивающаяся беременность. Во II подгруппе эти показатели составили 45,2%, 12,9%, 9,7% соответственно. В контрольной группе данных осложнений не выявлено. У женщин I подгруппы в 7,2% наблюдений в анамнезе установлено наличие самопроизвольного выкидыша на сроках 21 и 22 неделях в сочетании в 3,6% с гнойным хориоамнионитом (ХА). Во II подгруппе в 2 наблюдениях (9,7%) выявлена антенатальная гибель плода на сроках 25 и 27 неделях беременности. В обеих подгруппах основной группы достоверно чаще встречались осложнения гинекологического анамнеза, в сравнении с контрольной группой (p<0,05). Отмечена высокая частота хронического сальпингоофорита (21,4% и 19,4%), эктопии шейки матки (25% и 22,6%), инфекций передающихся половым путем (ИППП) – (57,1% и 48,4%) соответственно подгруппам основной группы.
При исследовании отделяемого из цервикального канала методом полимеразной цепной реакции (ПЦР) у беременных I и II подгруппы выявлены различные возбудители бактериальной инфекции. Так, Mycoplasma hominis в 10,7% и 16,1%, Ureaplasma urealyticum в 17,9% и 9,7%, Gardnerella vaginalis в 10,7% и 12,9%, Chlamydia trachomatis в 7,2% и 6,5% наблюдений соответственно подгруппам. Носительство вируса простого герпес (ВПГ) 1 или 2 типа выявлено в 25% и 25,8%, цитомегаловируса (ЦМВ) – в 21,4% и 19,4%, а папилломавируса – в 10,7% и 9,7% наблюдений соответственно подгруппам. При бактериологическом исследовании соскоба из цервикального канала в I подгруппе выявлен рост E.coli 7Log – в 14,3%, Streptococcus haemolyticus 7 Log – в 10,7%, Staphylococcus epidermidis 8Log в 21,4%, Enterobacterium spp. 6Log – в 10,7%, Candida glabrata 8 Log – в 25%, Enterococcus faecalis 7Log – в 21,4%, Klebsiella pneumoniae 7Log – в 7,2%, наблюдений. Staphylococcus hominis – 3,6%. У беременных II подгруппы выявлен рост Enterococcus faecium 6Log – в 12,9%, Enterococcus faecalis 6Log – в 16,1%, E.coli 7Log – в 16,1%, Streptococcus spp 7 Log – в 6,5% Streptococcus haemolyticus 7Log – в 9,7%, Staphylococcus epidermidis 8Log в 19,4%, Enterobacterium spp. 6Log – в 12,9%, Candida glabrata 6 Log – в 25,8%, Klebsiella pneumoniae 6Log – в 6,5%, наблюдений. Staphylococcus hominis – 12,9%.
Нами был проведен анализ течения беременности в обеих группах. Так, ранний токсикоз развился у беременных I подгруппы в 25%, а во II подгруппе – в 25,8%. Угроза раннего выкидыша отмечена у 28,6% I подгруппы и у 45,2% беременных во II подгруппе. Наличие данного осложнения связано с присутствием в обеих группах инфекционного процесса, который при восходящем пути инфицирования может способствовать развитию сократительной деятельности матки, провоцируя угрозу выкидыша, а в дальнейшем – угрозу преждевременных родов, частота которой во II триместре составляла в основной группе (57,1% и 45,2%) соответственно подгруппам. Истмико-цервикальная недостаточность (ИЦН) отмечена в I подгруппе у 21,4% (хирургическая коррекция проведена в 14,3% наблюдений), а во II подгруппе – у 12,9%. Среди других осложнений II триместра беременности отмечалось развитие анемии различной степени тяжести в 25% и 19,4% наблюдений в I и II подгруппах соответственно. Наследственная тромбофилия выявлена у 7,2% и 9,7% соответственно подгруппам. Первичная хроническая АГ выявлена в основной группе в 7,2% и 9,7%. В III триместре угроза преждевременных родов отмечена у 19,4%, а анемия – у 16,1% беременных II подгруппы. В основной группе обострение хронического цистита выявлено в 10,7% и 9,7%, обострение хронического пиелонефрита у 3,6% и 6,5% соответственно подгруппам.
Оценивая состояние новорожденных в обеих группах, выявлено, что масса новорожденных в I подгруппе в среднем составила 705 ± 135,7г, во II подгруппе 2452,0 + 129,17г, в контрольной группе 3498 ± 288г, рост – 31,1±3,9 см, 46 ±4,9 см и 51±1,2см. Отмечены статистически значимые изменения (p<0,05), связанные с ВУИ у новорожденных основной группы (табл. 3).
Таблица 3. Оценка состояния новорожденного в основной и контрольной группах
Примечание: * - значимость различий (р < 0,05) при сравнении показателей основной с контрольной группой.
При сравнении роста микробной флоры, обнаруженной у беременных основной группы при заборе материала из цервикального канала, выявлено в 42,9% I подгруппы и 45,2% II подгруппы совпадение микробного роста выявленного у новорожденных. Забор материала на микробиологическое исследование осуществлялся из зева, ануса, букального соскоба и содержимого трахеи новорожденного.
При исследовании последов I подгруппы признаки гнойного ХА выявлены в 57,1% наблюдениях. Виллозит сосудов хориальной площадки - в 46,4%, а фунизит – в 21,4% наблюдений. Острый диффузный базальный децидуит - в 50% наблюдений (рис. 3).
Причиной развития ВУИ новорожденного в I подгруппе – внутриутробной пневмонии, врожденного кандидоза кишечника и кожи, омфалита, инфекции мочевыводящих путей, энтероколита, возможно, явился гнойный ХА. Кроме того, по данным молекулярно-генетических методов исследований в ткани плаценты обнаружены Еnterobacterium spp. - 17,9% и Enterococcus spp. - 21,4%.
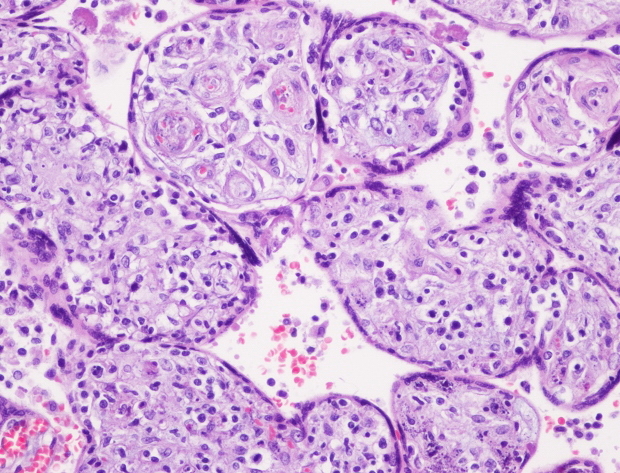
Рис. 3. Продуктивный виллозит. Увеличение 200.
В I подгруппе в 21,4% наблюдениях установлено соответствие строения ворсинчатого дерева сроку беременности. Ускоренное созревание ворсинчатого дерева отмечено в 28,6%, а отставание созревания ворсинчатого дерева – в 50% наблюдениях, при этом в структуре ворсинчатого дерева преобладали незрелые промежуточные ворсины. В 32,1% выявлены мелкие и крупные инфаркты ворсинчатого дерева, а в 17,9% – обнаружены крупные субхориальные тромбы, а также многочисленные скопления склерозированных ворсин и некрозы базальной пластинки.
Во II подгруппе в 70,9% наблюдениях выявлено соответствие степени зрелости ворсинчатого дерева сроку беременности, в 12,9% – отставание созревания ворсинчатого дерева и в 16,1% наблюдениях – ускоренное созревание ворсинчатого дерева. Признаки хронической маточно-плацентарной гипоксии (многочисленные мелкие терминальные ворсины с множеством синцитиальных почек) выявлены нами в 41,9% наблюдениях, острый диффузный ХА - в 41,9% наблюдениях, а острый некротический фунизит – в 16,1%. В 32,3% наблюдениях определялись крупные и мелкие инфаркты ворсинчатого дерева и многочисленные скопления бессосудистых ворсин, множественные тромбы межворсинчатого пространства - в 12,9%.
Ключевым механизм, контролирующим развитие плаценты являются апоптоз и пролиферация. С целью оценки значения плацентарного апоптоза и пролиферации в развитии плацентарной гипоксии проведено иммуногистохимическое исследование последов. Нами проведена оценка экспрессии антиапоптозного белка Bcl-2 в ткани плаценты, а так же пролиферация по уровню ядерного антигена пролиферирующих клеток Ki-67. В I подгруппе отмечена интенсивной степень экспрессии Bcl-2 в синцитиотрофобласте ворсин, синцитиальных узелках и в свободных симпластах (в среднем составила 2,48±0,11), которая по сравнению с контрольной группой увеличена в плацентарной ткани на 17%. Отмечена разная степень экспрессии в плацентах данной подгруппы: от умеренной (2 балла) до низкой (1 балл). Нами не получена значимая статистическая разница степени экспрессии Bcl-2 в I и II подгруппе, очевидно, данный процесс обусловлен в равной степени развитием плацентарной гипоксии в указанных подгруппах. В основной группе встречались многочисленные участки с полностью отсутствующей экспрессией данного белка, при наличии выраженной гипоксии в плацентах, свидетельствующих о крайне высоком уровне апоптоза и их разрушении. В контрольной группе экспрессия маркера пролиферации Ki-67 составляла 54,1±1,1 на 100 пролиферирующих клеток. В основной группе уровень экспрессии маркера пролиферации Ki-67 был достаточно низким, по сравнению с контрольной группой (p<0,05), однако без статистической значимости в обеих подгруппах (p>0,05) составляя в 8,2±1,6 на 100 клеток.
Таким образом, отягощенный анамнез матери (хронические инфекции), наличие в анамнезе прерывания беременности повышает риск развития ВУИ. На основании полученных нами результатов выявлено, что в прогнозировании тяжелых вариантов течения ПН инфекционного генеза являются ультразвуковые маркеры ВУИ у плода в сочетании с развитием СЗРП и начальными нарушениями фетоплацентарного кровотока. Снижение уровня пролиферации при плацентарной гипоксии потенцируют неблагоприятное влияние усиленного апоптоза в плаценте на трансплацентарный обмен.
