Актуальность. Преэклампсия (ПЭ) – тяжелейшее осложнение беременности, которое занимает лидирующую позицию среди причин материнской и перинатальной заболеваемости и смертности. ПЭ снижает качество последующей жизни женщины (высокая частота атеросклероза, сахарного диабета, сердечно-сосудистых заболеваний), нарушает психосоматическое развитие детей матерей с ПЭ, увеличивает риск развития у них в будущем соматических заболеваний [17,18]. Таким образом, ПЭ в настоящее время становится значимой медико-социальной проблемой.
ПЭ называют болезнью теорий, так природу этого клинического синдрома пытались объяснить самыми разными причинами - поражением почек, эндокринными изменениями, иммунологической несовместимостью, инфекциями, аутоиммунной патологией, сосудистыми и эндотелиальными дисфункциями и др. Каждая отдельно взятая теория не может охватить все многообразие клиники, но многие из перечисленных факторов реально участвуют в патогенезе происходящих при ПЭ нарушений. Согласно наиболее признанной современной гипотезе, причиной ПЭ является нарушение процессов формирования плаценты в самые ранние сроки гестации [3,7,23,24]. Вследствие аномальной плацентации и нарушения перфузии в плаценте высвобождаются факторы, вызывающие распространенную эндотелиальную дисфункцию и синдром системного воспалительного ответа (ССВО), приводящие к полиорганной недостаточности [3,7,14,20,22,23,24].
К настоящему времени накоплены значительные клинические данные, подтверждающие тесную связь механизмов воспаления и процессов коагуляции. Установлено, что компоненты системы гемостаза одновременно являются медиаторами воспаления [12]. Ингибитор активатора плазминогена (PAI-I) является центральным звеном фибринолитической системы, ингибирует урокиназу, протеин-С и тканевой активатор плазминогена. PAI-1 обладает способностью повышать уровень проатерогенных липидов, может являться ключевой причиной сосудистой патологии. Мутация PAI-1 675 4G/5G ассоциируется с повышенной PAI-1 активностью, в случае присутствия в гомозиготном состоянии приводит к повышению депозиции фибрина и нарушению процесса фибринолиза, увеличивает риск тромбозов в 1,7 раз. Кроме генетических существуют и приобретенные факторы, повышающие секрецию PAI-1 - глюкоза, инсулин, интерлейкин-1, фактор некроза опухоли α (TNF-α), глюкокортикоиды, ангиотензин II, «нагруженные» триглицеридами липопротеины низкой плотности (ЛПНП) и окисленные ЛПНП. Как показали результаты исследований последних лет, жировая ткань – это диффузная эндокринная железа, которая обладает ауто-, пара-, эндокринной функцией и секретирует целый спектр гормонов и биологически активных веществ, в т. ч. ангиотензин II, цитокины, TNF-α, PAI, которые могут вызвать развитие сопутствующих ожирению осложнений, в том числе гипертензии и инсулинорезистентности. Действительно, в последние годы, обнаружены ассоциации между повышенным уровнем PAI-1 и метаболическим синдромом, компонентами которого в том числе являются ожирение, артериальная гипертензия, дислипидемия, инсулинорезистентность [9,11,12,15,16,19,26]. Пшеничникова Е.Б., Пшеничникова Т.Б., Макацария А.Д. (2006 г.) установили, что у женщин с повышенным индексом массы тела (ИМТ) в 92% случаев выявляется мутация PAI-1 (гомозиготная форма достоверно чаще) [8].
Таким образом, изучение полиморфизма PAI-1 675 4G/5G как возможного предиктора развития ПЭ, является актуальным на современном этапе.
Целью настоящего исследования явилось изучение частоты полиморфизма PAI-1 675 4G/5G и маркеров системного воспалительного ответа при беременности, осложненной преэклампсией.
Материалы и методы исследования. Нами проведено исследование «случай-контроль» 44 беременных женщин, которые получали стационарное лечение в родильном доме Клиники ГБОУ ВПО ЮУГМУ Минздрава России. Критерием включения беременных в исследование явилось информированное согласие женщины на участие в исследовании. Критерии исключения: онкологические заболевания, ВИЧ-инфекция, туберкулез, тяжелая соматическая патология, психические заболевания, хронический алкоголизм, наркомания. План исследования соответствует законодательству РФ, международным этическим нормам и нормативным документам исследовательских организаций, а также одобрен этическим комитетом ГБОУ ВПО ЮУГМУ Минздрава России. Изучены особенности течения беременности и исходы родов. Клинико-лабораторное исследование беременных проводилось в третьем триместре беременности.
В зависимости от наличия/отсутствия гестационного осложнения ПЭ и степени ее тяжести [3,10] выделены: 1 группа (контрольная) – 14 женщин, течение беременности которых не осложнилось развитием ПЭ; 2 группа – 16 беременных с умеренной ПЭ; 3 группа – 14 пациенток с тяжелой ПЭ. Средний возраст женщин 1-ой группы составил 27,00±1,67 лет, 2-ой - 27,63±1,05, 3-ей - 30,36±1,64.
У всех беременных, которые участвовали в исследовании определены: высокочувствительный С-реактивный белок (hsСРБ) - иммунотурбидиметрический метод с латексным усилением (DiaSys, Германия); эндотоксин – LAL-тест хромогенный метод определения по конечной точке (Hycult biotech, США); триглицериды, холестерин общий - колориметрический ферментативный энзиматический метод (Human, Германия); липопротеины высокой плотности (ЛПВП) - колориметрический ферментативный энзиматический метод с предварительным осаждением липопротеинов низкой плотности (ЛПНП) и хиломикронов (Human, Германия).
С целью изучения мутаций гена PAI-1 675 4G/5G проведена полимеразная цепная реакция (ПЦР) с использованием комплекта реагентов для амплификации «SNP-экспресс» фирмы НПО «Литех» (г. Москва) на аппарате «Терцик» («ДНК-технология», Россия).
Все статистические расчеты были выполнены с помощью пакетов программ: SPSS 12.1, Statistica for Windows 6.0, STADIA 6.3 prof. Для определения средних тенденций использовали методы описательной статистики с получением оценок математических ожиданий, дисперсий и мод всех переменных во всех обследуемых группах. Для оценки различий между группами обследуемых применен аппарат проверки статистических гипотез с использованием критериев Манна-Уитни, Хи-квадрат Пирсона, отношение правдоподобия, линейно-линейная связь, коэффициент сопряженности, Лямбда, Тау Гудмена и Краскала, коэффициент неопределенности при уровне значимости критерия 0,05. Для изучения степени корреляционной зависимости между показателями использовался непараметрический корреляционный анализ с расчетом коэффициента непараметрической корреляции Спирмена.
Результаты исследования и их обсуждение. Результаты изучения частоты встречаемости PAI-1 675 4G/5G в популяции Российской Федерации неоднозначны - от 20% до 68% [4,12], тем более для Уральского региона, расположенного на границе Европы и Азии. При физиологическом течении беременности по данным Бицадзе В.О. и соавторов (2003 г.) частота мутации PAI-I 4G/5G составляет 16% (гомозиготы - 4%) [5], Пшеничниковой Е.Б. и соавторов (2006 г.) - 23,3% (гетерозиготы - 100%) [8], Вереиной Н.К. (2012 г.) - 56,7% (гомозиготы - 6,7%) [2]. В нашем исследовании (таблица 1) обращает на себя внимание достаточно высокий процент (64,2%) полиморфизма PAI-1 675 4G/5G (1 случай гомозиготной формы) у женщин контрольной группы.
Таблица 1. Структура полиморфизмов PAI-I беременных контрольной и клинических групп, n (%)
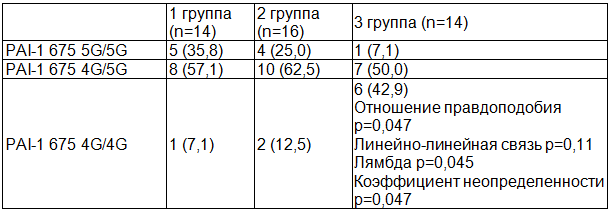
Такие результаты, возможно, связаны с тем, что критерием формирования группы контроля в настоящем исследовании было не физиологическое течение беременности, а отсутствие ПЭ. Однако установлено, что частотная характеристика полиморфизмов фибринолитического звена гемостаза имеет тенденцию к нарастанию по мере приближения к Азиатской части России, в том числе, в Уральском регионе [4].
Согласно данным литературы [12], у беременных с мутацией PAI-1 675 4G/5G в результате гипофибринолиза нарушается дифференцировка и из-за снижения протеазной активности инвазия трофобласта с формированием «эндотелиального» феномена плацентарной недостаточности и ПЭ. Действительно, в результате нашего исследования (таблица 1), у 92,9% пациенток с тяжелыми формами ПЭ выявлены мутации PAI-1 675 4G/5G, гомозиготные варианты зарегистрированы в 57,1% случаев, что оказалось достоверно больше в сравнении с 1 и 2 группами. Однако по данным Бицадзе В.О. и соавторов (2003 г.) при беременности, осложненной ПЭ, эти варианты мутации встречаются в 49,1% случаев (гомозиготы 29,1% и гетерозиготы 20%) [5]. По данным Вереиной Н.К. (2012 г.) установлено, что в популяции женщин Уральского региона с экстрагенитальными и акушерскими факторами тромботического риска частота PAI-1 675 4G/5G составила 70,8% (гомозиготы - 22,1%) [2]. Интересные данные получили Пшеничникова Т.Б. и соавторы (2006 г.): 92,2% женщин с метаболическим синдромом имели полиморфизм PAI-1 675 4G/5G (84,5% - гомозигота), их акушерский анамнез в 75,3% случаев был отягощен тяжелой ПЭ [9].
Интересно, что продукция PAI-1 увеличивается под действием важнейшего маркера ССВО СРБ. Кроме того, PAI-1 сам является белком острой фазы. Такая закономерность выявлена у пациентов с метаболическим синдромом, сахарным диабетом, атеросклерозом [12]. Эти данные доказывают связь процессов воспаления и коагуляции при данных патологиях. Мы изучили уровень маркеров системного воспалительного ответа (hsСРБ, эндотоксин) при ПЭ. Установлено, что указанные показатели у пациенток с ПЭ оказались достоверно выше в сравнении с группой контроля (табл. 2), уровень маркеров ССВО был наибольший при тяжелой ПЭ.
Таблица 2. Уровень эндотоксина и hsСРБ у беременных контрольной и клинических групп (использован критерий Манна-Уитни)
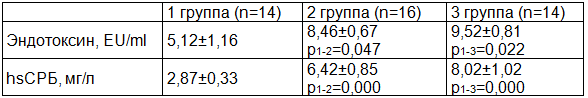
Мы решили изучить степень корреляционной связи полиморфизмов гена PAI-1 с уровнем маркеров системного воспалительного ответа (hsСРБ, эндотоксин). Установлены положительные корреляционные связи уровня hsСРБ с частотой гомозиготных форм мутаций PAI-1 675 4G/4G (r=0,307*, р=0,043) и отрицательные корреляционные связи уровня эндотоксина с частотой PAI-1 5G/5G (r=0,321*, р=0,033).
Согласно данным литературы, при ПЭ содержание триглицеридов, неэтерифицированных жирных кислот, общего холестерина, ЛПОНП, ЛПНП значительно выше, а уровень ЛПВП ниже, чем при неосложненной беременности [12]. Результаты изучения показателей липидограммы представлены в табл. 3.
Таблица 3. Показатели липидограммы беременных контрольной и клинических групп (использован критерий Манна-Уитни)
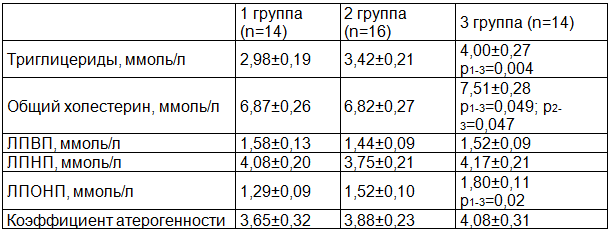
В результате нашего исследования установлено, что у беременных с тяжелой ПЭ уровень триглицеридов, общего холестерина, ЛПНП, ЛПОНП, коэффициент атерогенности были больше, чем в других группах (табл. 3), достоверные отличия получены по показателям триглицериды и общий холестерин.
Триглицериды активно накапливаются в эндотелиальных клетках, способствуя их повреждению. Для ПЭ характерно появление уникальных липопротеинов, нагруженных триглицеридами, отличных от ЛПОНП. Механизм таких изменений не разгадан [12]. Эти патологические процессы связывают с запуском опосредованного цитокинами оксидативного ответа, вызванного ишемией плаценты и/или активизированными лейкоцитами [1]. Установлено, что уровень ЛПНП у беременных, у которых впоследствии разовьется ПЭ, существенно повышается уже на 10-ой неделе беременности [21]. Липиды являются хорошим субстратом для ПОЛ и, следовательно, способствуют эндотелиальной дисфункции [2,12,25]. При ПЭ в условиях плацентарной ишемии и дислипидемии количество продуктов ПОЛ резко увеличивается, что способствует нарастанию степени тяжести ПЭ [1,12]. Таким образом, нарушение липидного обмена и оксидативный стресс при ПЭ тесно связаны между собой, а также с гипоксией, вызываемой ишемией плаценты и иммунной дезадаптацией [1]. Результаты настоящей работы подтверждают мнение современных ученых о роли дислипидемии в развитии ПЭ и согласуются с данными наших предыдущих исследований [6].
Согласно данным литературы, от генотипа PAI-1 зависит его регуляция липопротеином и ЛПНП на уровне транскрипции. Установлено, что аллель 4G PAI-1 ассоциируется с более низким уровнем ЛПВП в сравнении с носителями аллеля 5G [13]. Мы изучили степень корреляционной связи полиморфизмов гена PAI-1 с показателями липидограммы как маркерами системного воспалительного ответа. Установлены положительные корреляционные связи уровней общего холестерина (r=0,351*, р=0,02), ЛПНП (r=0,306*, р=0,043), ЛПОНП (r=0,301*, р=0,049) с частотой PAI-1 675 4G/4G. Таким образом, результаты нашего исследования позволяют сделать вывод, что полиморфизм гена PAI-1, вероятно, связан с развитием состояния гиперлипидемии и смещением баланса в пользу атерогенных липопротеинов, что может являться причиной формирования и/или нарастания тяжести ПЭ во время беременности.
С целью изучения возможности использования полиморфизма PAI-1 675 4G/5G в качестве вероятного предиктора ПЭ проведен непараметрический корреляционный анализ с расчетом коэффициента непараметрической корреляции Спирмена. Установлены положительные корреляционные связи PAI-1 675 4G/4G с частотой и тяжестью ПЭ (r=0,353*, р=0,019).
Выводы
1. У беременных с тяжелой преэклампсией выявлена высокая частота полиморфизма PAI-1 675 4G/5G (92,9%), в том числе гомозиготных вариантов PAI-1 675 4G/4G (57,1%).
2. Уровень маркеров системного воспалительного ответа (hsСРБ, эндотоксин) у пациенток с преэклампсией достоверно увеличен (особенно при тяжелой преэклампсии). Установлены положительные корреляционные связи уровня hsСРБ с частотой PAI-1 675 4G/4G (r=0,307*, р=0,043) и отрицательные - уровня эндотоксина с частотой PAI-1 5G/5G (r=0,321*, р=0,033).
3. При тяжелой преэклампсии повышены показатели триглицеридов и общего холестерина. Выявлены положительные корреляционные связи уровней общего холестерина, липопротеинов низкой и очень низкой плотности с наличием полиморфизма PAI-1 675 4G/4G.
4. Установлены положительные корреляционные связи PAI-1 675 4G/4G с частотой и тяжестью ПЭ (r=0,353*, р=0,019), что свидетельствует о возможности использования данного маркера как вероятного предиктора преэклампсии.
