Актуальность. Преэклампсия (ПЭ) остается серьезной медико-социальной проблемой во всем мире, являясь одной из основных причин материнской и перинатальной заболеваемости и смертности [5,8]. Согласно наиболее признанной гипотезе, причиной ПЭ является нарушение процессов формирования плаценты в самые ранние сроки гестации, что связывают с нарушением ремоделирования спиральных артерий [5,21]. Вследствие аномальной плацентации и нарушения перфузии в плаценте высвобождаются факторы, вызывающие распространенную эндотелиальную дисфункцию и синдром системного воспалительного ответа, приводящие к полиорганной недостаточности [5,19]. Таким образом, формирование ПЭ происходит на ранних сроках беременности: ряд предрасполагающих факторов приводят к нарушению инвазии трофобласта, развитию недостаточности маточно-плацентарного кровотока и ишемии плаценты [10]. В качестве вероятных предикторов ПЭ на сегодняшний день рассматривается комбинация тестов, включающая допплерометрию в маточных артериях, ультразвуковую оценку структуры плаценты, биохимические тесты [5].
Плацента человека играет основополагающую роль в нормальном течении беременности. При этом наиболее важной функцией является поддержание физиологического равновесия между матерью и плодом. Эндогенный или экзогенный стресс стимулирует активный ответ плаценты на неблагоприятные условия [17], поэтому большой интерес представляет изучение плацентарных и эндометриальных белков, так называемых «белков зоны беременности», выполняющих роль гормонов, ферментов, проферментов, рецепторов, факторов роста и иммунорегуляторных агентов [18,20]. Изучение плацентарных белков дает новый клинический взгляд на их функцию и роль в развитии беременности. Особое значение из веществ, продуцируемых плацентой, имеют плацентарные гормоны и белки, в частности трофобластический бета-1-гликопротеин (ТБГ), плацентарный лактоген (ПЛ), свободный эстриол (Е3).
Целью настоящего исследования является оценка эффективности использования трофобластического бета-1-гликопротеина, плацентарного лактогена, свободного эстриола в диагностике плацентарной недостаточности при преэклампсии.
Материалы и методы исследования. Проведено исследование «случай-контроль» 44 беременных женщин, которые получали стационарное лечение в родильном доме Клиники ГБОУ ВПО ЮУГМУ Минздрава России. Критерием включения беременных в исследование явилось информированное согласие женщины на участие в исследовании. Критерии исключения: онкозаболевания, ВИЧ-инфекция, туберкулез, тяжелая соматическая патология, психические заболевания, алкоголизм, наркомания. План исследования соответствует законодательству РФ, международным этическим нормам, нормативным документам исследовательских организаций, одобрен этическим комитетом ГБОУ ВПО ЮУГМУ. Изучены особенности течения беременности и исходы родов, оценены уровни плацентарных белков ТБГ, ПЛ, Е3.
В зависимости от наличия/отсутствия ПЭ и степени ее тяжести [5] выделены: 1 группа (контрольная) – 14 женщин, течение беременности которых не осложнилось развитием ПЭ; 2 группа – 16 беременных с умеренной ПЭ; 3 группа – 14 пациенток с тяжелой ПЭ. Средний возраст женщин 1 группы составил 27,00±1,67 лет, 2 - 27,63±1,05, 3 - 30,36±1,64.
Иммунобиохимическое исследование. ТБГ - твердофазный иммуноферментный анализ с применением поликлональных антител с использованием реагентов «ТБГ-ИФА-БЕСТ» (Вектор – Бест, Россия). Рассчитывался относительный ТБГ (ТБГотн – отношение наблюдаемого уровня ТБГ к минимальному/максимальному нормативному значению ТБГ для срока гестации, на котором проводилось исследование, в норме ТБГотн равен 1, изменение ТБГотн менее 1 свидетельствует о снижении, а более 1 о повышении уровня ТБГ относительно гестационной нормы). ПЛ – твердофазный иммуноферментный анализ, метод ELISA с использованием мышиных моноклональных антител (BIOSERV Diagnostics, Германия). Свободный Е3 – конкурентный твердофазный хемилюминесцентный иммуноферментный анализ с использованием поликлональных кроличьих антител к свободному Е3 с использованием анализатора IMMULITE 2000 (DPC, США).
Ультразвуковое исследование и оценка допплерометрических параметров кровотока фетоплацентарного комплекса проводились на диагностических ультразвуковых системах М5 (Mindrai, КНР), «Sonoace Pico» и «Sonoace 8800» (Medison, Южная Корея). Изучены кривые скоростей кровотока (КСК) в правой и левой маточных артериях и артерии пуповины методом допплерометрии. Для оценки состояния кровотока использовались следующие «уголнезависимые индексы»: индекс резистентности (ИР - соотношение разницы максимальной систолической и конечной диастолической скоростей кровотока к максимальной систолической скорости кровотока); систоло-диастолическое отношение (СДО - отношение максимальной систолической к конечной диастолической скоростями кровотока). Полученные результаты исследования (СДО и ИР в правой и левой маточных артериях) сгруппированы по максимальному (СДОmax и ИРmax) и минимальному (СДОmini и ИРmini) числовому значению «уголнезависимых индексов». Гемодинамические нарушения в системе мать-плацента-плод выявлялись при оценке кривых скоростей кровотока в маточных артериях и артерии пуповины (Стрижаков А.Н., 1989) [5]. С помощью ультразвуковой фетометрии устанавливался диагноз синдрома задержки развития плода (СЗРП), его форма и степень [5]. В зависимости от степени гемодинамических нарушений в системе мать–плацента–плод (НМПК) и синдрома задержки развития плода (СЗРП) выделены компенсированная (НМПК 1 степени и/или СЗРП 1 степени), субкомпенсированная (НМПК 2 степени и/или СЗРП 2 степени), декомпенсированная (НМПК 3 степени и/или СЗРП 3 степени) формы хронической плацентарной недостаточности (ХПН).
Статистические расчеты были выполнены с помощью пакетов программ: SPSS 12.1, Statistica for Windows 6.0, STADIA 6.3 prof. Применен аппарат проверки статистических гипотез с использованием критериев Манна-Уитни, χ2 Пирсона; отношение правдоподобия, линейно-линейная связь; λ; τ Гудмена и Краскала; коэффициент неопределенности при уровне значимости критерия 0,05. Кроме того использовался непараметрический корреляционный анализ с расчетом коэффициента Спирмена.
Результаты исследования и обсуждение. В настоящее время формирование ПЭ тесно связывают с нарушением инвазии трофобласта, развитием недостаточности маточно-плацентарного кровотока и ишемии плаценты [5,21], поэтому мы оценили состояние фетоплацентарного комплекса у беременных, которые участвовали в нашем исследовании. В третьем триместре гестации ХПН (1 группа – 14,3%; 2 группа – 56,3%; 3 группа – 100,0%) достоверно чаще (χ2 р=0,002; отношение правдоподобия р=0,001; линейно-линейная связь p<0,001; λ р=0,01; τ р=0,003; коэффициент неопределенности р=0,002) встречалась среди пациенток с ПЭ, частота была выше при тяжелой ПЭ. Субкомпенсированная ХПН (1 группа - 0; 2 группа - 6,3%; 3 группа – 35,7%) была зарегистрирована только при ПЭ, чаще при тяжелой (χ2 р=0,001; отношение правдоподобия р=0,001; линейно-линейная связь р=0,002; λ р=0,017; τ р=0,002; коэффициент неопределенности р=0,001). Случаи декомпенсированной ХПН зарегистрированы только у женщин с тяжелой ПЭ (14,3%). Нарушение кровотока в системе мать-плацента-плод чаще выявлялось у беременных с ПЭ, частота патологии увеличивалась при тяжелой ПЭ (1 группа – 7,1%; 2 группа – 31,3%; 3 группа – 92,9%;). НМПК II (28,6%) и III (7,1%) степени встречались только у пациенток с тяжелой ПЭ (χ2 р=0,009; отношение правдоподобия р=0,007; линейно-линейная связь р=0,009; λ р=0,036; τ р=0,011; коэффициент неопределенности р=0,007). Аналогичные результаты получены при изучении частоты СЗРП (1 группа – 14,3%; 2 группа - 25,0%; 3 группа – 64,3%; χ2 р=0,031; отношение правдоподобия р=0,032; линейно-линейная связь р=0,02; τ р=0,033; коэффициент неопределенности р=0,032). СЗРП II (1 группа – 0; 2 группа – 6,3%; 3 группа – 21,4%) и III степени (1 группа – 0; 2 группа - 0; 3 группа – 7,1%) выявлялся только при ПЭ, достоверно чаще при тяжелой ПЭ (χ2 р=0,032; отношение правдоподобия р=0,025; линейно-линейная связь р=0,026; τ р=0,037; коэффициент неопределенности р=0,025).
При изучении допплерометрических показателей маточно-плацентарно-плодового кровотока (таблица 1) установлено, что во 2 и 3 группах все «уголнезависимые индексы» кровотока были выше, чем в контрольной. Достоверные различия получены при тяжелой ПЭ.
Таблица 1. Допплерометрические показатели кровотока в третьем триместре гестации
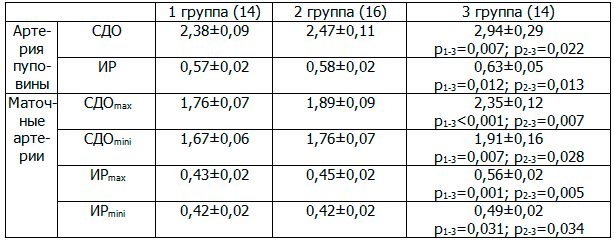
Примечание: здесь и далее использован критерий Манна-Уитни.
Таким образом, результаты оценки маточно-плацентарно-плодового кровотока можно использовать в качестве маркеров тяжести ПЭ.
Нормальное течение беременности зависит от функционирования плаценты. В связи с этим, изучение уровня продукции гормонов и белков в клетках плаценты имеет несомненный клинический интерес. Мы оценили показатели ТБГ, ПЛ, Е3 у пациенток с умеренной и тяжелой ПЭ (табл. 2).
Таблица 2. Показатели плацентарных белков и гормонов в третьем триместре гестации
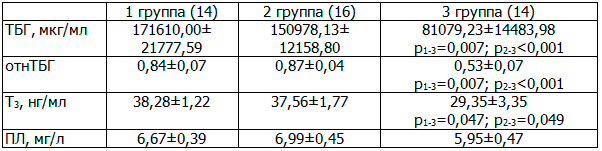
ТБГ является одним из наиболее информативных специфических маркёров беременности. Во время беременности его продукция происходит в клетках синцитиотрофобласта, а локализация в незрелой плаценте в цитоплазме цитотрофобластов и синцитиотрофобластов хориона. В зрелой плаценте ТБГ обнаруживается в трофобласте и в составе фибриновых островков, а также на внешней поверхности плазматических мембран микроворсинок [1,6]. ТБГ - надёжный маркёр ХПН, так как концентрация ТБГ отражает функциональное состояние клеток паренхимы плаценты [1,2,6,7,13]. Согласно результатам нашего исследования (таблица 2), показатели ТБГ и отнТБГ при тяжелой ПЭ оказались достоверно ниже аналогичных в двух других группах. При умеренной ПЭ уровень ТБГ статистически значимо не отличался от контрольной группы. Результаты нашего исследования согласуются с данными современной литературы. Калюжина Л.С. (2007) выявила падение фракции ТБГ в 1,5-1,9 раза в среднем за 3-5 недель до манифестации клинических симптомов ПЭ и ХПН. ХПН и СЗРП при «нормальных» и «высоких» значениях ТБГ не развивались вовсе [4]. Гусак Ю.К. и соавторы (2002) [3], Щербаков В.И. и соавторы (2005) [11] установили, что у женщин с ПЭ в срок беременности 35–37 недель уровни ТБГ снижены по сравнению с нормой при беременности. Причем величина снижения ТБГ оказалась прямо пропорциональна тяжести ПЭ. Как считают авторы, ТБГ стимулирует синтез интерлейкина-10, недостаток наработки которого на уровне трофобласта является одним из важных механизмов развития ПЭ. Выявлено, что падение уровня синтеза ТБГ у беременных с ПЭ и ХПН сопровождается изменениями углеводного и липидного обменов веществ. Увеличивалась концентрация общих липидов, холестерина, свободных жирных кислот.
Е3 составляет 80–95 % всех эстрогенов беременной женщины, при этом 90% Е3 имеет плодовое происхождение и лишь 10% Е3 образуется из эстрона и эстрадиола, секретируемых яичниками матери. Е3 увеличивает кровоток по сосудам матки, снижая их сопротивление, а также способствует развитию системы протоков молочных желез во время беременности. Поскольку Е3 образуется в плаценте, его уровень непосредственно характеризует функциональное состояние плаценты и плода. В случае нарушения функционирования фетоплацентарного комплекса, снижение уровня гормона опережает клинические проявления. Чем больше снижен уровень гормона, тем выше вероятность развития патологического состояния [9]. По данным Lagiou P. at all. (2013) материнские уровни Е3 положительно коррелируют с массой плаценты [16]. Тришкин А.Г. (2011) выявил снижение уровня Е3 у беременных женщин с СЗРП [9]. Согласно результатам нашего исследования уровень неконъюгированного Е3 при тяжелой ПЭ был статистически значимо ниже данного показателя в 1 и 2 группах. Аналогичные результаты получены и другими исследователями. Açıkgöz S. at all. (2013) установили, что уровень Е3 в плацентарных тканях у женщин с ПЭ оказался ниже, чем при нормальной беременности. Установлено, что плацентарный Е3 при ПЭ как с СЗРП, так и без данной патологии оставался ниже нормы при беременности [12]. Результаты исследования Jobe S.O. at all. (2013) показывают, что ПЭ характеризуется аномальным синтезом, метаболизмом и накоплением эстрогенов. Сывороточный уровень Е3 при тяжелой ПЭ оказался достоверно ниже в сравнении с нормальной беременностью, однако аналогичные изменения не зарегистрировали при умеренной ПЭ. Эти результаты подчеркивают необходимость изучения значения эстрогенов и их метаболитов в патофизиологии ПЭ [15].
ПЛ синтезируется в синцитиотрофобласте с самых ранних сроков гестации. Его концентрация нарастает параллельно сроку беременности и массе плаценты. По структуре ПЛ имеет большое сходство с гормоном роста. Подобно гормону роста, он активизирует синтез ДНК и пролиферацию клеток у плода, что ускоряет его рост. ПЛ обладает не только лакто-, сомато- и лютеотропной активностью, но и оказывает значительное влияние на все виды обмена веществ у матери и плода [9]. Согласно данным Тришкина А.Г. (2011) [9], Braun T. at all. (2013) [14], Szukiewicz D. at all. (2008) [22] ПЛ является ключевым регулятором роста плода. Тришкиным А.Г. (2011) [9], Szukiewicz D. at all. (2008) [22] отмечено, что уровень ПЛ оказался сниженным при наличии СЗРП, а так же при развитии ПЭ даже без СЗРП [22]. Однако мы не выявили достоверных отличий уровня ПЛ в группах обследованных женщин (табл. 2), но отмечена тенденция к снижению данного гормона при тяжелой ПЭ.
С целью изучения значимости плацентарных белков и гормонов в диагностике функционального состояния плаценты при ПЭ мы решили определить корреляционные связи уровня ТБГ, ПЛ, Е3 с тяжестью проявлений ПЭ, ХПН и допплерометрическими показателями маточно-плацентарно-плодового кровотока, использован корреляционный анализ Спирмена (табл. 3).
Таблица 3. Корреляционные связи плацентарных белков и гормонов с частотой и тяжестью ПЭ, ХПН, допплерометрическими показателями маточно-плацентарно-плодового кровотока
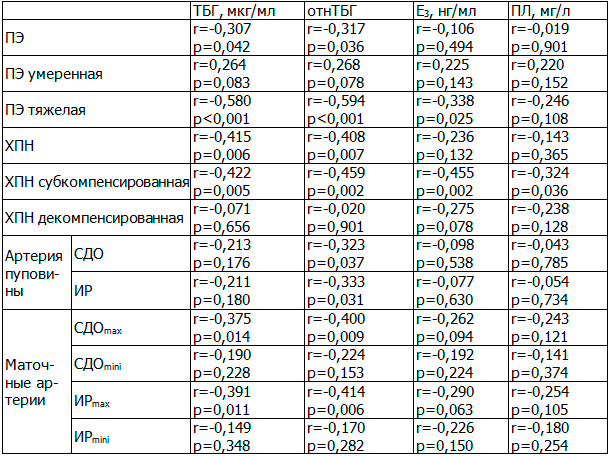
В результате статистического анализа установлены отрицательные корреляционные связи уровня плацентарных белков и гормонов с частотой и тяжестью ПЭ, плацентарной недостаточности, а также допплерометрическими показателями маточно-плацентарно-плодового кровотока. Установлено, что наиболее эффективным маркером состояния фетоплацентарного комплекса при ПЭ являются показатели ТБГ и отнТБГ, что позволяет использовать данные параметры в качестве предикторов нарастания тяжести плацентарной недостаточности и ПЭ.
Выводы
- Преэклампсия ассоциирована с высокой частотой выявления суб- и декомпенсированной хронической плацентарной недостаточности, синдрома задержки развития плода, тяжесть проявлений наиболее выраженная при тяжелой преэклампсии.
- Допплерометрические показатели маточно-плацентарно-плодового кровотока увеличиваются при беременности, осложнившейся тяжелой преэклампсией.
- При тяжелой преэклампсии зарегистрировано снижение показателей трофобластического бета-1-гликопротеина и свободного эстриола. Уровень плацентарного лактогена статистически значимо не изменился.
- Выявлены отрицательные корреляционные связи показателей трофобластического бета-1-гликопротеина, свободного эстриола, плацентарного лактогена с частотой и тяжестью преэклампсии, плацентарной недостаточности, а также допплерометрическими показателями маточно-плацентарно-плодового кровотока. Наиболее эффективным маркером состояния фетоплацентарного комплекса при преэклампсии является трофобластический бета-1-гликопротеин.
