Введение. Особый интерес хирургов в настоящее время вызывает синдром интраабдоминальной гипертензии (СИАГ) или Abdominal Compartment Syndrome, который представляет собой симптомокомплекс, развивающийся вследствие повышения внутрибрюшного давления (ВБД) и характеризующийся развитием полиорганной недостаточности [3, 6, 17]. Наиболее частыми причинами развития внутрибрюшной гипертензии в экстренной абдоминальной хирургии являются деструктивный панкреатит, перитонит [12, 14, 15]. При тяжелых формах этих заболеваний внутрибрюшная гипертензия, вызванная, прежде всего, повышением давления в паретичной толстой и тонкой кишке, развивается у 30 и более процентов больных, а СИАГ возникает приблизительно у 5,5 - 8,3% пациентов [2, 3, 6, 11].
Так как внутрибрюшная гипертензия и полиорганная недостаточность при этом развиваются на фоне уже имеющихся тяжелых нарушений гомеостаза, летальность от СИАГ достигает очень высоких цифр – 42 – 68% [6, 9, 10].
Хотя технике хирургической коррекции ВБД современными авторами уделено большое внимание [4, 7, 8], механизмы развития осложнений, специфичных для динамической или механической толстокишечной непроходимости, внутритолстокишечной и внутрибрюшной гипертензии, не выяснены. По-прежнему дискутируется вопрос о критическом уровне ВБД и внутрикишечного давления (ВКД), требующем активной хирургической коррекции.
Цель работы – определить критический уровень внутрибрюшного и внутрикишечного давления, вызывающий необратимые трофические нарушения в стенке толстой кишки и требующий хирургической коррекции.
Материалы и методы. В эксперименте на 36 беспородных собаках массой 15,4 ± 0,8 кг изучены функциональные (микроциркуляторные – по данным лазерной доплеровской флоуметрии – ЛДФ) и морфологические (по данным гистоморфометрии) изменения в стенке толстой кишки в зависимости от уровня внутрикишечного (ВКД, 5, 15, 25 и 35 мм рт. ст. в I, II, III, IV экспериментальных группах, соответственно) и внутрибрюшного (ВБД) давления (табл.1).
Таблица 1. Распределение экспериментальных животных по группам
Внутрикишечное давление дискретно поднимали введением в просвет кишки физиологического раствора через зонд, установленный в энтеротомное отверстие и закрепленный кисетным швом в условиях наложенного эластичного жома на участок в 30 см дистальнее илеоцекального перехода толстой кишки.
Одновременно фиксировали показатели ВКД и ВБД. Измерение ВБД проводили методом открытого уретрального катетера по Harrahill M. (1998) [16]. Состояние микроциркуляции кишечной стенки оценивали неинвазивным методом исследования колебаний микрокровотока – лазерной допплеровской флоуметрией (ЛДФ) при помощи лазерного анализатора капиллярного кровотока ЛАКК-02, производства НПП «Лазма», Россия.
Выполнение всех операций на животных осуществлялось согласно приказу Министерства здравоохранения СССР № 755 от 12.08.1977 «О мерах по дальнейшему совершенствованию организационных форм работы с использованием экспериментальных животных» и приказ № 701 от 27.07.1978 «О внесении дополнений в приказ Министерства здравоохранения СССР № 755 от 12.08.1977».
Состояние системы микроциркуляции оценивали по следующим показателям: показатель микроциркуляции (ПМ), среднее квадратичное отклонение (СКО), амплитуды медленных (ALF), быстрых (AHF) и пульсовых (АСF) колебаний. Перечисленные показатели измеряли в перфузионных единицах (пф. ед.). Также определяли нормативные показатели ритмических составляющих колебаний кровотока: коэффициент вариации (Kv), микрососудистый тонус (ALF/СКО), миогенную активность прекапиллярных вазомоторов (ALF/M x 100%), респираторные (AHF/CKO x 100%) и пульсовые флуктуации кровотока (ACF/CKO x 100%).
После окончательной обработки полученных данных пользовались шкалой недостаточности микроциркуляции (НМЦ) Б.С.Брискина, В.Н. Букатко.
Для оценки морфологической картины в качестве материала для гистоморфометрического исследования забирали участок толстой кишки, в котором была смоделирована внутрикишечная гипертензия.
Экспериментальный материал в растворе 10% формалина доставляли в лабораторию. Материал фиксировали 10% раствором формалина при t=37° С в течение 24 часов с последующим обезвоживанием в спиртах восходящей концентрации, начиная с 70% и до абсолютного. Материал заливали в парафин и готовили срезы, средняя толщина среза не превышала 5 мкм. Окраску производили гематоксилин-эозином.
Для морфометрической обработки использовали микроскоп Leica и объёктив х20; х40. Для морфометрического анализа применяли автоматическую систему подсчёта Leica. Проведена компьютерная морфометрия полученного материала с последующеё статистической обработкой данных. Расчёт количества сегменто-ядерных нейтрофилов с поля определения среднего количества сегменто-ядерных нейтрофилов на 10 полей зрения при увеличении кратном x20. Подсчёт площади отёка и площади полнокровия сосудов производился путём визуализации объектов и подсчёте средней площади от 10 полей зрения при увеличении кратном x20.
Результаты исследования. Установлено, что в I группе (n=10) имелось снижение перфузии по медиане на 37,7% (p=0,005),. Модуляции кровотока δ также снизилась, на 41,1% (p=0,005) за счёт уменьшения вклада дыхательного и сердечного компонентов на 50,1% (p=0,005) и 59,5% (p=0,005), соответственно. Ослабление влияния со стороны пассивных механизмов регуляции, в условиях повышения ПШ на 24,3% (р=0,024) означает усиление сброса крови по шунтам и предупреждение застоя в МЦ-русле.
Во II группе исследования (n=10) при ВКД равном 15 мм рт. ст. (n=10) статистически значимого изменения перфузии не наблюдали, однако отмечали многофакторную компенсаторную положительную реакцию – рост медианы модуляции микрокровотока на 49,6% (р=0,007) и снижение пассивных механизмов регуляции, отражающихся в падении вклада сердечного и дыхательного компонентов 56,5% и (р=0,005) и 63,6% (р=0,005), соответственно, на фоне невысоких показателей тонусов. При этом зафиксировано значимое повышение показателя шунтирования на 67,9% (р=0,005), что свидетельствует о интенсивном сбросе крови в обход нутритивного звена, что избавило МЦ-русло от застойных явлений в приносящем и выносящем звеньях. Такая реакция системы МЦ является патологической и приводит к усугублению ишемии тканей, не получающих достаточное количество крови через капилляры. Вышеуказанные изменения характерны для НМЦ II степени.
В III исследуемой группе отмечали снижение перфузии на 15,1% (р=0,036) и её модуляции на 36,9% (р=0,005). В условиях сниженных миогенного на 50,9% (р=0,005) и нейрогенного тонусов на 53,0% (р=0,005), отображающих компенсаторную релаксацию прекапиллярных сфинктеров и стенок приносящих сосудов и массивного поступления крови через приносящее звено, повышение вклада сердечного компонента на 34,7% (р=0,005) указывало на выраженный застой в прекапиллярной зоне. Отсутствовал массивный сброс крови через шунты (ПШ без значимых отклонений от контроля) и отмечали повышение Д-компонента на 41,8% (р=0,005) характеризует застой также и в венулярном звене. Вышеуказанные изменения характерны для НМЦ II – III степени.
В IV группе исследования отмечали снижение перфузии на 20,7% (р=0,005) без значимого изменения её модуляции. При изучении пассивных механизмов регуляции МЦ отмечалось значительное усиление их влияния – сердечного на 63,2% (p=0,036) и дыхательного на 142,9% (р=0,005), что связано с выраженным застоем по всей МЦ-системе, преимущественно в венулярном звене. Отмечено также усиление активных механизмов, что отразилось в снижении миогенного и нейрогенного тонусов на 36,8% (р=0,005) и 17,1% (р=0,012). Показатель шунтирования снизился на 23,4% (р=0,005) что привело к снижению шунтирующего кровотока и перенаправило поток в капиллярное звено, однако дисбаланс механизмов и массивный застой привело к снижению ИЭМ на 41,0% (р=0,005). Вышеуказанные показатели характерны для НМЦ III степени.
В результате экспериментального исследования (табл. 2) выявлена сильная прямая корреляционная связь между повышением давления в кишке и ВБД измеренным открытым способом в мочевом пузыре животного в условиях закрытой лапаротомной раны (коэффициент корреляции Спирмена R=1,00 при условии р=0,05).
Таблица 2. Соотношение ВКД и ВБД в эксперименте (Ме [LQ; UQ])
![Таблица 2. Соотношение ВКД и ВБД в эксперименте (Ме [LQ; UQ])](/images/articles/2012/2.1/12152/t2.png)
Изучение гистологической картины стенки кишечника, находящегося в условиях внутрикишечной и внутрибрюшной гипертензии, подтвердило полученные данные исследования микроциркуляции (рис. 1, 2).
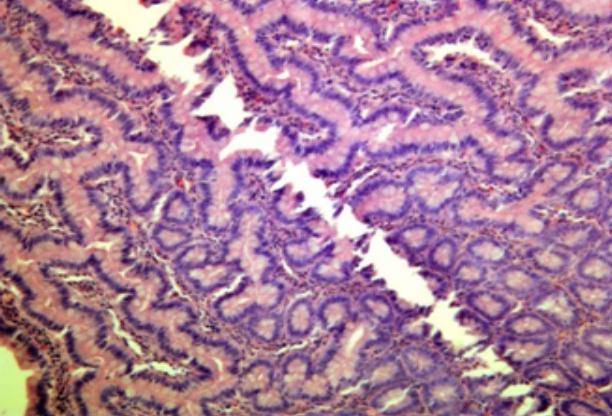
Рис. 1. Микрофото стенки толстой кишки в устовиях ВКД 15 мм рт.ст. Лейкоцитарная инфильтрация и отек выражены незначительно. Окраска гематоксилин-эозином. Увеличение х40.
При гистологическом исследовании стенки толстой кишки, находящейся в условиях ВКД, равного 15 мм рт. ст., найдена картина без сколько-нибудь выраженных морфологических изменений. Лейкоцитарной реакции не отмечали, признаков отека, миозита не было.
Гистологическая картина стенки толстой кишки, находившейся в условиях внутрикишечного давления 25 мм рт. ст., значительно отличалась наличием выраженной лейкоцитарной инфильтрации подслизистого и мышечного слоев, признаками полнокровия, кровоизлияний (рис. 2).
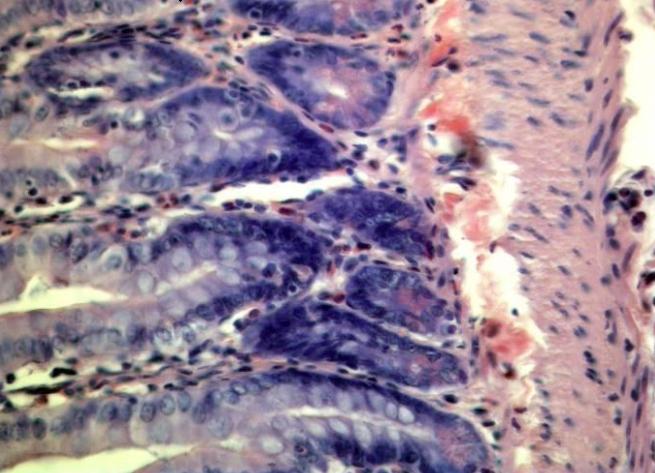
Рис. 2. Микрофото стенки толстой кишки в устовиях ВКД 25 мм рт.ст. Полнокровие и отёк подслизистого слоя, умеренная лейкоцитарная инфильтрация. Окраска гематоксилин-эозином. Увеличение х40.
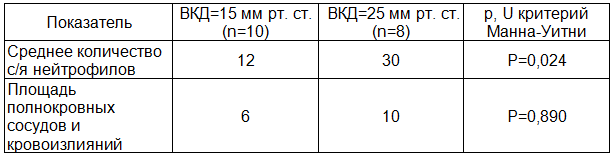
Сравнения морфометрических показателей тканей исследованных групп показал, что при уровне внутрикишечного давления 25 мм рт. ст. в стенке толстой кишки развиваются процессы, достоверно отличающиеся интенсивностью проявления инфильтрации сегменто-ядерными нейтрофилами от подобных проявлений при 15 мм рт. ст., а также ярко выраженной венозной гиперемией (табл. 3).
Таблица 3. Сравнение результатов морфометрии в тканях стенки толстой кишки при разных уровнях внутрикишечного давления (n=18)
Таким образом, в результате экспериментального исследования установлено, что важным механизмом патогенеза трофических нарушений в стенке толстой кишки при интракишечной и интраабдоминальной гипертензии является застой в венулярном звене МЦ-русла. Венозный застой вызывает развитие отёка с последующими сдавлением, ишемией тканей, нарушением оттока и замыканием порочного круга.
При ВКД 5 мм рт. ст. и 15 мм рт.ст. развиваются значимые нарушения перфузии в стенке толстой кишки без включения компенсаторных механизмов. Декомпенсированные нарушения МЦ в стенке кишки развиваются уже при уровне ВКД 25 мм рт. ст., они сопровождаются выраженными морфологическими нарушениями в виде венозной гиперемии и лейкоцитарной инфильтрации.
Критический уровень ВБД, обусловленного энтеральной недостаточностью и парезом толстой кишки составляет 13,2 мм рт. ст. и требует активной, в том числе и хирургической, декомпрессии брюшной полости.
