Введение
Развитие космонавтики сопровождается неизбежным увеличением длительности пилотируемых орбитальных полетов. В этой связи остается открытым вопрос о поиске новых мер и средств, обладающих профилактическими свойствами в отношении нежелательных эффектов факторов космического полета и, прежде всего, невесомости, на физиологические системы организма. Среди них возможность использования электромагнитного воздействия в силу ряда оказываемых биологических эффектов является достаточно актуальным [2, 4, 5, 7, 17, 18]. Не вызывает сомнения, что одной из точек приложения корригирующего действия магнитного поля на организм может являться печень, принимающая непосредственное участие во всех видах обмена. Паренхима этого органа пищеварительной системы представляет собой клеточную популяцию, обладающей достаточной гетерогенностью в зависимости от внутридольковой топографии и гемодинамических условий [10, 11, 20, 21]. В развитии адаптивных реакций паренхимы печени на действие разнообразных факторов внешней и внутренней среды важнейшее значение принимает ядерный аппарат гепатоцитов [3]. С целью изучения влияния низкочастотного импульсного магнитного поля (НИМП) на состояние ядерного аппарата гепатоцитов в восстановительном периоде после моделирования некоторых физиологических эффектов невесомости была проведена настоящая работа.
Методика
Эксперимент проводился в ФГБУН ГНЦ РФ «Институт медико-биологических проблем» РАН в рамках программы «Изучение эффективности применения низкоинтенсивного импульсного магнитного поля как средства коррекции неблагоприятных изменений в организме при моделировании физиологических эффектов невесомости». Изучение биоматериала и его анализ проводились на кафедре биологии и в НИИ экспериментальной биологии и медицины ВГМА им.Н.Н.Бурденко. Объектом исследования являлась печень белых беспородных половозрелых крыс (самцов) четырех экспериментальных групп, каждая из которых была представлена 7 животными. Первую группу составили животные виварийного контроля. Животные второй группы подвергались 14-суточному антиортостатическому вывешиванию после моделирования некоторых эффектов невесомости по методике Ильина–Новикова в модификации Морей–Холтон [19]. Третья и четвертая группы крыс обследовались спустя 3 суток после завершения вывешивания, при этом животные последней группы в течение трехсуточного восстановительного периода подвергались влиянию НИМП определенных параметров. В качестве источника магнитного поля была использована установка «Бутон-3», генерирующая электромагнитные волны с максимальным значением магнитной индукции в рабочей зоне 3.5 мТл. Воздействие магнитным полем осуществлялось тотально, при этом животные размещались в рабочей зоне установки в контейнере с прозрачными стенками без фиксации. Режим НИМП представлял собой три последовательных 10-ти минутных воздействия с определенными значениями магнитной индукции (табл.1). Общая экспозиция магнитного поля составила 30 минут. В первые сутки после моделирования физиологических эффектов невесомости использовалось НИМП в режиме №1, а на вторые и третьи сутки – в режиме №2.
Для проведения морфологических исследований фрагменты левой доли печени фиксировали в забуференном 10% нейтральном формалине (рН 7,6) при комнатной температуре, проводили через спирты и заливали в парафин. Приготовленные срезы толщиной 6 мкм окрашивали гематоксилином Караччи–эозином. Для вычисления среднего объема ядер и ядрышек гепатоцитов использовали формулу: V = π/6*L*B2, где L и B – наибольший и наименьший диаметры измеряемого объекта соответственно, расположенные перпендикулярно друг к другу [1]. Количество клеток для определения морфометрических показателей составляло не менее 350. Высчитывали среднее число ядрышек на одно ядро гепатоцита, а также частоту их прилежания к кариолемме, проводя измерения в 500 клетках. Соотношение одноядерных и двуядерных гепатоцитов выявляли на 1000 клеток. Для оценки пролиферативной активности гепатоцитов выявляли частоту встречаемости митоза и амитоза на 20000 тысяч клеток. Минимальное число измерений, необходимое для получения объективных данных по всем выше перечисленным критериям оценки состояния ядерного аппарата гепатоцитов, рассчитывалось с использованием метода аккумулированных средних [8]. Морфометрический анализ проводился с помощью анализатора изображений «ВидеоТест-Морфо», имеющего широкие возможности для объективной оценки структур клеточных ядер [15]. Полученные данные обрабатывались статистически с использованием пакета стандартных компьютерных программ, достоверность различий определялась при помощи критерия Стьюдента с уровнем значимости p<0,05. Исследования проведены с соблюдением требований по гуманному обращению с животными в соответствии с решением Комиссии по биомедицинской этике Института медико-биологических проблем (протокол № 206 от 07.10.2007 г.).
Результаты.
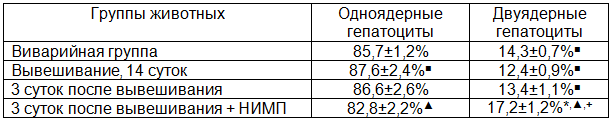
В группе интактных крыс среди гепатоцитов печени доминировали одноядерные клетки, которые представляли 85,7±1,2% общей популяции, содержание двуядерных было гораздо меньше (табл. 1). По результатам морфометрического анализа средний объем ядер гепатоцитов в дольках печени составил 224,7±7,2 мкм3, ядрышек - 4,56±0,14 мкм3, при этом их количество в расчете на одно клеточное ядро было 1,58±0,05, а частота прилежания к кариолемме наблюдалась в 12,4±0,9% от общего количества ядер.
Спустя 14 суток после вывешивания в сравнении с показателями виварийной группы животных соотношение одно- и двуядерных гепатоцитов не менялось, обнаруживалась лишь тенденция к возрастанию численности одноядерных клеток и снижению двуядерных (табл. 2). Определение объемов ядер и ядрышек гепатоцитов выявило их достоверное возрастание (табл. 3). При подсчете количества ядрышек в ядрах гепатоцитов крыс было показано достоверное увеличение их численности вместе с частотой прилежания к кариолемме (табл. 4).
Таблица 1. Режимы воздействия магнитным полем

Таблица 2. Содержание одно- и двуядерных гепатоцитов крыс (в %)
Примечания: здесь и далее * - p<0,05 по сравнению с показателями группы виварийных животных; ▲ − p<0,05 по сравнению с показателями группы вывешивания; + − по сравнению с показателями животных, обследованных через 3 суток после вывешивания; ■ – по сравнению с показателями животных, подвергавшихся во время 3-суточного восстановления после вывешивания воздействию НИМП.
Таблица 3. Морфометрические показатели ядерного аппарата гепатоцитов крыс (в мкм3)
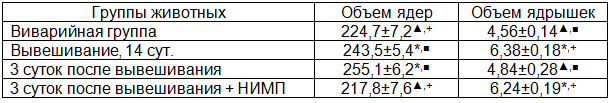
Таблица 4. Содержание ядрышек в ядрах гепатоцитов (на одно ядро) и частота их прилежания к кариолемме (% от общего числа ядер) в печени крыс
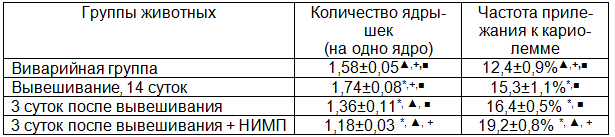
К 3 суткам восстановительного периода после вывешивания количество ядер в гепатоцитах оставалось прежним в сравнении с аналогичными показателями других экспериментальных групп животных (табл. 2). Размеры ядер клеток паренхимы печени продолжали возрастать в сравнении со значениями виварийных животных, однако, они не достигали достоверных отличий от значений группы крыс, подвергавшихся 14-суточному вывешиванию. В то же время, по отношению к показателям группы крыс, у которых моделировались некоторые физиологические эффекты невесомости, объемы ядрышек достоверно снижались, возвращаясь к уровню виварийного контроля (табл. 3). Количество ядрышек значимо уменьшалось, приобретая существенные отличия не только в сравнении с показателями крыс группы вывешивания, но и виварийного контроля (табл. 4). Вместе с тем, частота контактирования ядрышка с ядерной оболочкой практически не менялась в сравнении с предыдущей группой эксперимента, достоверно превышая значения виварийных животных (табл. 4).
Воздействие электромагнитного поля в течение трехсуточного восстановительного периода после вывешивания приводило к достоверному возрастанию численности двуядерных клеток по сравнению с их содержанием в других группах эксперимента, тогда как снижение числа одноядерных гепатоцитов было незначимым (табл. 2). В то же время, обнаруживалось существенное уменьшение объема ядер в сравнении показателями группы животных, на которых моделировались некоторые физиологические эффекты невесомости, также как и с крысами, не подвергавшихся в трехсуточный восстановительный период влиянию магнитного поля. При этом, размеры ядер достигали аналогичных показателей группы животных виварийного контроля (табл. 3). Объемы ядрышек были достоверно выше по сравнению с показателями крыс, восстановление которых после моделирования невесомости проходило без применения НИМП. Вместе с этим, размеры ядрышек не отличались от значений животных, подвергавшихся 14-суточному вывешиванию, достоверно превышая их показатели у виварийных крыс (табл. 3). В то же время, выраженность снижения численности ядрышек была более значительна по сравнению с уровнем в остальных экспериментальных группах, в том числе, у животных, восстановительный период которых после 14-суточного вывешивания проходил без влияния НИМП (табл. 4). Интересным являлся тот факт, что частота контактирования ядрышка с кариолеммой существенно возрастала в сравнении с другими группами эксперимента, свидетельствуя об интенсификации ядерно-цитоплазматического обмена (табл. 4).
Обсуждение
Хорошо известен существующий выраженный полимофизм в основе изменения биосинтетического потенциала гепатоцитов млекопитающих [6, 12]. Вариабельность строения ядерного аппарата у крыс может затрагивать как ядра (количество, размеры, плоидность), так и ядрышковый аппарат (объемы, число, частота прилежания к кариолемме), что создает широкие возможности для адаптивного ответа на влияние факторов окружающей среды. С одной стороны, в гепатоцитах может происходить нарастание плоидности. С другой стороны, повышение функциональной активности может достигаться увеличением числа ядер гепатоцитов, а также их объемов, активизацией деятельности ядрышкового аппарата. Очевидно, характер адаптивных реакций определяется природой воздействующего фактора, его продолжительностью и интенсивностью. В литературе имеются сведения о том, что среди основных ответных реакций паренхимы печени на острые и хронические стрессовые воздействия часто наблюдается реактивное торможение митозов [9]. Вместе с этим, известен существенный пролиферативный потенциал печени, проявляющийся при экспериментальной резекции части органа.
В нашем исследовании возрастание митотической активности не обнаруживалось. Это позволяет считать, что как при моделировании некоторых физиологических эффектов невесомости, так и после окончания вывешивания, в том числе, и в условиях воздействия НИМП, выявленные изменения не затрагивали численности общего пула гепатоцитов, а вызывали, в первую очередь, изменение их функциональной активности. Эффекты применения низкоинтенсивного магнитного поля как модификатора восстановительного периода после моделирования условий невесомости на состоянии ядерного аппарата гепатоцитов проявлялись неоднозначными изменениями, свидетельствующими как о снижении, так и повышении биосинтетического потенциала. Например, такие критерии, как объем ядер гепатоцитов и содержание в них ядрышек свидетельствовали о признаках снижения функциональной активности в условиях радиомодификации восстановительного периода после вывешивания низкоинтенсивным электромагнитным полем.
В то же время, на возрастание функциональной активности указывала динамика таких параметров, как объем ядрышек и частота их прилежания к кариолемме, а также увеличение представительства двуядерных гепатоцитов в паренхиме печени. Возможно, что эти процессы и лежали в основе лучшей сохранности гистоархитектоники печеночных долек, которые к 3 суткам восстановительного периода при использовании НИМП в большей степени сохраняли балочное строение, характерное для виварийных крыс, по сравнению с немодифицированными животными.
Для понимания механизма возрастания численности двуядерных клеток в паренхиме печени был проведен подсчет амитоза гепатоцитов, который идентифицировали по различным картинам перетяжки ядра [20] и гантелеобразным ядрам [16]. Следует отметить, что амитоз гепатоцитов печени интактных крыс, так же как и митоз – весьма редкое явление. По проведенным подсчетам, у животных группы виварийного контроля частота встречаемости амитоза составила 1,4±0,06‰. Действие НИМП вызывало достоверное возрастание частоты встречаемости амитоза в паренхиме печени крыс. Косвенно об этом свидетельствовало и значимое возрастание численности двуядерых гепатоцитов, кариолеммы ядер которых соприкасались друг с другом, с 7,6±0,8% в группе виварийных животных до 12,3±0,5% у крыс, подвергавшихя в течение трехсуточного восстановительного периода действию НИМП. Известно, что после завершения амитоза в гепатоците образуются два ядра, некоторое время соприкасающиеся друг с другом. Следует отметить, что тенденция к возрастанию этого показателя обнаруживалась и непосредственно после 14-суточного вывешивания, и спустя 3 суток после него, однако, она не приобретала достоверного характера. Ядра сформировавшихся двуядерных гепатоцитов могут работать асинхронно, удлиняя период функциональной активности клетки [13]. Морфологические перестройки при амитозе отражают наиболее простой и быстрый способ увеличения поверхности соприкосновения между ядром и цитоплазмой, соответственно, интенсифицируя обмен между ними [14]. В исследовании Т. Nagata [20] были показаны более высокие функциональные потенции двуядерных клеток в сравнении с одноядерными, в основе которых – лучшее развитие митохондриального аппарата, более активные процессы синтеза РНК и белка. Таким образом, полученные сведения позволяют считать, что использование НИМП в восстановительном периоде после 14-суточного вывешивания животных может увеличивать биосинтетические потенции гепатоцитов в обеспечении адаптивных реакций печени к возникающим условиям жизнедеятельности.
