Пигментный ретинит (ПР) – это группа наследственных прогрессирующих дистрофий сетчатки с первичным поражением палочковых фоторецепторов, встречается с частотой 1:4000 [7].
ПР – генетически очень гетерогенная группа заболеваний, может иметь различный тип наследования и связан с мутациями более 100 различных генов. Это гены белков зрительного цикла, белков мембран дисков наружных сегментов палочек, метаболизма ретинола, фолдинга, транскрипционных факторов фоторецепторов [15]. Мутантный ген экспрессируется в основном в палочках, индуцирует их апоптоз [11], что приводит к потере палочковых фоторецепторов уже в раннем детском возрасте. Клинические проявления ПР – никталопия и прогрессивное сужение поля зрения. Колбочки, в последующем, тоже вовлекаются в патологический процесс, что приводит к потере не только периферического, но и центрального зрения.
Мыши линии rd10 (retinal degeneration 10) – одна из животных моделей пигментного ретинита, демонстрирующая ретинальную дегенерацию с мягким течением, имеющая широкий терапевтический интервал, и наиболее точно соответствующая течению ПР у человека. Данная линия мышей имеют мутации в гене фосфодиэстеразы, приводящей к постепенной гибели палочек, но в последующем погибают и колбочковые фоторецепторы [13].
При пигментном ретините фоторецепторы гибнут путем апоптоза, ключевую роль в индукции которого играют активные формы кислорода и оксидативный стресс [12]. В исследованиях на животных моделях ПР получены данные о повышении уровня малондиальдегида и других продуктов перекисного окисления липидов в фоторецепторах, и снижении активности глутатионпероксидазы в сетчатке модельных животных [6]. Показано, что лечение антиоксидантами может уменьшить гибель фоторецепторов на животных моделях ПР [8].Эти открытия подчеркивают важность оксидативного повреждения и терапевтический потенциал антиоксидантов в лечении пигментного ретинита.
Пара-аминобензойная кислота (ПАБК) – непротеиногенная аминокислота, широко распространенная в природе. По химическому строению ПАБК – производное бензойной кислоты, содержащее аминогруппу заместитель в пара-положении. ПАБК относят к группе витаминов В (В10). В настоящее время, ПАБК и ее производные продолжают привлекать внимание исследователей в связи с их широким спектром биологического действия и низкой токсичностью. ПАБК обеспечивает защиту от ультрафиолетовых лучей, индуцирует синтез эндогенного интерферона и интерлейкина-6 [1], имеет антикоагулянтную активность [4]. ПАБК обладает антиоксидантными свойствами: снижает уровень гидропероксида и малонового диальдегида, нормализует активность каталазы в роговице и хрусталике глаза [3],снижает интенсивность перекисного окисления липидов в сетчатке после индуцированной гипоксии [2]. О.Г. Строева и соавт. показали, что ПАБК стимулирует морфогенез дисков наружных сегментов фоторецепторов у крыс с наследственной абиотрофией сетчатки типа пигментного ретинита [5].
Целью настоящего исследования является оценка влияния пара-аминобензойной кислоты на интенсивность оксидативного повреждения в сетчатке мышей линии rd10 путем определения уровня продуктов перекисного окисления липидов и карбонилированных форм белков.
Материалы и методы. Эксперимент проводился на мышах линии rd10 (JacksonLabs, Maine, USA). Животные были разделены на 2 группы: группа лечения и контрольная группа. В группу лечения включено 28 мышей, которым проводились интраперитонеальные инъекции ПАБК в физиологическом растворе (доза 50 мг/кг) 6 раз в неделю с третьего дня после рождения до 4,5 недели. Животным из контрольной группы (n=24) по тому же протоколу проводились интраперитонеальные инъекции физиологического раствора.
Для биохимического исследования глаза энуклеировали на 3 и 4,5 неделе, сетчатки аккуратно отделяли и помещали в лизирующий буфер (1% деионизированный Тритон Х-100, 0,1% азида натрия в 50 мМ Трис-HCl рН 7,5 с 0,25 мкМ фенилметилсульфонилфторид). Образцы гомогенизировали, инкубировали на льду в течение 30 мин (встряхивали каждые 5-6 мин), центрифугировали при 3000 оборотов в минуту (1000g) в течение 15 мин. Супернатант отбирали и использовали для анализа.
Общее содержание белка оценивали путем фотометрического определения с использованием бицинхониновой кислоты по стандартной методике (Bicinchoninic acid assay Kit, Rockford, IL, USA; micro plate reader MR 5000, оснащенный светофильтром 570 нм (Dynatech Laboratories, Chantilly, VA, USA)).
Степень оксидативного повреждения определялась путем измерения уровня биохимических маркеров перекисного окисления липидов - «тиобарбитурореактивных веществ» (англ. thiobarbituric reactive substances,), содержание карбонилировонных форм белков определялось с использованием 2,4-динитрофенилгидразила как описано Levine и соавт.[14].
Статистический анализ биохимических данных выполнен с применением метода ANOVA. Различия считались статистически значимыми при р ≤ 0,05. Результаты представлены как среднее ± стандартная ошибка среднего (СОС).
Результаты. Для определения влияния ПАБК на степень оксидативного повреждения сетчатки были измерены уровни продуктов перекисного окисления липидов (определялись TBARS) и окислительной модификации белков (количество карбонилированных производных белков на 1 мг общего белка). Оба метода показали значительное снижение уровня окислительного повреждения в сетчатке животных, получавших ПАБК. Уровень TBARS был на 49% ниже на 3 неделе (р<0,05) и на 69% ниже на 4,5 неделе (р<0.0005) в группе ПАБК по сравнению с контрольной группой (рис. 1).
Количество карбонилированных форм белка так же было меньше в группе ПАБК: на 68% ниже на 3 неделе (р<0,005) и на 58% ниже на 4,5 неделе (р<0,05) (рис. 2).
Полученные результаты демонстрируют способность ПАБК предотвращать оксидативное повреждение белков и липидов в сетчатке мышей линии rd10 и подтверждают ее эффективность как антиоксиданта на модели пигментного ретинита.
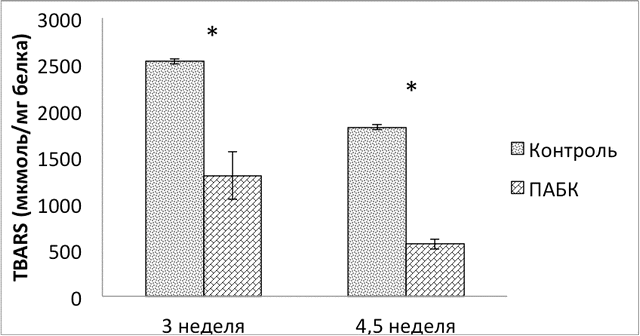
Рис. 1. Уровни TBARS в сетчатке животных контрольной группы и группы ПАБК на 3 и 4,5 неделе. Здесь и далее * - статистически значимые различия. Планки погрешностей – стандартная ошибка среднего.
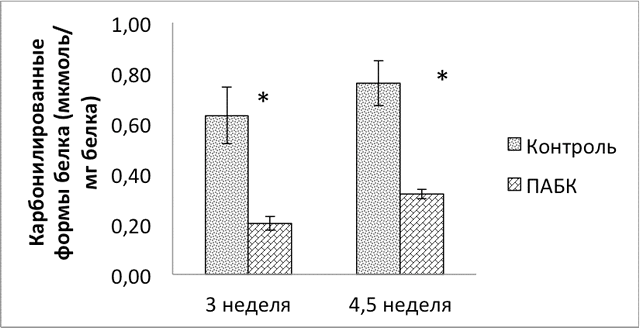
Рис.2. Уровни карбонилированного белка в сетчатке животных контрольной группы и группы ПАБК на 3 и 4,5 неделе.
Обсуждение. Оценка уровня оксидативного повреждения ретинальных липидов и белков показала значительный уровень антиоксидантной защиты (до 50-70%), наблюдаемый при системном введении ПАБК. Способность ПАБК снижать интенсивность перекисного окисления липидов в сетчатке так же была описана Акберовой С.И. и соавт. на модели гипоксического повреждения сетчатки [2].
На сегодняшний день перспективным методом лечения ретинальных дегенераций является патогенетически ориентированная терапия с использованием антиоксидантов. Единичные исследования уже раскрывают потенциал эффективности антиоксидантов в лечении ПР: показано увеличение выживаемости фоторецепторов на животных моделях при применении комплексов лютеин + зеаксантин + α-липоевая кислота [8, 9], α-токоферол + аскорбиновая кислота + Mn (III) + порфирин + α-липоевая кислота [14]. Тем не менее, действие каждого препарата в отдельности в этих исследованиях часто было очень небольшим, но при совместном применении была достигнута высокая эффективность, связанная с аддитивным или даже синергическим эффектом антиоксидантов в различных комбинациях [8,9,14].
ПАБК снижает интенсивность перекисного окисления липидов и окислительной модификации белков. Возможно, применение ПАБК при пигментном ретините может ограничить уровень оксидативного повреждения в сетчатке и предотвратить гибель фоторецепторов. Таким образом, ПАБК с его хорошим профилем безопасности может служить эффективным дополнением к антиоксидантной терапии пигментного ретинита.
