Введение
Печень, как орган, выполняющий фундаментальную роль в метаболизме белков, углеводов и липидов, неоднократно подвергалась исследованиям у млекопитающих, вернувшихся из орбитального полета [11, 13, 16, 22]. При этом, часть работ была посвящена изучению важного биологического полимера – гликогена, во многом определяющего адаптивные возможности организма в целом [17, 18, 19]. К настоящему времени хорошо известна морфофизиологическая специфика гепатоцитов в зависимости от количества ядер, внутридольковой топографии, особенностей кровотока, количества ядер и др., проявляющейся, в том числе, различной интенсивностью образования и расщепления гликогена [7, 8, 9, 14, 21]. Однако, исследование распределения и содержания гликогена в гепатоцитах крыс с учетом их локализации в дольках при моделировании эффектов невесомости ранее не проводилось. Воздействие магнитного поля определенных параметров можно рассматривать в качестве модификатора послеполетных изменений в организме, поскольку среди разносторонних биологических эффектов электромагнитных излучений имеются данные относительно их способности повышать резистентность организма к повреждающим агентам [1, 2, 3, 12]. Эти сведения послужили основанием для проведения анализа модифицирующего действия низкочастотного импульсного магнитного поля (НИМП) на содержание гликогена печени крыс в восстановительный период после моделирования некоторых физиологических эффектов невесомости.
Методика
Эксперимент проводился в ФГБУН ГНЦ РФ «Институт медико-биологических проблем» РАН в рамках программы «Изучение эффективности применения низкоинтенсивного импульсного магнитного поля как средства коррекции неблагоприятных изменений в организме при моделировании физиологических эффектов невесомости». Дальнейшее изучение и анализ биоматериала проводились на кафедре биологии и НИИ ЭБМ Воронежской государственной медицинской академии имени Н.Н.Бурденко. Объект исследования – печень белых беспородных половозрелых крыс (самцов) четырех экспериментальных групп, каждая из которых была представлена 7 животными. Первую группу составил животные виварийного контроля. Животные второй группы подвергались моделированию гравитационной разгрузки путем антиортостатического вывешивания животных в течении 14 суток по стандартной методике Ильина-Новикова в модификации Morey-Holton [20]. Третья и четвертая группы крыс обследовались спустя 3 суток после завершения вывешивания, во время которых животные последней группы подвергались влиянию НИМП. В качестве источника магнитного поля была использована установка «Бутон-3», генерирующая электромагнитные волны с максимальным значением магнитной индукции в рабочей зоне 3.5 мТл при максимальном напряжении конденсаторов 500 В. Воздействие магнитным полем осуществлялось тотально, при этом животные размещались в рабочей зоне установки в контейнере с прозрачными стенками без фиксации. Режим НИМП представлял собой три последовательных 10-ти минутных воздействия с определенными значениями магнитной индукции (см. табл.1). Общая экспозиция магнитного поля составила 30 минут. Действие НИМП в режиме №1 использовалось в первые сутки, а в режиме №2 – во вторые и третьи сутки после моделирования физиологических эффектов невесомости.
Материал для идентификации содержания и распределения гликогена получали из середины левой доли печени. Пластинки ткани толщиной не более 1 мм погружали в охлажденный до −20оС фиксатор Россмана на 18-20 часов, после чего промывали в трех сменах абсолютного этанола. Материал проводили через две смены диоксана и заливали в парафин. На срезах толщиной 7 мкм гликоген идентифицировали ШИК-реакцией, при этом альдегидные группы, не принадлежащим молекулам гликогена избирательно блокировались [15]. Для верификации полученных данных проводилась выборочная проверка срезов амилазой. На светооптическом уровне содержание и топохимия гликогена оценивалась в дольках печени по направлению от триад к центральной вене. В необходимых случаях оценивали соотношение между накоплением гликосом и физиологическими формами внутриклеточного распределения гранул гликогена, оценивая топографию и уровень агрегации α- и β-частиц. Количественный анализ содержания гликогена в гепатоцитах печени проводился с помощью системы анализа изображений «ВидеоТест-Морфо» (версия 3.0) при использовании объектива х40. Перед проведением измерений проводили калибровку системы стандартными фильтрами светопропускания. Осветитель микроскопа подключался к стабилизатору напряжения Statron. На каждом гистологическом препарате в перипортальных, перицентральных и промежуточных зонах классических печеночных долек измеряли оптическую плотность цитоплазмы не менее 500 гепатоцитов, из которых при анализе исключали территорию ядра. Значение необходимого числа клеток для подсчетов было определено методом аккумулированных средних [5]. Количество поглощенного красителя в цитоплазме было пропорционально содержанию гликогена и в конечном итоге определяло оптическую плотность гепатоцитов. Полученные данные обрабатывались статистически с использованием пакета стандартных компьютерных программ, достоверность различий определялась при помощи критерия Стьюдента с уровнем значимости p<0,05.
Результаты и их обсуждение
У животных группы виварийного контроля в печени обнаруживались индивидуальные различия содержания гликогена в дольках печени. Определенная закономерность заключалась в том, что гепатоциты с наибольшим содержание полисахарида располагались преимущественно в промежуточной зоне долек, тогда как в направлении к портальной триаде или центральной вене локализовались клетки с меньшим количеством гликогена (фото 1 - А). Однако, наблюдался и центральный тип расположения гликогена в дольке, при котором его количество постепенно уменьшалось в направлении от центральной вены к периферическим отделам дольки. Количественная оценка определения оптической плотности гликогена в цитоплазме гепатоцитов подтвердили результаты визуальной оценки. Наибольшими показателями оптической плотности цитоплазмы обладали клетки промежуточной области дольки, меньшими – клетки из центральной и перипортальной зон (табл. 2). Исследование внутриклеточной организации гликогена показало его присутствие в форме крупных интенсивно окрашенных α-гранул величиной до 1 мкм, диффузно расположенных в цитоплазме, и более мелких β-гранул, которые локализовались отдельно или формировали скопления. Иногда α-гранулы обнаруживались преимущественно в периферической зоне цитоплазмы или, наоборот, локализовались в ее перинуклеарной области. Имеет место определенная закономерность внутриклеточного накопления гранул гликогена: в цитоплазме некоторых гепатоцитов полисахарид обнаруживался исключительно в форме α-гранул, либо только в виде β-гранул, однако в большей части клеток присутствовали как крупные, так и более мелкие гранулы.
Таблица 1. Режимы воздействия магнитным полем

Таблица 2. Оптическая плотность гепатоцитов крыс (в усл.ед.)
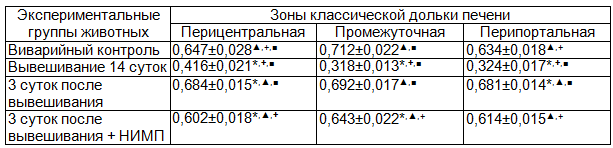
Примечания: * - p<0,05 по сравнению с показателями группы виварийных животных; ▲ − p<0,05 по сравнению с показателями группы крыс, подвергавшихся 14-суточному вывешиванию; + − по сравнению с показателями животных, обследованных спустя 3 суток после вывешивания; ■ – по сравнению с показателями животных, подвергавшихся воздействию НИМП во время 3-суточного периода после завершения вывешивания.
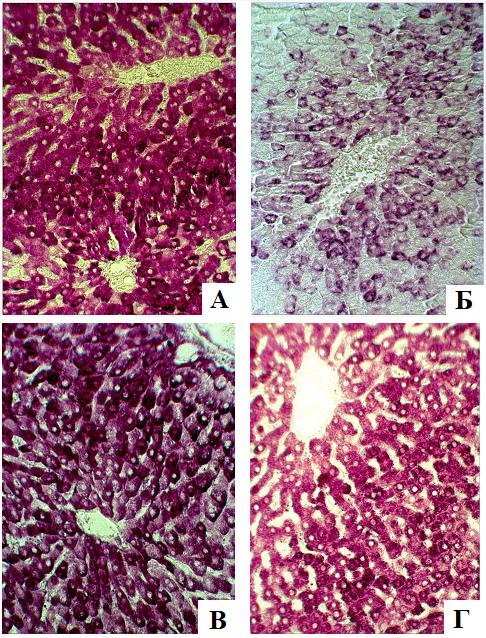
Фото 1. Гликоген печени крыс. Фиксатор: смесь Россмана. Методика: ШИК-реакция с димедоном, рН 2,4. Увеличение: 25х10: А – виварийный контроль. Высокое содержание полисахарида в гепатоцитах промежуточной зоны; Б – 14-суточное вывешивание. Выраженная редукция гранул гликогена, который обнаруживается преимущественно в гепатоцитах перицентральной зоны дольки; В – спустя 3 суток после вывешивания. Существенное возрастание уровня гликогена в дольке печени; Г – спустя 3 суток после вывешивания в условиях воздействия НИМП. Высокое содержание гликогена в гепатоцитах промежуточной зоны дольки печени.
После 14-суточного вывешивания в печени крыс обнаруживалось существенное снижение содержания гликогена в каждой зоне дольки (табл. 2). Гликоген сохранялся преимущественно в гепатоцитах, расположенных в центре долек вокруг v.centralis, тогда как в клетках промежуточной зоны и, особенно, перипортальной территории выявляемый полисахарид подвергался выраженной редукции (фото 1-Б, табл. 2). Возрастала частота встречаемости гепатоцитов, цитоплазма которых была полностью лишена гликогена. В этой связи формировалась выраженная гетерогенность содержания гликогена смежными гепатоцитами. В цитоплазме клеток выявлялись преимущественно альфа-гранулы, расположенные в цитоплазме без какой-либо упорядоченной топографии, β-гранулы отсутствовали.
Спустя 3 суток после завершения 14-суточного вывешивания, несмотря на высокие индивидуальные особенности животных, содержание гликогена в гепатоцитах существенно возрастало по сравнению с группой крыс, обследованных непосредственно после моделирования физиологических эффектов невесомости, в промежуточной зоне достигая, а перицентральной и перипортальной областях достоверно превышая аналогичные показатели животных группы виварийного контроля (фото 1–В, табл.2). При этом градиент распределения гликогена в дольках, характерный для животных группы виварийного контроля, нивелировался: результаты цитофотометрического исследования показали приблизительно равное содержание гликогена в гепатоцитах вне зависимости от внутридольковой локализации (табл. 2). Следует отметить, что внутри долек формировалась высокая гетерогенность смежных клеток по количеству гликогена, отражая их различную вовлеченность в углеводный обмен. Внутриклеточная организация гликогена была представлена как крупными α-гранулами, расположенными диффузно, так и β-гранулами, представительство которых в цитоплазме гепатоцитов по сравнению с показателями виварийного контроля возрастало.
В условиях применения после 14-суточного вывешивания низкочастотного импульсного магнитного поля внутридольковая топография полисахарида соотносилась с морфологическими картинами, характерными для животных группы виварийного контроля. Так же, как и у интактных крыс, гепатоциты с наибольшим уровнем гликогена располагались в промежуточной зоне долек печени, тогда как вокруг центральной вены и печеночных триад располагались клетки с меньшим его содержанием (фото 1-Г). Однако, цитофотометрическое исследование выявило меньшее количество гликогена в гепатоцитах перицентральной и промежуточной зоны долек печени, как в сравнении с крысами, восстановление которых проходило без воздействия электромагнитного фактора, так и группой виварийного контроля (табл. 2). Выявленные показатели носили выраженные индивидуальные отличия у животных. В частности, у двух крыс наблюдалась определенная ротация - в гепатоцитах, локализованных перипортально, гликоген накапливался с большей динамикой по сравнению с другими функциональными зонами долек. Видимо, это послужило причиной для формирования достоверных отличий только в сравнении с результатами немодифицированной группы животных (табл. 2). Внутриклеточная организация гликогена по сравнению с немодифицированными животными характеризовалась возрастанием представительства α-гранул и уменьшением β –гранул.
Анализируя полученные данные, можно сделать вывод, что использование магнитного поля в качестве модификатора восстановительного периода после моделирования некоторых физиологических эффектов невесомости способно изменять интенсивность метаболизма гликогена в гепатоцитах. Об этом свидетельствует снижение уровня полисахарида в печени крыс при использовании НИМП в восстановительном периоде по сравнению с аналогичными показателями немодифицированных животных. Имеющиеся зональные особенности гепатоцитов по содержанию гликогена подчеркивают неравнозначность их участия в адаптивных процессах при действии магнитного фактора. При этом, более лабильными по критерию содержания гликогена оказываются клеточные популяции, локализованные вокруг v.centralis. Возможно, что НИМП в выбранном диапазоне повышает метаболическую активность полисахарида и, соответственно, поступление глюкозы в кровь. В частности, ряд полученных ранее экспериментальных данных, касающихся морфофункционального состояния ядерного аппарата, свидетельствует о признаках повышения функциональной активности гепатоцитов при использовании магнитного поля как модификатора восстановительных процессов после вывешивания. Вопрос о механизме выявленных эффектов низкоинтенсивного магнитного поля на содержание гликогена в гепатоцитах представляется весьма дискутабельным в связи с многочисленными экспериментальными данными о разносторонней биологической активности электромагнитного воздействия, проявляющейся, в том числе, и на геномном уровне [4, 6, 10].
