Введение. Заболевания венозной системы нижних конечностей являются наиболее распространённой патологией периферических сосудов. Они встречаются у 26-38% женщин и 10-20% мужчин трудоспособного возраста. В России ежегодно более 35 млн. человек с хроническими заболеваниями венозной системы нижних конечностей нуждается в специализированной помощи, 1,5 млн. из которых имеют инвалидность, страдая тяжёлыми трофическими расстройствами [12].
Наряду с «классическими» этиологическими факторами острой и хронической венозной патологии происходит переосмысление взглядов на механизмы развития данных патологических состояний. В частности, в последние годы, всё большее количество сторонников получает теория дисфункции эндотелия (ЭД) в развитии различных заболеваний вен [12]. Имеется ряд исследований, в которых отмечается тенденция увеличения частоты развития венозных тромбозов у лиц с атеросклеротическим поражением артерий различных бассейнов, при этом, роль дисфункции эндотелия в развитии последнего на сегодняшний день имеет широкую доказательную базу [4, 5, 11, 15].
Теория дисфункции эндотелия – многогранна, с множеством вероятных механизмов повреждения эндотелиоцитов, таких как активированные лейкоциты, свободные радикалы и продукты перекисного окисления липидов (ПОЛ), пероксинитрит (NOOO–), гипопродукция оксида азота (II) (NO) вследствие различных факторов [4, 5]. Получены убедительные данные о важной роли NO как основного маркера функционального состояния эндотелия (ФСЭ) и его нарушений [2, 5].
В связи с накоплением клинического и лабораторного материала по данной проблеме, возросла потребность к экспериментальному воспроизведению дисфункции эндотелия венозной стенки.
В качестве модели эндотелиальной дисфункции в настоящее время широкое распространение получило применение ингибитора синтаз NO N-нитро-L-аргинин метилового эфира (L-NAME), приводящее к ЭД путём снижения содержания NO в сыворотке крови, вследствие гипопродукции [2].
Самой широкой группой препаратов, применяемой при различных заболеваниях вен, на сегодняшний день, остаются флебопротекторы. Очищенная микронизированная флавоноидная фракция диосмина (МОФФ) является представителем препаратов группы выбора с доказанными эффектами на проницаемость капилляров, активацию лейкоцитов и свободнорадикальное окисление [1, 13]. В настоящее время, МОФФ широко применяется и при атеросклерозе различных артериальных бассейнов, при котором, роль эндотелиальной дисфункции весьма велика [9, 14]. Учитывая влияние данного препарата на процессы, участвующие в развитии эндотелиальной дисфункции, изучение его эффектов на биохимические маркеры функционального состояния эндотелия представляется весьма перспективным.
Цель исследования: оценка эффективности моделирования венозной эндотелиальной дисфункции препаратом L-NAME в эксперименте на животных с последующей её коррекцией очищенной микронизированной флавоноидной фракцией диосмина.
Материалы и методы. Исследуемую группу составили 35 животных (крысы линии Wistar массой 250 – 350 г). Все животные содержались в условиях вивария: стандартная экспериментальная биологически чистая комната, освещение 12 ч/12 ч светлый/темный цикл, t = 22-24ºС. Все исследования проводили в одно и то же время суток во второй половине дня с соблюдением принципов, изложенных в «Конвенции по защите позвоночных животных, используемых для экспериментальных и других научных целей» (Страсбург, 1986) [3] и приказом Минздрава СССР № 742 от 13.11.1984 г. [10].
Животным выполнялось внутрибрюшинное введение N-нитро-L-аргинин метилового эфира (L-NAME) в дозе 25 мг/кг/сутки в течение 7 суток. C 8 суток от начала эксперимента и на протяжении 6 месяцев животным энтеральным путём вводилась суспензия очищенной микронизированной флавоноидной фракцией диосмина в дозе 100 мг/кг/сутки. Вывод животных из эксперимента в количестве 7 особей производился путём передозировки раствором сернокислой магнезии на 8-е сутки, 1, 2, 3 и 6 месяцы от начала эксперимента. В условиях операционной у крыс под наркозом (табл. 1) осуществлялся забор крови из нижней полой вены в стерильные пробирки с последующим определением биохимических показателей ФСЭ и антиоксидантного статуса.
Выведение животных на протяжении периода исследования осуществлялось ввиду необходимости для определения исследуемых показателей около 5 мл крови от особи, что само по себе является фатальной кровопотерей для животного.
Цельная кровь центрифугировалась при 3000 об./мин. в течение 15 минут. Эритроциты гемолизировали разбавлением дистиллированной водой в соотношении 1:10. Активность супероксиддисмутазы (СОД) определялась в гемолизате по методу, основанному на реакции окисления кверцетина [7]. Содержание малонового диальдегида (МДА) в гемолизате определяли по методу, основанному на реакции с тиобарбитуровой кислотой [6]. Определение СОД и МДА выполнено на фотометре КФК-3-01-«ЗОМЗ». Содержание метаболитов NO определяли в сыворотке крови на ИФА - анализаторе «Stat Fax 2100» по методике Метельской В.П. [8].
Таблица 1. Этапы проведения наркоза

Статистическая обработка полученных результатов осуществлялась с помощью программы Statistica 6.0.
Результаты и обсуждение. Колебание исследуемых показателей в различные сроки в исследуемой группе представлены в табл. 2.
Таблица 2. Значение исследуемых показателей в различные сроки наблюдения
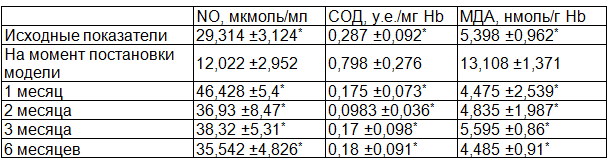
Примечание: * - значимое отличие от уровня на момент постановки модели (р<0,05).
Как видно из табл. 2, колебания основных биохимических показателей функционального состояния эндотелия, которые были определены в исследовании, позволяют с уверенностью говорить, что препарат L-NAME модулирует ФСЭ, с заметными изменениями биохимического профиля: достоверно снижается уровень NO при одновременном увеличении содержания малонового диальдегида (МДА) и, как следствие, повышении активности супероксиддисмутазы (СОД). МДА является конечным продуктом процессов перекисного окисления липидов (ПОЛ) и, следовательно, важным маркером этого процесса. СОД является важным компонентом антиоксидантной системы, катализирует реакцию превращения супероксида в Н2О2. Оксид азота (II) и СОД конкурируют за супероксид-анион, при этом, конкуренция – разнонаправлена по конечным эффектам: при взаимодействии последнего с NO образуется NOOO–- клеточный яд. Высокая концентрация СОД в сыворотки крови животных говорит об активности антиоксидантной системы. Применение МОФФ приводит к стойкому увеличению уровня NO, снижению МДА и уменьшению активности СОД на протяжении всего периода исследования, что говорит о нормализации процессов ПОЛ. Активность СОД на фоне применения МОФФ снижается, возможно, вследствие уменьшения содержания продуктов ПОЛ (малонового диальдегида). Таким образом, все исследуемые параметры на фоне применения МОФФ вернулись к своим исходным значениям уже к 1 месяцу исследования и оставались на этом уровне на протяжении всего периода наблюдения.
Положительное влияние МОФФ, препарата с выраженным флеботропным эффектом, на ФСЭ при моделировании ЭД введением L-NAME, говорит о развитии дефицита синтеза NO эндотелием венозного русла, т.е. его дисфункции, что имеет важное значение для дальнейших экспериментальных работ в данной области.
Выводы
1. Модель L-NAME-индуцированной эндотелиальной дисфункции имеет большое научное значение и с успехом может применяться для экспериментального воспроизведения эндотелиальной дисфункции венозной системы.
2. Применение МОФФ в сердечно - сосудистой хирургии и флебологии возможно с позиции его положительного влияния на ФСЭ.
