В результате перераспределение жидких сред в краниальном направлении, происходят изменения в функциональной деятельности сердца [1, 2].
Инверсия гидростатического градиента давления и возрастание объема циркулирующей крови в кардиоторакальной области формируют новое равновесное состояние системы сердца [3]. В отличие от ортостатической позы, где адаптивные механизмы вырабатываются в процессе филогенеза и онтогенеза, при антиортостатической гипокинезии (АНОГ) эти механизмы отличаются от критериев физиологической нормы [4]. Существует объективная потребность в более четком понимании физиологических процессов и возникающих при воздействиях АНОГ функциональных перестроек сердца, выводящих его деятельность на новый физиологический уровень.
В настоящее время отсутствуют данные об изменении электрических свойств в интрамуральных слоях миокарда, а именно реполяризационных свойств в различных областях желудочков во время антиортостатической гипокинезии.
Целью данной работы явилось изучение реполяризационных свойств миокарда желудочков в условии антиортостатической гипокинезии.
Материалы и методы. Исследования выполнены на 12 взрослых беспородных собаках обоего пола, массой тела 30±5 кг, в соответствии с международными правилами обращения с экспериментальными животными Guide for the Care and Use of Laboratory Animals.
Собак наркотизировали золетилом (15 мг/кг внутримышечно), фиксировали в положении лежа на спине на специальном устройстве, позволяющем создавать АНОГ под углом 45º и 60º. После вскрытия грудной клетки температуру тела животного во время эксперимента поддерживали на уровне 37-38º С.
Интрамуральные электрограммы регистрировали с помощью равно расположенных друг от друга игольчатых электродов. Электроды устанавливали в миокард основания правого (ПЖ) и левого (ЛЖ) желудочков, в верхушки обоих желудочков и среднюю часть ЛЖ.
Момент восстановления возбудимости (время реполяризации) определяли по точке максимума первой производной по времени (dV/dtmax) в период ST-T комплекса. Интервал активация-восстановление (ARI) определяли как временной период между моментами деполяризации (dV/dtmin в период комплекса QRS) и реполяризации (dV/dtmax в период ST-T комплекса).
Электрические параметры регистрировали в горизонтальном положении, с первой минуты АНОГ, затем через каждые 5 минут в течение 30 минут при последовательном изменении угла наклона АНОГ 45º и 60º.
Статистическую обработку проводили с помощью программ STATISTICA 6.0., BIOSTAT 4.03. Для оценки различий параметров до и после воздействия применяли критерий Уилкоксона, тест Фридмана с последующим применением критерия Ньюмена-Кейлса. Различия признавали значимыми при р<0,05.
Результаты исследования. Реполяризация. Показано, что, начиная, с 30-й минуты АНОГ 45º и на всем протяжении эксперимента в условии АНОГ 60º в правом и левом желудочках происходит увеличение времени реполяризации по отношению к горизонтальному положению (p<0,05) (рис. 1).
При этом в основании ПЖ выявляется трансмуральный градиент реполяризации на 20-й минуте АНОГ 60º (p<0,05), где последовательно реполяризуется субэндокардиальный (246,3±3,9 мс), интрамуральный (253,9±5,2 мс; p<0,05), и субэпикардиальный (257,5±3,8 мс; p<0,05) слои миокарда основания ПЖ.
В верхушке ПЖ трансмуральный градиент реполяризации не выражен. Однако в условиях АНОГ 45º на 1-й минуте формируются ранние очаги реполяризации в интрамуральных слоях, затем реполяризуются субэпикард и субэндокард. В области верхушки ПЖ на 1-й минуте АНОГ 60º первыми реполяризуются интрамуральные слои, а на 30-й минуте АНОГ 60º практически одновременно реполяризация начинается в субэндокарде и субэпикарде с распространением в интрамуральные слои верхушки ПЖ (рис. 1).
В основании ЛЖ выявлен трансмуральный градиент реполяризации на 10-й минуте АНОГ 45º (p<0,05).
В средней части свободной стенки ЛЖ трансмуральный градиент реполяризации формируется на 1-й минуте АНОГ 60º (p<0,05) (рис.1). Первым реполяризуется субэндокардиальный слой (240,9±1,7 мс), по сравнению с субэпикардиальным (246,7±1,9 мс; p<0,05) слоем миокарда средней части свободной стенки ЛЖ. На 30-й минуте АНОГ 60º происходит инверсия движения волны реполяризации в направлении от субэпикарда ЛЖ к субэндокарду (рис. 1).
В области верхушки ЛЖ трансмуральный градиент реполяризации формируется на 10-й минуте АНОГ 60º (p<0,05), где в первую очередь реполяризуется субэндокардиальный, по отношению к субэпикардиальному слою миокарда верхушки ЛЖ (рис. 1).
В условиях АНОГ в ПЖ на 1-й минуте АНОГ 60º выявлен апикобазальный градиент реполяризации (p<0,05). Так последовательность реполяризации на 1-й минуте АНОГ 60º направлена от верхушки (246,8±6,3 мс) к основанию (253,8±13,1 мс; p<0,05). Начиная с 10-й минуты, и в течение всего периода исследования в условии АНОГ 60º, в ПЖ происходит инверсия апикобазального на базоапикальный градиент реполяризации (p<0,05), вследствие того, что основание реполяризуется раньше верхушки (p<0,05).
В ЛЖ с 1-й минуты АНОГ 45º по 1-ю минуту АНОГ 60º первыми реполяризуются (p<0,05) интрамуральные слои, позже – верхушечная и базальная части желудочка. Во время дальнейшего пребывания тела в условиях АНОГ 60º на 20-й минуте возникает апикобазальный (p<0,05), а на 30-й минуте – базоапикальный (p<0,05) градиенты реполяризации.
Локальные длительности реполяризации. В правом и левом желудочках начиная с 30-й минуты АНОГ 45º и в течение всего эксперимента в условии АНОГ 60º имеет место, увеличение ARI во всех интрамуральных слоях миокарда по сравнению с данными, полученными в исходным горизонтальном положением тела (p<0,05) (рис. 2).
В ПЖ трансмуральное распределение длительностей ARI не изменяется на протяжении всего исследования в условиях АНОГ. В ЛЖ в базальной и апикальной областях обнаружен трансмуральный градиент локальных длительностей реполяризации на 20-й минуте АНОГ 45º (p<0,05), где длительности активация - восстановление увеличиваются от субэпикарда к субэндокарду (p<0,05) (рис. 2).
В условиях АНОГ в ПЖ базоапикальный градиент распределения локальных длительностей реполяризации обнаружен на 1-й минуте АНОГ 45º и на 30-й минуте АНОГ 60º, направленный от основания в сторону его верхушки (p<0,05). В ЛЖ в условии АНОГ апикобазальный градиент распределения локальных длительностей реполяризации не обнаружен. При этом, как в ПЖ, так и в ЛЖ, происходит увеличение локальных длительностей реполяризации, по отношению к исходному положению тела во всех областях желудочков начиная с 30-й минуты АНОГ 45º и в течение 30-ти минут АНОГ 60º (p<0,001).
Выявлен межжелудочковый градиент локальных длительностей реполяризации (p<0,05). Установлено, что длительности ARI начинают укорачиваться в ПЖ с 20-й минуты АНОГ 45º по 30-минуту АНОГ 60º, по отношению к ЛЖ (p<0,05).
Обсуждение результатов. В первые минуты АНОГ выявляются разнонаправленные изменения электрических функциональных свойств сердца, более выраженных в основании и верхушке ЛЖ. Это позволяет рассматривать ранние механизмы адаптации сердца к АНОГ, как аварийные, краткосрочные, обусловленные как мы полагаем кратковременностью усиленного симпатического эффекта, направленного с одной стороны на сохранение сократительной функции сердца. С другой стороны, это ведет к обеспечению функциональных связей между физиологическими системами организма. В дальнейшем с увеличением времени пребывания в АНОГ включаются механизмы, регулирующие деятельность сердца для обеспечения длительного сохранения эффективности сокращений ЛЖ. Формируется определенный уровень электрического ремоделирования миокарда, в виде появления мозаичной однородности процессов реполяризации, и локальных длительностей реполяризации не свойственной нормальному миокарду. По истечению 30 минут с увеличением времени АНОГ и изменения угла относительно горизонтальной поверхности мозаичность и разнонаправленность реакций сменяются образованием региональной однородности электрических свойств миокарда. Устанавливаются цикличные изменения электрофизиологческих свойств в основании и верхушке ЛЖ, характеризующие функциональное ремоделирование миокарда. Выявляется ранняя реполяризация интрамуральных слоев миокарда ЛЖ. Установлено, что при АНОГ последовательность реполяризации определяется изменением длительности ARI в желудочках, уменьшая при этом различия во времени восстановления между эпикардом и эндокардом.
Регулирующая роль в выравнивании трансмурального градиента дисперсии реполяризации обеспечивается изменением градиента тока Ito. Распределение, которого является генетически детерминируемым процессом и играет важную роль в установлении аутоидентичности различных участков сердца. Возможно, ток Ito определяет временную заданную функциональную организацию миокарда на локальном и региональном уровнях [5, 6].
Перераспределение объемов крови в кардио-торакальную область увеличивает механическую нагрузку на сердце и приводит к локальной чрезмерной перегрузке кардиомиоцитов (КМЦ) в базальных отделах и локальной «недогрузки» в области верхушки ЛЖ. В областях с максимальным растяжением в диастолу снижается анизотропия миокарда, возникает так называемый «функциональный дуализм» КМЦ [7], который, возможно, компенсируется увеличением числа межмитохондриальных контактов (ММК) [8]. При патологическом растяжении фибробласты индуцируют пролонгированную автодеполяризацию КМЦ в конце реполяризации, удлиняя потенциал покоя [9], тем самым увеличивается время реполяризации. В условиях гиперфункции миокарда блокируется межклеточное взаимодействие, увеличивается межклеточное сопротивление, что способствует электрическому и механическому разобщению кардиомиоцитов [10]. В области верхушки ЛЖ механическая «разгрузка» сопровождается дедифференцировкой КМЦ и потерей ими специфических структурных свойств, обеспечивающих сопряжение электрического возбуждения с механическим сокращением [11]. Можно предположить, что «недогрузка» объемом верхушки левого желудочка, приводит к перераспределению максимального градиента внутрижелудочкового давления в конце систолы со средних областей ЛЖ в область верхушки и основания, что и определяет локальное и региональное электрофизиологическое ремоделирование этих областей миокарда. Функциональные изменения в КМЦ, стремящиеся ослабить или нейтрализовать результаты воздействия АНОГ на сердце, модифицируют структуру миокарда в ряд морфо-функциональных состояний через вариативность функционирования подсистем [12] в зависимости от потребностей организма в гемодинамическом обеспечении. Выявленные однотипные изменения электрических свойств в области основания и верхушки ЛЖ, обусловлены согласованной деятельностью КМЦ, которая направлена на выравнивание суммарного энергетического потенциала на их поверхности, вследствие измененных кабельных свойств, и свидетельствует об образовании новой структурной организации, на основе кластерного управления функциями миокарда [13].
Можно полагать, что при АНОГ нарушается принцип субординации и функционального взаимодействия физиологических систем, сердце не участвует в разнообразных реакциях кровообращения, т.е. система сердца становится изолированной. Гетерогенность миокарда, как основа его функциональной деятельности, формировалась при усложнении организации сердца для обеспечения функциональной механической целостности, но до определенных ее пределов, вне которых реализуются генетические фундаментальные механизмы обратной частичной эволюции. Контроль над этими процессами опосредуется внутриклеточными и внеклеточными сигнальными системами, ответственными за проявление филогенетических форм в процессе адаптации [14, 15]. Инверсия вектора гравитации способствует раннему переводу функционирования сердца на механизмы фетального фенотипа, которые обеспечивают энергетически более экономный режим функциональной деятельности, за счет упрощения функций сердца.
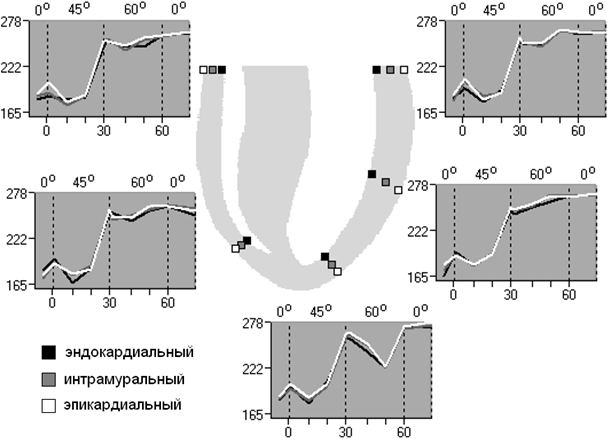
Рис. 1. Трансмуральная последовательность реполяризации миокарда желудочков собаки при АНОГ; ПЖ – правый желудочек, ЛЖ – левый желудочек. По горизонтальной оси (низ) – указаны периоды времени АНОГ в минутах (мин.); по вертикальной оси – указано время окончания реполяризации в миллисекундах (мс).
Периоды времени, в которые животные находились в разном положении, разделены на зоны с помощью штриховки, сверху каждой зоны посередине указан угол наклона туловища.
Нулевой момент на шкале времени соответствует моменту, когда животное наклонили на 45°; параметры, предшествующие нулевому моменту, соответствуют исходному горизонтальному положению туловища.
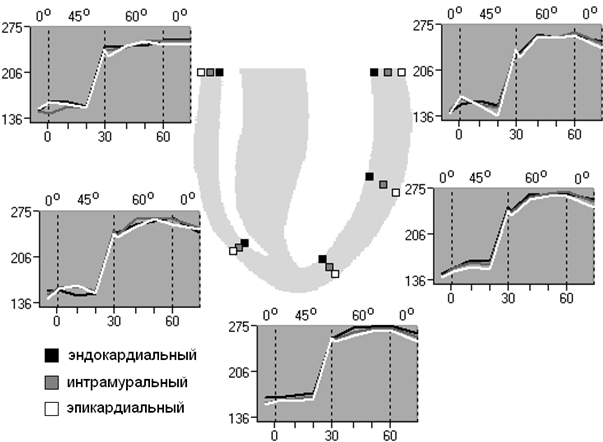
Рис. 2. Трансмуральная последовательность интервалов активация-восстановление миокарда желудочков собаки при АНОГ; ПЖ – правый желудочек, ЛЖ – левый желудочек. По горизонтальной оси (низ) – указаны периоды времени АНОГ в минутах (мин.); по вертикальной оси – указано время интервалов активация - восстановление в миллисекундах (мс).
Периоды времени, в которые животные находились в разном положении, разделены на зоны с помощью штриховки, сверху каждой зоны посередине указан угол наклона туловища.
Нулевой момент на шкале времени соответствует моменту, когда животное наклонили на 45°; параметры, предшествующие нулевому моменту, соответствуют исходному горизонтальному положению туловища.
