Введение. Дыхательная недостаточность является частым ранним признаком острого деструктивного панкреатита (ОДП). ОП развивается в 20-50% наблюдений в связи с наличием реактивного плеврального выпота, базальных ателектазов, лёгочных инфильтратов, пневмонии, эмпиемы плевры, отёка лёгких, высокого стояния диафрагмы и ограничения её подвижности, ретроперитонеального отёка, панкреато-бронхиального, панкреато-плеврального свищей, тромбоэмболии ветвей лёгочных артерий и инфарктной пневмонии, чрезмерном переливании растворов [1,9,10].
Респираторные осложнения являются причиной смерти в 5-72% наблюдений [2,5,6,8]. Прямые воздействия панкреатических ферментов и вазоактивных пептидов оказывают на диафрагму, париетальную и висцеральную плевру, паренхиму и сосуды лёгких. Образующиеся при остром панкреатите токсины оказывают большое влияние на системный и легочный кровоток, что приводит к снижению артериального и перфузионного давления, развитию застойных явлений в малом круге кровообращения. Это способствует выделению в лёгких свободных жирных кислот, способных повреждать альвеолярно-капиллярную мембрану с последующей транссудацией жидкости в интерстициальную ткань альвеолы, развитием отёка, снижением газообмена внутрисосудистому диссеминированному свёртыванию крови, тромбоэмболии ветвей лёгочной артерии.
Панкреатические ферменты играют важную, но не основную роль в патогенезе ОДП [3,4]. Согласно современным данным одним из ведущих звеньев патогенеза ОП является развитие синдрома системного воспалительного ответа (ССВО) в результате острого воспаления ткани поджелудочной железы [7,8]. ССВО - комплекс клинических, биохимических, микробиологических и морфологических критериев воспалительного процесса [5]. Между тем в доступной нам литературе мы не обнаружили данных о динамике и степени выраженности морфологических признаков ССВО (морфологического субстрата) при экспериментальном остром деструктивном панкреатите.
Цель исследования:
- Изучить морфологические изменения внутренних органов (поджелудочной железы, легких, сердца) крыс при ОДП, вызванные криовоздействием на селезеночный сегмент поджелудочной железы хлорэтила.
- Исследовать способность клеток крови к продукции провоспалительных, противовоспалительных и ростовых цитокинов интерферона-гамма (INF-ɣ), фактора некроза опухоли-альфа (TNF-α), интерлейкина-1-альфа (IL-1α), интерлейкина-4 (IL-4), гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF) и моноцитарного хемоаттрактантного протеина-1 (MCP-1) у экспериментальных животных.
Материалы и методы исследования. Модель ОДП на 40 беспородных белых крысах обоего пола массой 180 -220 г создавали путем криовоздействия на селезеночный сегмент поджелудочной железы хлорэтилом в соответствии с «Правилами проведения работ с использованием экспериментальных животных» [3,7].
До и после операции грызуны находились на стандартном лабораторном рационе при неограниченном количестве воды. У крыс в асептических условиях под эфирным наркозом после выполнения верхнесрединной лапаротомии производили иммобилизацию поджелудочной железы. Селезеночный сегмент железы и селезенку помещали в лапаротомную рану и отграничивали от брюшной полости полиэтиленовой пленкой. Длительность криовоздействия составляла около 1 минуты - до образования инея на поверхности охлаждаемого участка. Через 2-3 минуты пораженный участок поджелудочной железы спонтанно оттаивал. Забой животных с последующим исследованием аутоптатов внутренних органов (сердце, легкие, поджелудочная железа) проводили через 1 час и на 1-3-7-14-е сутки после операции. Исследования внутренних органов крыс производили с помощью световой микроскопии, срезы аутоптатов были окрашены гематоксилином и эозином. Для определения цитокинов интерферона-гамма (INF-гамма), фактора некроза опухоли-альфа (TNF-α), интерлейкина-1-альфа (IL-1α), интерлейкина-4(IL-4), гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF) и моноцитарного хемоаттрактантного протеина-1 (MCP-1) был использован набор «Rat Cytokines 6plex Kit» (Bender MedSystems, Австрия)
Результаты. При микроскопическом исследовании через 1 час после моделирования ОДП в миокарде отмечались участки пересокращения кардиомиоцитов, местами с разрывом мышечных волокон и формированием интерстициального отека. В легких резко выраженное сосудистое полнокровие и кровоизлияния в альвеолы сочетались с очажками острой эмфиземы и единичными лимфоидными инфильтратами в межальвеолярных перегородках.
Через 24 часа в миокарде отмечалось полнокровие сосудов микроциркуляторного русла с единичными диапедезными кровоизлияниями (рис.1,б). В легких также нарастали явления расстройства кровообращения в виде полнокровия сосудов межальвеолярных перегородок и диапедезных кровоизлияний в них. Кроме этого, в легких увеличивалась инфильтрация межальвеолярных перегородок лимфоцитами и макрофагами с увеличением в размерах участков острой эмфиземы (рис.1,а).
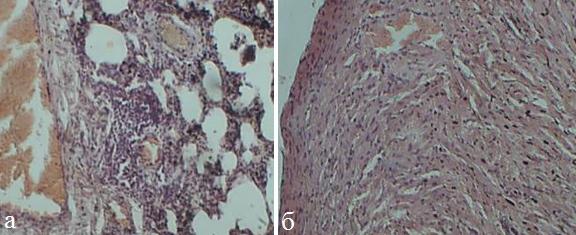
Рис. 1. Микрофото легких (а) и миокарда (б) крысы (ОДП, 1 сутки). Окраска гематоксилином и эозином, х 200.
Таблица 1. Содержание цитокинов у крыс в 1-е сутки эксперимента по моделированию ОДП
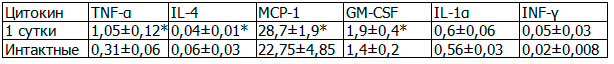
При анализе содержания цитокинов у экспериментальных животных установлено повышение уровня провоспалительных цитокинов: TNF-α в 3,38 раза, MCP-1 в 1,26 раза, GM-CSF в 1,35 раза (в сравнении с интактными животными), при этом отмечалось снижение IL-4, но неизменным остался уровень IL-1α.
На 3-и сутки ОП дистрофические изменения в органах увеличились, усилились расстройства микроциркуляции (рис.2,б). В легких также выявлялась отрицательная динамика: нарастали явления интерстициального воспаления (рис.2,а).
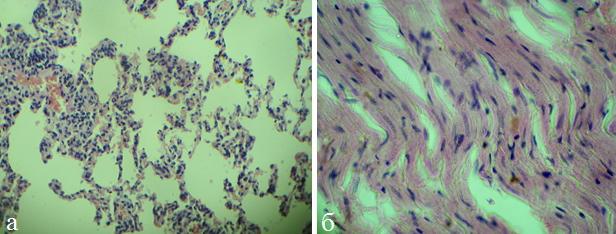
Рис. 2. Микрофото легких (а) и миокарда (б) крысы (ОДП, 3 сутки). Окраска гематоксилином и эозином, х 200.
Таблица 2. Содержание цитокинов у крыс в 3-е сутки эксперимента по моделированию ОДП
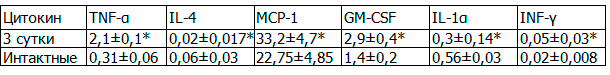
Продолжает повышаться уровень провоспалительных цитокинов: TNF-α в 6,7 раза, MCP-1 в 1,45 раза, GM-CSF в 2 раза, а содержание интерлейкинов снижается в 3 раза (IL-4) и в 1,8 раза (IL-1α).
К 7-м суткам в миокарде преобладали очаговая бурая атрофия кардиомиоцитов, присутствовал незначительный отек стромы, отмечалось полнокровие сосудов и очаговых кровоизлияний между волокнами кардиомиоцитов (рис.3,б). В легких обнаруживались признаки спазма мелких бронхов, пневмонита, участков дистелектазов - чередование очагов острой эмфиземы и ателектаза (рис.3,а).
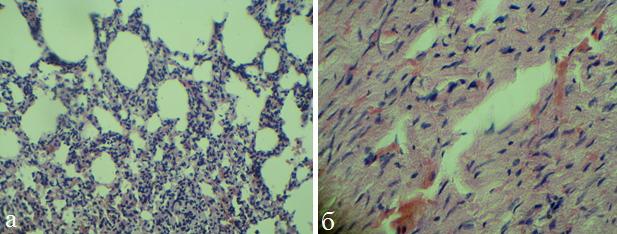
Рис. 3. Микрофото легких (а) и миокарда (б) крысы (ОДП, 7 сутки). Окраска гематоксилином и эозином, х 200.
Таблица 3. Содержание цитокинов у крыс в 7-е сутки эксперимента по моделированию ОДП
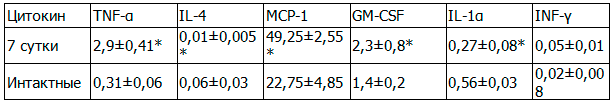
Цитокиновый «взрыв» показал нарастание провоспалительных цитокинов в 1,6-9,1 раз (GM-CSF- TNF-α соответственно) с незначительным количеством интерлейкинов, что усилило воспалительную реакцию в поджелудочной железе, легких и сердце экспериментальных животных.
На 14-е сутки структура миокарда существенных изменений по сравнению с 7-ми сутками не претерпела (рис.4,б). В легких микроскопическая картина также практически не изменилась: отмечалось выраженное полнокровие сосудов микроциркуляторного русла, межальвеолярные перегородки утолщены, умеренно инфильтрированы лимфоцитами, моноцитами и полиморфноядерными лейкоцитами (рис.4,а).
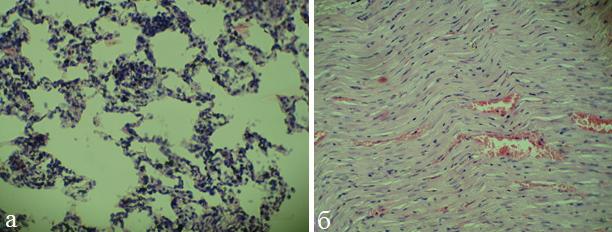
Рис. 4. Микрофото легких (а) и миокарда (б) крысы (ОДП, 14 сутки). Окраска гематоксилином и эозином, х 200.
Таблица 4. Содержание цитокинов у крыс в 14-е сутки эксперимента по моделированию ОДП

Обсуждение. Таким образом, нами выявлены закономерности вовлечения в патологический процесс органов-мишеней при ОДП в эксперименте и создание специфического цитокинового статуса.
Первым органом в цепи патоморфологических повреждений при ОДП были легкие (выраженные сосудистые изменения возникали уже через один час после операции). Этому способствовали анатомические особенности органа: большая площадь мелких, легко повреждающихся сосудов, обилие эндотелия, хорошее кровоснабжение, а также циркуляция в крови медиаторов воспаления.
Структурные изменения в миокарде (повреждение кардиомиоцитов в виде их пересокращений и значительный отеком интерстициальной ткани), могут быть связаны с циркуляцией медиаторов воспаления, а также действием на миокард специфического фактора депрессии миокарда, вырабатываемого поджелудочной железой при различных критических состояниях, а также при ОП. Таким образом, причиной структурных повреждений внутренних органов при ОП является чрезмерная воспалительная реакция системного характера, ведущая в итоге к развитию СПОН (множественной органной дисфункции).
Разрыв базальной мембраны эндотелия капилляров поджелудочной железы и интерстиция легких при развитии панкреатита способствует выходу факторов воспаления в кровь. Разрушение эндотелиального барьера приводит к активации тучных клеток и выбросу биогенных факторов воспаления. При этом уровень провоспалительных цитокинов остается достаточно высоким, что сопровождается развитием полиорганной дисфункции. Цитокины, ответственные за противовоспалительный ответ, в незначительном количестве создают слабую защитную реакцию организма экспериментальных животных.
Анализ полученных результатов показал четко выраженную провоспалительную направленность процесса при моделировании ОДП. Об этом свидетельствует статистически значимое повышение по сравнению с нормой уровня TNF-α, MCP-1 и GM CSF во все сроки наблюдения на фоне снижения IL-1α и уменьшение содержания IL-4 с достоверным увеличением лишь к 14 суткам. Данная динамика коррелирует с результатами морфологических исследований, распространенностью некроза и выраженностью апоптоза.
Изучение патогенеза острого деструктивного панкреатита с характеристикой цитокинового ответа позволяет описать течение заболевания и возможность быстрого ограничения развивающего воспаления и купирования массивного некроза с развитием полиорганной недостаточности.
