Последние два десятилетия ознаменовались повышенным интересом исследователей к роли сфинголипидных механизмов в регуляции клеточных функций на периферии: доказана роль сфинголипидов как сигнальных молекул апоптоза и выживания клеток, их пролиферации и дифференцировке, формировании инсулинорезистентности. Скелетные мышцы не являются исключением. Сфинголипиды участвуют в регуляции роста, дифференцировки и регенерации скелетных мышц, влияют на сопряжение процессов возбуждения и сокращения, утомляемость, чувствительность к инсулину, оказывают трофические эффекты. Одними из ключевых эффекторов сфингомиелиназного сигнального пути являются церамиды.
Резистентность мышечной ткани к инсулину снижает активность аэробного метаболизма и эффективность физических упражнений за счет препятствия усвоения глюкозы скелетными мышцами. В развитии периферической инсулинорезистентности важная роль принадлежит метаболимам сфингомиелина. Доказано, что накопление церамидов в мышечной ткани приводит к инсулинорезистентности и, как следствие, снижению аэробного метаболизма вплоть до атрофии скелетных мышц.
Целью нашего исследования являлось изучение влияния тяжелого эмоционального и метаболического стресса на содержание церамидов в скелетной мышце в разрезе индивидуальной стрессоустойчивости.
Материалы и методы. Хронические опыты проведены на белых половозрелых крысах самцах, предварительно разделенных на устойчивых и неустойчивых к стрессу методом "открытого поля" (далее СУ и СН). Моделировались два типа стресса: хронический эмоциональный (иммобилизационный: с ежедневной двухчасовой фиксацией животных на доске в положении на спине - далее ХИС) и метаболический (после однократного внутрибрюшинного введения раствора аллоксана гидрохлорида развивался сахарный диабет, который контролировали по клиническим и лабораторным показателям - далее АСД). Части крыс внутримышечно вводился даларгин в качестве прямого агониста опиатных рецепторов - стресс-коррегирующего фактора. Опыты проводили на интактных крысах (контроль), на 10, 20, 30 и 45 дни эксперимента. После выведения животных из эксперимента забирали для исследования ткани скелетных мышц из передней группы голени. Экстракцию общей фракции липидов из ткани проводили по методу Фолча. Липиды разделялись на классы методом тонкослойной хроматографии. Проявляли пластины окрашиванием раствором фосфорномолибденовой кислоты в этаноле. Расчет параметров и количественная оценка хроматограмм проводилась помощью программы «Sorbfil TLC Videodensitometer». Количество церамидов в пластинах определяли с использованием внешнего стандарта (Ceramide from bovine brain, Sigma) посредством компьютерной обработки. Различия определяли при помощи критерия Манна-Уитни, считали достоверными при p≤0,05. Для исключения ежедневного «инъекционного» стресса контрольной группе животных (АСД/ХИС+даларгин) внутрибрюшинно вводили физиологический раствор натрия хлорида в эквивалентных раствору даларгина объемах. Различия в степени прироста оценивали после стандартизации показателей относительно контрольных значений.
Результаты. В мышечной ткани интактных животных содержание церамидов было достоверно (p<0,05) выше в группе устойчивых к стрессу особей. На всех сроках, во всех экспериментальных моделях и во всех группах животных уровень церамидов скелетной мышцы был достоверно выше контрольных значений (табл. 1).
Таблица 1. Содержание церамидов в скелетной мышце крыс с разной стрессрезистентностью (мг на 1 г. ткани)
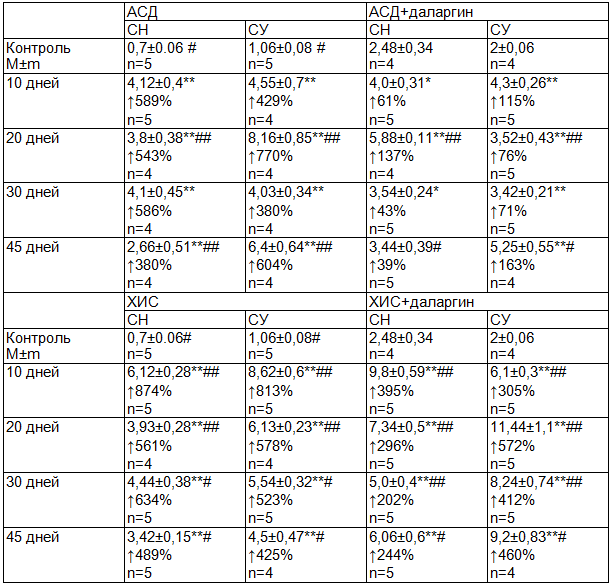
Примечание: СН - стресс-неустойчивые животные, СУ - стресс-устойчивые животные, контроль - интактные животные, 10, 20, 30, 45 дней - соответствующие дни эксперимента, M - среднее арифметическое, m - стандартная ошибка средней арифметической, n - число животных в группе, статистически значимые различия: * - с контролем, # - между СУ и СН (абсолютные значения), 1 знак - р≤0,05, 2 знака р≤0,01, ↑ - прирост содержания ЦЕР % относительно контроля.
При метаболическом стрессе на 20 и 45 дни после введения аллоксана прирост содержания церамидов был более выражен у СУ, на 30 день - у СН животных. Различия между СУ и СН в отношении абсолютного содержания церамидов оказались достоверными только на 20 и 45 дни опытов. Различия в отношении степени прироста относительно контроля оказались достоверными и на 30 день, когда уровень исследуемого вещества у устойчивых животных был выше, чем у неустойчивых.
При ХИС максимальный прирост уровня церамидов наблюдался на ранних сроках стрессирования, различия между устойчивыми и неустойчивыми животными, оказались достоверными на всех сроках исследования. Максимальный прирост (в 8,7 раз относительно контрольных значений) наблюдался на 10 день иммобилизации у неустойчивых животных.
Наши исследования показали сходную динамику изменений уровня церамидов при ХИС и АСД. В обеих экспериментальных моделях наблюдались различия между устойчивыми и неустойчивыми животными, что свидетельствует о важности индивидуально-типологических факторов на стресс-индуцированные изменения метаболизма.
Введение в эксперимент даларгина, как стресс-лимитирующего фактора вызывало частичное восстановление относительного уровня церамидов в обеих экспериментальных моделях у всех животных за исключением стресс-устойчивых при эмоциональном стрессе. В качестве примера на рисунке показано влияние даларгина на восстановление уровня церамидов у стресс-устойчивых животных при аллоксановом сахарном диабете.
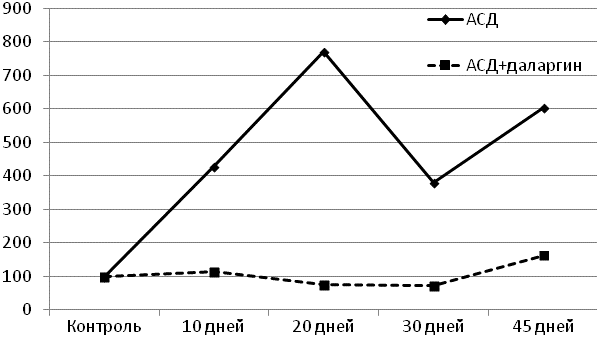
Рис. 1. Влияние даларгина на прирост ЦЕР в мышце СУ крыс при АСД: * статистически значимые различия между показателями прироста ЦЕР с коррекцией ДАЛ и соответствующими показателями без коррекции, 2 знака (**) - р≤0,01.
У неустойчивых к стрессу животных при аллоксановом сахарном диабете получена сильная положительная корреляция между уровнем церамида мышцы и глюкозы крови (коэффициент корреляции Спирмена 0,818 при критическом значении r=0,64 для p<0,05). Приведение ковариации к коэффициенту корреляции Пирсона и коэффициенту детерминации (r2) показало сильную корреляцию и среднюю детерминацию гликозилированного гемоглобина и церамидов мышцы (r=0,73; r2=0,53), что косвенно указывает на развитие мышечной инсулинорезистентности.
Обсуждение. В мышечной ткани крыс в нашем исследовании выявлялось повышение содержания церамидов в обеих экспериментальных моделях на всех сроках. Полученные нами данные соотносимы с имеющимися в литературе сведениями. В частности, ранее было показано увеличение уровня церамидов в мышечной ткани при стрептозотациновом сахарном диабете до 250% [6].
В нашем исследовании (аллоксановая модель сахарного диабета 1 типа) максимальный прирост уровня церамидов составил 680%. В условиях введения дексаметазона исследователями выявлялось увеличение уровня церамида в мышце (до 194%) [6], что так же соотносимо с результатами, полученными в настоящем исследовании при иммобилизации животных (прирост уровня церамидов в мышце до 874%).
Выбранная модель метаболического стресса представляет собой сахарный диабет первого типа, развивающегося за счет гибели бета-клеток островков Лангерганса поджелудочной железы под действием аллоксана [1]. Известно, что данный тип диабета сопровождается развитием вторичной инсулинорезистентности. Механизм этого явления до настоящего времени не является полностью изученным.
Поскольку, при АСД мы наблюдали увеличение содержания церамида в инсулинзависимых тканях, что по данным литературы коррелирует с развитием инсулинорезистентности, результаты нашего исследования позволяют предположить зависимость вторичной мышечной инсулинорезастентности при сахарном диабете 1 типа от уровня церамида.
Периферическое действие церамидов может рассматриваться как с позиции повреждения в мышечной ткани (развитие резистентности к инсулину с апоптозом миоцитов, атрофией мышечной ткани), так и с позиции протекции - развитие инсулинорезистентности с целью накопления глюкозы как основного энергетического субстрата для инсулиннезависимой ткани мозга - централизация энергетического субстрата.
Повышение уровня церамидов в тканях при АСД является неспецифичным и отражает включение церамид-опосредованных механизмов в деятельность стресс-системы, что доказывается однообразной динамикой изменений при стрессе и диабете, значением устойчивости животных к стрессу, корригирующим влиянием активации стресс-лимитирующей опиоидной системы.
Поскольку повышение уровня церамидов в тканях неспецифично и связано с активацией стресс-системы, для церамид-опосредованных процессов большое значение имеют индивидуально-типологические особенности организма, что наглядно показано в нашем исследовании.
Введение в эксперимент коррекции даларгином помимо частичного восстановления уровня церамидов в мышце и «сглаживания» колебаний уровня исследуемого вещества на различных сроках, приводило к более значимым различиям между устойчивыми и неустойчивыми к стрессу животными. Фармакологическая активация стресс-лимитирующих систем (на примере опиоидной) позволяет уменьшить риск повреждающего действия церамидов в тканях.
Показано, что длительная иммобилизация приводит к мышечной слабости и атрофии скелетных мышц и сопровождается развитием инсулинорезистентности за счет угнетения инсулинзависимого транспорта глюкозы [7]. В индукции апоптоза миоцитов ключевое участие принимает церамид [8]. Имеются данные о роли церамида в непосредственной блокаде инсулин-сигналинга в скелетной мышце [3].
По данным исследований A. Dobrzyn, J Gorski [4] длительные физические тренировки крыс приводят к снижению активности сфингомиелиназ и общего содержания церамидов в красных мышцах конечностей. Те же авторы в 2004 году указывают, что данные процессы сопровождаются увеличением поглощения глюкозы мышцами [5].
В 2011 году исследователи под руководством M. Baranowski отмечали, что регулярные тренировки приводят к снижению содержания церамидов и других метаболитов сфингомиелина в плазме крови, что благоприятно сказывается на усвоении глюкозы инсулинзависимыми тканями, в частности, миокардом [2].
Выводы:
- Как метаболический, так и эмоциональный стресс сопровождаются накомплением церамидов в мышечной ткани.
- Стресс-индуцированное накопление церамидов в скелетных мышцах по данным литературы приводит к развитию инсулинорезистентности и апоптозу миоцитов.
- Выраженность стресс-индуцированного накопления церамидов в мыщцах зависит от индивидуально-типологических особенностей организма
- Возможна фармакологическая коррекция накопления церамидов в мышцах при стрессе за счет активации центральных стресс-лимитирующих систем.
