Развитие общества на современном этапе сопровождается увеличением продолжительности жизни населения. Увеличивающееся число лиц пожилого и старческого возраста ставит приоритетной задачей проблему профилактики возрастной патологии и состояния здоровья пожилого населения. Только в России доля лиц в возрасте 60 лет и старше за период 1970-2012 гг. увеличилась с 12% до 18,6%, а доля лиц в возрасте 75 лет и старше - с 2,5% до 4,1% населения страны.
Постарению населения сопутствует возрастание удельного веса различных соматических заболеваний. Хроническая обструктивная болезнь легких (ХОБЛ) и ишемическая болезнь сердца (ИБС) являются ведущими причинами заболеваемости и смертности в мире и обладают высокой коморбидностью [5, 6, 16]. Сердечно-сосудистые заболевания (ССЗ) обнаруживаются не менее чем у 50% пациентов ХОБЛ [1, 7]. В развитии ССЗ и ХОБЛ имеет место общность этиопатогенетических факторов, главную роль среди которых занимают дисфункция артериального эндотелия, воспаление, гипоксемия. В некоторых исследованиях указывается, что сердечно - сосудистые заболевания при ХОБЛ встречаются в 2 раза чаще, чем без бронхолегочной патологии [2].
Проспективные исследования доказали связь агрегации тромбоцитов с прогнозом течения сочетанной патологии и увеличением летальности при ССЗ. [18]. Известно, что повышение агрегационной активности тромбоцитов приводит к образованию клеточных агрегатов, нарушению микроциркуляции и увеличению риска развития тромбозов [12].
Взаимное отягощение ХОБЛ и ИБС основывается на объединении некоторых патологических звеньев: эндотелиальная дисфункция, роли нарушений тромбоцитарного гемостаза изменение реологических свойств крови по типу синдрома гипервязкости, развитие вентиляционной, гемодинамической, а затем и тканевой гипоксии [4].
Эндотелий представляет собой монослой пограничных клеток между кровью и мышечным слоем сосудов. Эндотелиальные клетки сосудов выполняют функции транспортного барьера, регуляции многих биологически активных субстанций. Эндотелиоциты продуцируют мощные вазодилатирующие (простациклин, эндотелий гиперполяризующий фактор, эндотелий расслабляющий фактор (ЭРФ)) и вазоконстрикторные (тромбоксан, эндотелин-1, простагландин Н2, эндоперекиси) субстанции.
Биологически активные веществ, выделяемые эндотелием, определяют состояние сердечной, сосудистой деятельности, реологические свойства крови. Потеря этих свойств при развитии эндотелиальной дисфункции является патогенетической основой развития и прогрессирования, как ИБС, так и легочной патологии [3, 14].
Доказана роль участия дисфункции эндотелия в атерогенезе, ишемии миокарда, возникновении атеротромбоза. Выброс вазоконстрикторов эндотелием в просвет сосуда способствует также активации тромбоцитов, что приводит к их дегрануляции и вовлекает в процессы тромбообразования все большее количество клеток, и в частности, самих тромбоцитов. При коморбидности повышенная способность тромбоцитов к агрегатообразованию может усугублять реологические свойства крови и ухудшать перфузию газов в легких, что закономерно приводит к более быстрому прогрессированию обоих заболеваний [8].
Доказано, что повреждение эндотелия с развитием эндотелиальной дисфункции является одним из системных проявлений ХОБЛ [9, 11, 17]. Эндотелин-1 (ЭТ-1) вырабатывается путем растяжения сосудистой стенки, норадреналином, тромбином, тяжелой гипоксией тканей. Описанные изменения, наряду с замедлением кровотока с возрастом, повышают вероятность внутрисосудистого тромбоза, формированию атеросклеротических бляшек.
Ухудшение функции легких является также сильным триггером сердечно-сосудистой летальности, как и основные кардиоваскулярные факторы риска.
Повышение вязкости крови на фоне старения создает условия для усиления способности клеток образовывать агрегаты, что усугубляет риск тромботических осложнений [17]. Нарастает эндотелиальная дисфункция сначала на микроциркуляторном уровне, затем в крупных артериальных сосудах. Возрастное снижение эндотелиальной функции в значительной степени влияет на изменения внутрисосудистого гемостаза, повышая тромбогенный потенциал крови.
Эти изменения, наряду с возрастным замедлением кровотока, предрасполагают к развитию внутрисосудистого тромбоза, формированию атеросклеротической бляшки.
Следовательно, комплексная оценка изменений агрегационной способности тромбоцитов, функции эндотелия у больных с ССЗ и ХОБЛ является важным звеном в диагностике и прогнозировании течения патологии у лиц различных возрастных групп.
С учетом большой распространенности полиморбидности у лиц старших возрастных групп, небольшого количества исследований, посвященных частоте сочетания ХОБЛ и ИБС в старческом возрасте, большой интерес вызывает изучение влияния ХОБЛ на течение ИБС.
Цель исследования: определить роль эндотелиальной дисфункции в развитии и прогрессировании у пациентов старческого возраста ХОБЛ и ИБС.
Материалы и методы. Нами обследованы 88 человек в возрасте от 75 до 89 лет, проходивших обследование и лечение в Самарском областном клиническом госпитале для ветеранов войн.
Больные были разделены на четыре группы: первую группу составили 27 пациента старческого возраста больных с ИБС, стенокардией напряжения стабильной II функционального класса, хроническая сердечная недостаточность (ХСН) II функционального класса (средний возраст - 83,05±0,73 лет); во вторую группу включено 23 больных с ИБС, стенокардией напряжения стабильной II функционального класса, ХСН II функционального класса и ХОБЛ 2 степени тяжести (средний возраст - 84,27±0,86 лет); в третью группу вошло 17 пациентов с ИБС, стенокардией напряжения стабильной II функционального класса и ХОБЛ 3 степени тяжести (средний возраст - 85,33±0,73 лет). Четвертую группу составили 21 человек без клинических и инструментальных проявлений сердечно-сосудистой патологии (средний возраст 83,24±0,73 лет).
Согласно классификации, принятой Европейским региональным бюро Всемирной Организации Здравоохранения (ВОЗ) (Киев, 1963), группу старческого возраста составили лица в возрасте от 75 до 89 лет.
В исследование были включены пациенты, соответствующие критериям включения и исключения и подписавшие информированное добровольное согласие пациента, одобренное этическим комитетом Самарского государственного медицинского университета.
Дезагрегантная терапия была отменена за 7 дней до исследования.
Критерии исключения: сахарный диабет, онкологические заболевания на момент поступления и/или в анамнезе до 5 лет, тяжелая сопутствующая патология с органной недостаточностью более 2 степени (хроническая почечная недостаточность, печеночная недостаточность), анемия любого генеза с уровнем гемоглобина менее 100 г/л, тиреотоксикоз или гипотиреоз в стадии декомпенсации, острые нарушения мозгового кровообращения в сроки до 1 года.
Исследование функции внешнего дыхания (ФВД) проводили на спирографе Spirolab II (Medical International Research) с автоматизированной обработкой параметров. Исследовали такие показатели, как: жизненную емкость легких (ЖЕЛ) (VC), форсированную жизненную емкость легких (ФЖЕЛ) (FVC), объем форсированного выдоха за 1 с (ОФВ1) (FEV1) c расчетом индекса Тиффно (FEV1/FVC), пиковую скорость выдоха (ПСВ) (PEF).
Исследование сосудистого звена гемостаза проводили путем определения уровня ЭТ-1 иммуноферментным анализом с помощью тест-системы Biomedica Endotelin (1-21) (ЗАО «БиоХимМак») на автоанализаторе Architect i1000SR (Abbot Laboratories S.A., Норвегия).
Тромбоцитарное звено гемостаза исследовали путем определения агрегации тромбоцитов на лазерном агрегометре (BIOLA Ltd., модель 230 LA). Определяли спонтанную агрегацию (СА), агрегацию тромбоцитов в ответ на действие индукторов (аденозиндифосфат (АДФ), ристомицин). Определяли максимальное значение агрегационной способности тромбоцитов по кривой среднего размера (КСР) агрегатов, максимальный угол наклона по кривой среднего размера агрегатов (СРА).
Статистическую обработку результатов исследования проводили с помощью пакета прикладных программ Statistica 6,0. Для оценки достоверности различий между группами использовали критерий Стьюдента. Результаты исследования со значением вероятности ошибки р<0,05 расценивались как статистически значимые.
Результаты и их обсуждение. Результаты исследования представлены в табл. 1.
Таблица 1. Показатели сосудисто-тромбоцитарного гемостаза
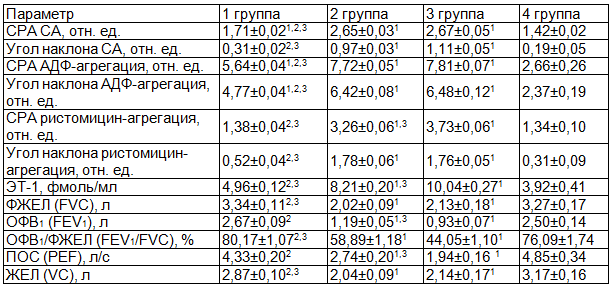
Примечания: достоверность различий р<0,05: 1 - в сравнении с 4 группой, 2 - в сравнении со 2 группой, 3 - в сравнении с 3 группой.
При определении спонтанной агрегации тромбоцитов по кривой среднего размера агрегатов наблюдается достоверное отличие агрегационной активности тромбоцитов у пациентов с сердечно-сосудистой патологией от группы контроля (р<0,05). Во 2 и 3 группах еще больше усиливается спонтанная агрегация по КСР.
Данная тенденция, однако, не прослеживается при определении максимального угла наклона КСР агрегатов, характеризующего скорость и интенсивность агрегации. Отмечается усиление спонтанной агрегации во 2 и 3 группах в сравнении с 1 группой (р<0,05). В каждой группе происходит увеличение агрегационной способности тромбоцитов по максимальному значению КСР агрегатов и по максимальному углу наклона КСР агрегатов по сравнению с пациентами предыдущей группы.
При анализе АДФ-индуцированной агрегации по максимальному значению КСР агрегатов наиболее выраженные изменения наблюдаются у пациентов 3 группы - возрастание агрегации отмечается в 2,5 раза по сравнению с группой контроля. Статистически значимые изменения прослеживаются и с группой больных ИБС (р<0,05).
Исследование по максимальному углу наклона КСР агрегатов при индуцировании агрегации АДФ выявляет наибольшее повышение параметра у пациентов с ИБС и ХОБЛ 3 степени (р>0,05). Полученные данные имеют важное клиническое значение, так как АДФ является одним из наиболее сильных индукторов агрегации и выделяется из секреторных гранул тромбоцитов на стадии начальной активации под воздействием коллагена и тромбина [10].
Под влиянием АДФ в цитоплазме клеток увеличивается содержание кальция, изменяется форма тромбоцита. Следствием данных процессов является повышенная готовность кровяных пластинок к адгезии и агрегации [13]. На фоне дисфункции эндотелия, в местах повреждений, создаются высокие концентрации данного индуктора, стимулирующие соседние неактивные элементы крови с образованием феномена «снежного кома». Подобная ситуация может приводить к увеличению риска тромбообразования [1].
Если в качестве лиганда был использован ристомицин, то по среднему размеру агрегация кровяных пластинок протекала более интенсивно во 2 и 3 группах в сравнении с 4 группой (p<0,05). И с достоверной разницей в группе с ИБС и ХОБЛ III степени по сравнению с группой ИБС и ХОБЛ II степени, а по светопропусканию - при нестабильной стенокардии (p<0,05).
У пациентов с сочетанным течением ИБС и ХОБЛ выявлено увеличение уровня ЭТ-1 по сравнению со 2 группой и группой контроля. Увеличение содержания эндотелина в крови подтверждает факт наличия эндотелиальной дисфункции у больных (нарушена выработка эндотелием сосудов вазоактивных веществ).
Полученные результаты не противоречат данным научных исследований [15, 17].
Выводы. Наибольший вклад в нарушение сосудисто-тромбоцитарного звена гемостаза вносит наличие сочетания ишемической болезни сердца и хронической обструктивной болезни легких, осложняющее физиологическое старение и приводящее к значительным сдвигам в гомеостатическом балансе.
Это обусловлено несовершенством приспособительных адаптационных механизмов на фоне кардиореспираторной патологии, которая значительным образом формируются у лиц старческого возраста.
Таким образом, у лиц с ИБС, сочетанной с ХОБЛ, наблюдаются более выраженные изменения со стороны сосудисто-тромбоцитарного звена гемостаза, что коррелирует с показателями функции внешнего дыхания.
Характерно увеличение тромбогенного потенциала крови, который связан с повышением функциональных способностей тромбоцитов и увеличением уровня эндотелина-1 в плазме крови. По мере прогрессирования атеросклеротического процесса, обострения заболеваний перечисленные сдвиги могут становиться причиной развития тромботических осложнений.
