Несмотря на небольшой удельный вес гломерулонефрита (ГН) в структуре нефропатий у детей, данная патология остается одной из актуальных, поскольку может иметь достаточно тяжелое течение и серьезные осложнения в остром периоде [1,3]. Среди приобретенных заболеваний почек, ГН является вторым по распространенности после инфекции мочевыводящих путей [3,6].
В настоящее время многие гломерулопатии, манифестирующие в детском возрасте, отличаются увеличением частоты латентных и хронических форм заболевания, затяжным характером течения, протекающих с более ранним снижением почечных функций, сравнительно низкой эффективностью терапевтических мероприятий, оказываются причиной инвалидизации подростков и взрослых в связи с развитием хронической почечной недостаточности (ХПН) [3-5].
Кроме того, в последние десятилетия отмечается увеличение встречаемости нефропатий в детской популяции: по эпидемиологическим данным в России в 70-80 годы их частота составила 29 больных на 1000 детского населения, в 90-е годы возросла до 60:1000 детей [5-7].
Одними из наиболее значимых в педиатрической практике являются постинфекционные поражения почечной ткани иммунной природы. Особое место среди них занимает острый гломерулонефрит (ОГН), концепция этиологии и патогенеза которого в последнее десятилетие претерпела значительные изменения, требующие дальнейшего их изучения [7,11].
У большинства детей ОГН имеет благоприятное течение с исходом в выздоровление. Однако у части больных добиться клинико-лабораторной ремиссии не удается, заболевание трансформируется в хроническую форму. В последние годы течение ГН значительно изменилось: стали редкими классические формы с полным симптомокомплексом, включающим нефритические отеки, артериальную гипертензию, гематурию. В клинической практике все чаще встречается атипичное течение заболевания. Такие варианты ГН вызывают наибольшие трудности в ранней диагностике и лечении, в связи, с чем терапия оказывается запоздалой и нередко безуспешной, возрастает риск перехода ОГН в хронический гломерулонефрит (ХГН). При этом, роль отдельных факторов неблагоприятного течения гломерулонефрита у детей, а также возможности прогнозирования исхода заболевания остаются невыясненными [1,4,8].
Исходя из вышеизложенного, целью настоящего исследования явилась сравнительная оценка клинико-лабораторных особенностей острого и дебюта хронического гломерулонефрита для выяснения возможных факторов риска формирования хронических гломерулопатий в детском возрасте.
Материалы и методы исследования. В исследование было включено 139 детей с впервые выявленными проявлениями гломерулопатий в возрасте 7-16 лет (75 мальчиков и 64 девочки), находившихся на лечении в нефрологическом отделении Областной детской клинической больницы г. Курска с 1999 по 2010 г.
По результатам исследования пациенты были разделены на две группы. В первую группу вошли 103 (74,1%) ребенка, с установленным диагнозом ОГН, разрешившимся выздоровлением, во вторую группу - 36 (25,9%) пациентов, у которых в последующем сформировался хронический гломерулонефрит.
Контрольную группу составили 70 здоровых детей, сопоставимых по полу и возрасту. При наличии сопутствующих хромосомных аномалий, острых инфекционных процессов, системных заболеваний пациенты исключались из исследования. Здоровыми считали детей без каких-либо признаков патологии внутренних органов, не имеющих хронических очагов инфекции, не болевших вирусными или острыми бактериальными инфекциями в течение последнего месяца, с нормальными анализами крови и мочи.
Родители пациентов дали информированное согласие на включение в исследование. Разрешение этического комитета на проведение исследования получено.
Все дети с ГН были госпитализированы в первые 4-10 дней от момента начала заболевания. Средний срок лечения в стационаре составил 24,5±1,2 дней. Оценку клинического статуса и лабораторных параметров проводили при включении пациентов в исследование и в динамике каждые три месяца в течение года наблюдения, а затем ежегодно в течение пяти лет.
Пациентам проводилось комплексное общеклиническое обследование (оценка соматического статуса, общие анализы мочи и крови, проба Нечипоренко и Зимницкого, суточная протеинурия). При этом, гематурию дифференцировали по степени выраженности: минимальная - содержание эритроцитов не превышало 10х106/л, при умеренной - количество эритроцитов составляло от 10х106/л до 60х106/л, и при выраженной - более 60х106/л. Протеинурию также различали по степени выраженности: минимальная - суточные потери белка до 1,0 г, умеренная от 1,0 г до 3,0 г и выраженная - более 3,0 г [9].
При изучении биохимического анализа крови исследовали уровень общего белка, холестерина, мочевины, креатинина, С-реактивного белка (СРБ), сиаловых кислот, фибриногена, серомукоида, соотношение белковых фракций в сыворотке крови [9].
Функциональное состояние почек оценивали по содержанию мочевины и креатинина крови, клиренсу эндогенного креатинина, клубочковой фильтрации и реабсорбции в пробе Реберга, концентрационной способности почек.
Для оценки морфологических изменений всем детям проводили ультразвуковое исследование органов мочевыделительной системы.
Критериями постановки диагноза служили: отсутствие указания на предшествующее поражение почек, связь со стрептококковой инфекцией, повышение уровня антистрептолизина-О (АСЛ-О), наличие нефритического синдрома, высокая относительная плотность мочи даже при уменьшении клубочковой фильтрации, отсутствие или регрессирующий характер гипертонической ангиопатии.
Статистическую обработку результатов исследования проводили путем вычисления средней арифметической (М) и среднего квадратичного отклонения (σ) с помощью программных комплексов «STATISTICA 6.0». Достоверность различий сравниваемых показателей определяли с помощью t критерия Стьюдента [2,10].
Полученные результаты и их обсуждение. Для выявления факторов, влияющих на хронизацию острого гломерулонефрита, ретроспективно пациенты были разделены на две группы. В первую группу вошли 103 (74,1%) ребенка без признаков хронизации гломерулонефрита, во вторую группу было включено 36 (25,9%) детей, у которых отмечалась хронизация гломерулонефрита в течение срока наблюдения.
В сравниваемых группах были изучены сроки дебюта заболевания. При этом средний возраст пациентов составил 11,56±0,07 лет. У 78 (75,7%) детей первой группы ГН развился в возрасте 7-11 (9,1±0,19) лет, в то время как, у 30 (83,3%) пациентов второй группы заболевание начиналось в 8-12 (12,2±0,56) лет. Половая структура обеих групп оказалась одинаковой.
Заболевания, которые непосредственно предшествовали началу ГН и поэтому рассматривались в качестве этиологического фактора, представлены в табл. 1.
Таблица 1. Заболевания, непосредственно предшествовавшие дебюту гломерулонефрита
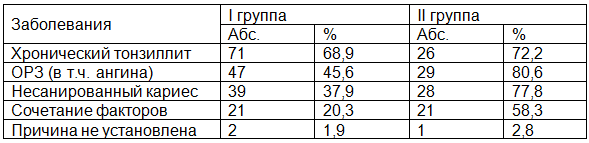
По нашим данным, возникновению острого и хронического гломерулонефрита чаще всего предшествовал хронический тонзиллит: у пациентов без проявлений хронизации заболевания выявлялся в 68,9% случаев, у детей с признаками хронизации ГН в 72,2% наблюдений. В сравниваемых группах перенесенные острые респираторные заболевания (особенно ангины) встречались в 1,8 раза чаще во второй группе, чем в первой (80,6% и 45,6% соответственно). При сравнительном анализе в роли хронического очага инфекции во второй группе в 2,1 раза чаще выявлялся множественный кариес. Сочетание нескольких хронических очагов инфекции в 2,9 раза чаще встречались у детей с признаками хронизации ГН. У 3 (2,2%) пациентов предшествующий фактор уточнить не удалось.
При анализе анамнестических данных (табл. 2) выяснилось, что отягощенная по почечной патологии наследственность в 2 раза чаще встречалась у пациентов с последующей хронизацией ГН, чем у детей, вышедших в ремиссию (30,5% и 15,5% соответственно).
Таблица 2. Анамнестические факторы риска хронизации гломерулонефрита у детей
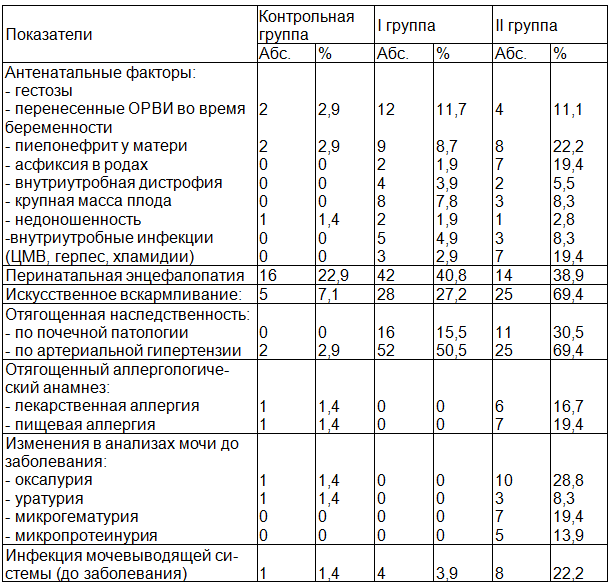
Также у пациентов второй группы обращала на себя внимание более высокая частота артериальной гипертензии (АГ) у родителей - 69,4%, по сравнению с 50,5% наблюдений в первой группе.
Неблагоприятное течение беременности и родов имело место у 97,0% детей второй группы, в то время как в первой группе оно регистрировалось только у 43,7% пациентов.
69,4% детей с последующей хронизацией, находились на искусственном вскармливании, в группе детей, вышедших в ремиссию - лишь в 27,2% наблюдений.
В течение последнего месяца до развития ГН у 25 (69,4%) детей второй группы наблюдались непостоянные изменения в анализах мочи в виде оксалурии (28,8%), микрогематурии (19,4%), микропротеинурии (13,9%), уратурии (8,3%). 8 (22,2%) пациентов в группе с последующей хронизацией ГН до заболевания наблюдались по поводу «инфекции мочевыводящих путей», в то время как аналогичный диагноз в первой группе был выявлен только у 4 (3,9%) детей.
У 13 (36,1%) пациентов второй группы выявлен отягощенный аллергологический анамнез: у 6 (16,7%) отмечалась лекарственная аллергия, у 7 (19,4%), она сочеталась с пищевой аллергией.
Анализ клинических проявлений дебюта заболевания (табл. 3) показал, что у 96,1% больных первой группы ГН протекал типично, с острым развитием нефритического синдрома (ОНС). «Светлый» промежуток между появлением первых симптомов заболевания и перенесенной накануне инфекцией составил от 7 до 28 дней. Критериями ОНС являлось острое начало заболевания с развитием отечного синдрома, наличие артериальной гипертензии и изменений в анализах мочи (протеинурии, микро- или макрогематурии). В тоже время у большинства пациентов второй группы (91,6%) клиническая картина была малосимптомной, в основном, представлена изолированным мочевым синдромом.
Выраженность отечного синдрома в сравниваемых группах также была различной: от пастозности лица и стоп до выраженных периферических отеков. В группе детей с последующим выздоровлением отеки выявлялись у 42,7% больных; пастозность век, верхних и нижних конечностей отмечалась у 55,3% детей. В то время как у пациентов второй группы периферические отеки отсутствовали, только у 5 (13,9%) из 36 детей регистрировалась пастозность мягких тканей в области нижних конечностей и параорбитальной клетчатки. Периферические отеки сохранялись в течение 12,0±1,44 дней и исчезали в результате лечения у всех больных.
Артериальная гипертензия была выявлена у 81 (78,6%) пациента первой группы: у 37 (35,9%) из них систолическое артериальное давление (САД) было установлено до 125-130мм.рт.ст., диастолическое артериальное давление (ДАД) - до 85-95мм.рт.ст., у 44 (42,7%) детей показатели АД достигали 140-150/100 мм.рт.ст. Необходимо отметить, что у всех пациентов, повышение АД было зафиксировано впервые в жизни и нормализовалось по мере регрессии явлений ОНС на фоне лечения. Во второй группе было отмечено незначительное повышение АД лишь у 2 детей, что составило 5,6%.
Таблица 3. Клинические особенности манифестации острого и хронического гломерулонефрита у детей
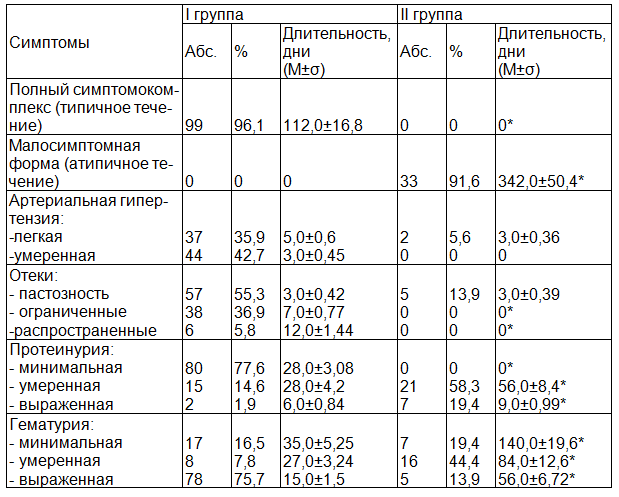
Примечание: здесь и далее указаны средние арифметические показатели (М) и среднее квадратичное отклонение (σ); * - достоверность различий средних величин р<0,05.
Анализ особенностей мочевого синдрома показал, что мочевой осадок в обеих группах был представлен умеренно выраженной протеинурией (не более 2 г в сутки), макро- или микрогематурией. В первой группе детей макрогематурия имела место у 78 (75,7%) детей, умеренная гематурия выявлена в 7,8% случаев, микрогематурия была отмечена у 16,5% пациентов. Минимальная протеинурия в начале заболевания зафиксирована у 77,6% пациентов, умеренная - в 14,6% наблюдений, выраженная - у 1,9% детей. В то время как, у пациентов с последующей хронизацией ГН, гематурия была выявлена в 77,7% наблюдений, в основном представлена умеренными изменениями у 44,4% детей. Протеинурия отмечалась у 28 пациентов, из них у 19,4% - выраженная, у 58,3% - умеренная. Протеинурия у наших пациентов не приводила к гипоальбуминемии.
Таблица 4. Лабораторная характеристика дебюта острого и хронического гломерулонефрита
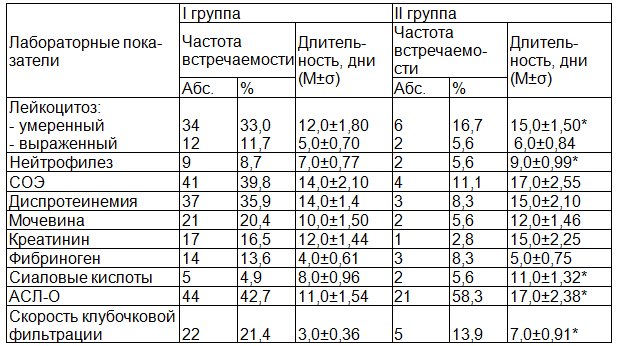
Признаки активности воспалительного процесса (табл. 4) оказались более выраженными у детей без признаков хронизации ГН и регистрировались в 2,4 раза чаще, чем у пациентов с последующей хронизацией. В частности лейкоцитоз в 2 раза чаще выявлялся у детей с клиническим выздоровлением. У 34 (33,0%) детей первой группы повышение уровня лейкоцитов было умеренным (до 10,5 - 14,2 х 109/л), у 12 (11,7%) пациентов - более выраженным (>14,2 х 109/л). В группе с последующей хронизацией умеренный лейкоцитоз наблюдался у 6 (16,7%) детей, лишь у 2 (5,6%) пациентов отмечались более высокие показатели. Длительность умеренного лейкоцитоза оказалась достоверно выше в 1,3 раза у детей с хронизацией процесса, чем у пациентов с клиническим выздоровлением, что составило 15,0±1,50 дней, против 12,0±1,80 дней, р<0,001.
Нейтрофилез выявлялся в 1,5 раза чаще у детей первой группы, чем у пациентов второй группы (8,7% и 5,6% соответственно). Повышение уровня АСЛ-О до 1:625 – 1:1250 регистрировалось в 1,4 раза чаще у детей с последующей хронизацией, чем у пациентов с клиническим выздоровлением (p<0,05).
В протеинограмме диспротеинемия по типу острого воспаления встречалась в 4,3 раза чаще у детей первой группы, главным образом, в виде незначительного снижения альбуминов (до 52-48%) и повышения β2 - глобулинов (до 15-20%). У 21 (20,4%) ребенка с последующим выздоровлением регистрировалось транзиторное (в течение 1-2 недель) повышение в крови уровня мочевины - до 9-15 ммоль/л, в то время как, у детей с хронизацией ГН - лишь у 2 (5,6%). Повышение креатинина в первой группе регистрировалось в 5,9 раза чаще. Достоверно оказались длительно сохраняющиеся повышенные показатели креатинина (15,0±2,25 дней, против 12,0±1,44 дней), сиаловых кислот (11,0±1,32 дней, против 8,0±0,96 дней), АСЛ-О (17,0±2,38 дней, против 11,0±1,54 дней), чем в группе с клиническим выздоровлением, (р<0,001). Средние значения СОЭ и фибриногена не имели достоверного отличия в сравниваемых группах.
Снижение клубочковой фильтрации наблюдалось у 22 (21,4%) пациентов первой группы и у 5 (13,9%) детей второй группы. У 112 (80,6%) пациентов, включенных в исследование, скорость клубочковой фильтрации была на нижней границе нормы.
При проведении УЗИ почек отклонений от возрастной нормы в первой группе детей не выявлено, в то время как у 21 (58,3%) ребенка второй группы обнаружены изменения в положении почек (нефроптоз), малые и большие аномалии развития мочевыделительной системы (синдром Фрейли, полное и неполное удвоение почек, подковообразная почка, кисты, агенезия почки).
Лечение больных обеих групп в дебюте ГН осуществлялось с учетом существующих рекомендаций и включало базисную терапию (режим, диету, антибиотики), патогенетическую (антикоагулянты, дезагреганты) и симптоматические (мочегонные, гипотензивные) средства.
Оценку результатов лечения проводили перед выпиской из клиники (к 4-6-ой неделе от момента госпитализации), в последующем у 139 детей через 1 год, отдаленный исход заболевания у 36 детей был изучен через 5 лет от дебюта ГН путем определения функционального состояния почек, степени выраженности протеинурии и эритроцитурии.
Непосредственная эффективность лечения оценивалась как:
- хорошая - отсутствие протеинурии при нормальной или минимальной эритроцитурии;
- удовлетворительная - отсутствие протеинурии при умеренной эритроцитурии или минимальная протеинурия при нормальной, минимальной, умеренной эритроцитурии;
- низкая - минимальная протеинурия при выраженной эритроцитурии или наличие умеренной протеинурии.
Верификация эффективности комплексной терапии спустя 12-14 месяцев после окончания лечебных мероприятий показала, что нормализация анализов мочи зарегистрирована у 103 (74,1%) пациентов. Из них у 81 (78,6%) ребенка удалось добиться полной клинико-лабораторной ремиссии через 4-5 недель от начала лечения, у 8 (7,8%) детей несколько позднее - через 10-12 недель, у 11 (10,6%) пациентов через 18 недель, у 3 (2,9%) детей - изолированные изменения в моче выявлялись до 1 года, что в целом является характерным для типичной формы острого гломерулонефрита. Через 5 лет наблюдения в этой группе констатировано клиническое выздоровление.
В то же время, у 36 (25,9%) детей регресса симптомов получить не удалось, в результате чего, в последующем сформировался хронический гломерулонефрит, который проявлялся повышением показателей активности воспалительного процесса (анемический синдром, гипергаммаглобулинемия) и мочевым синдромом. Характерным было быстрое исчезновение клинических признаков, однако, нормализация лабораторных показателей не всегда была устойчивой. У 33,3% больных фиксировались рецидивы мочевого синдрома после нормализации состояния в первые 3 месяца. В 66,7% случаев изменения в моче в виде протеинурии и (или) гематурии персистировали более 12 месяцев. В дальнейшем мочевой синдром сохранялся к концу 2 года болезни у 20,9% детей, к концу 3-го года у 5,1% пациентов. Через 5 лет от начала болезни никто из пациентов второй группы не выздоравливал.
Таким образом, по нашим данным к прогностически неблагоприятным факторам хронизации гломерулонефрита у детей можно отнести: наличие очагов хронической инфекции (тонзиллит, кариес), отягощенную по почечной патологии и артериальной гипертензии наследственность; непостоянные изменения в анализах мочи до развития ГН; отягощенный аллергологический анамнез; развитие ГН на фоне врожденной или приобретенной патологии почек (кисты, нефроптоз, агенезия почки); увеличение длительности симптомов ОГН, начиная с четвертого месяца от начала заболевания (склонность к затяжному течению); изменения в осадке мочи в виде продолжительной по времени макрогематурии и умеренно выраженной протеинурии; малосимптомное течение дебюта ГН, пубертатный возраст.
Полученные результаты свидетельствуют о необходимости проведения углубленного обследования и интенсивной терапии для профилактики заболевания.
