Введение. Гастроэнтерологические заболевания у детей, несмотря на достигнутые успехи в изучении их этиологии, патогенеза, разработку новых методов диагностики и терапии, остаются проблемой педиатрии. В последние годы отмечается омоложение патологии органов пищеварения, со смещением первого пика заболеваемости на ранний возраст, когда преимущественно определяются функциональные расстройства желудочно-кишечного тракта [1].
Значительную роль в развитии заболеваний органов пищеварения у детей младшего возраста играют снижение барьерной функции желудочно-кишечного тракта, его местной специфической и неспецифической защиты, высокий уровень антигенной нагрузки [2, 3]. В настоящее время немаловажное значение отводится инфекционный факторам [4-6]. Особый интерес приобретает изучение влияния герпесвирусных инфекций (ГВИ) на формирование и характер течения патологии у детей младшего возраста.
Распространенность герпесвирусов в популяции, множественность путей передачи, в том числе внутриутробное инфицирование, преимущественное заражение в детском возрасте, пожизненная персистенция, пантропизм к различным органам и тканям, полиморфизм клинических проявлений позволяют считать ГВИ важной медико-социальной и педиатрической проблемой [6, 7].
Известно, что ГВИ, изменяют характер иммунного ответа организма [9, 12]. Они способны подавлять продукцию интерферона (INF) и/или других цитокинов, препятствовать или прерывать сигнальные и антивирусные пути их действия, нарушать равновесие Th1/Th2 в сторону Th1-ответа, и таким образом, активировать клеточный иммунитет и снижать факторы гуморальной защиты, что в свою очередь утяжеляет течение основного заболевания [10, 11, 16, 17]. Однако до настоящего времени, изучение распространенности данных инфекций у детей раннего и дошкольного возраста проводилось в ограниченном объеме, не ясна роль герпесвирусов в развитии соматической, в том числе гастроэнтерологической патологии [7, 8].
Выше изложенное определило цель исследования: изучить влияние герпесвирусной инфекции на формирование и течение пищевой аллергии у детей с гастроэнтерологической патологией.
Материалы и методы. В клинике ФГБУ «Нижегородский НИИ детской гастроэнтерологии» обследованы 32 ребенка в возрасте от 2 месяцев до 7 лет, 19 мальчиков и 13 девочек, с пищевой аллергией в виде атопического дерматита или дермато-интестинальной её формы и функциональными нарушениями желудочно-кишечного тракта (функциональный запор, функциональная диарея).
Всем детям проведено стандартизованное обследование гастроэнтерологического больного. Для постановки диагноза атопический дерматит использована рабочая классификация, разработанная в рамках научно – практической программы «Атопический дерматит у детей: диагностика, лечение и профилактика» [12]. Диагноз пищевой аллергии основывался на оценке данных аллергологического анамнеза, диетического анализа с оценкой результатов ведения пищевого дневника, проведении эллиминационной диеты, провокационных тестов, данных лабораторного исследования [14]. Диагноз функциональные нарушения дефекации ставили согласно «Рабочей классификации функциональных заболеваний органов пищеварения у детей» [13]. Для выявления факторов риска проводилось интервьюирование матерей согласно разработанной анкете.
Для оценки провоспалительного потенциала цитокинов исследована концентрация ИНФ-γ, для противовоспалительного - ИЛ-4 и ИЛ-10 методом иммуноферментного анализа с использованием тест–систем «ProCon» (ООО «Протеиновый контур», С.-Петербург). Для диагностики наличия инфекционного фактора определены ДНК цитомегаловируса (CMV), вируса Эпштейна-Барр (EBV) в биологическом материале (в клетках крови, моче, соскобе с задней стенки глотки) методом полимеразной цепной реакции с гибридизационно-флюоресцентной детекцией в режиме «реального времени» (Вio-Rad, США).
С учетом активности ГВИ у детей с пищевой аллергией и функциональными нарушениями ЖКТ (запором, диареей) выделено 2 группы больных:
I группа – 14 детей с пищевой аллергией и функциональными нарушениями ЖКТ без ГВИ.
II группа – 18 больных с пищевой аллергией и функциональными нарушениями ЖКТ (запором, диареей) с ГВИ.
Группы формировались методом стратифицированной рандомизации. Исследование было ретроспектиным наблюдательным сравнительным контролируемым.
Статистическая обработка полученных результатов. Для оценки клинико-лабораторных показателей применяли современные методы статистического анализа, интегрированные в ряде прикладных программ – «Statistiсa 8.0», Excel для Windows 7. Анализ полученных данных включал расчет коэффициентов корреляции Спирмена (R), гамма (g). При анализе качественных исследований достоверность различий в частоте встречаемости того или иного признака в сравниваемых группах оценивали по критерию χ2. Определяли атрибутивный риск (АР). Статистически достоверными различия в сравниваемых группах считались при р < 0,05.
Результаты и их обсуждение. В результате исследования различий по возрастно-половому составу не установлено, в каждой группе под наблюдением находились по 50% детей до года и старше года.
Определено, что ГВИ имели 56 % обследованных (18 из 32) - CMV 50% из 32, EBV 22% (7 из 32), микстинфекция (CMV+EBV) 39% из 32.
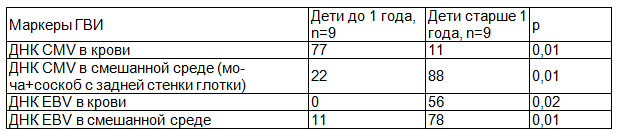
Среди детей II группы выделены следующие формы инфекций: моноинфекция у 61% из 18 в различных биосредах - CMV- инфекция 50% (9 из 18), EBV 22% (4 из 18), у 39% детей старше года обнаруживалась микстинфекция (CMV+EBV). Таким образом, в структуре моногерпесвирусных инфекций преобладала CMV-инфекция, при этом вирусемия достоверно чаще встречалась у детей грудного возраста 77% (р=0,01), а вирусурия у детей старше года (р=0,01), что может свидетельствовать о длительной персистенции возбудителя и хроническом течении данной инфекции [14]. EBV-инфекция существенно чаще диагностировалась у детей дошкольного возраста (R=0,43, р=0,02) (табл. 1).
Таблица 1. Частота выявления маркеров герпесвирусных инфекций в различных биосредах у детей II группы в зависимости от возраста (в %)
При ретроспективном анализе установлено, что наиболее существенными факторами риска, способствующими формированию заболеваний ЖКТ у обследованных детей, были: наследственная отягощенность по гастродуоденальной 25% из 32 и аллергической патологии 70% из 32. Осложненное течение беременность и родов отмечалось у 38% (12 из 32), в виде гестоза, угрозы прерывания беременности у 47% (15 из 32), анемия, как показатель инфицированности, достоверно чаще отмечалась среди матерей детей II группы (АР=37%, р=0,02) [14]; гипоксия плода отмечалась существенно чаще у детей II группы (АР=38%, р=0,04) (табл. 2).
При анализе гастроэнтерологической патологии установлено, что 56% (18 из 32) имели функциональный запор, 25 % (8 из 32) функциональную диарею, при этом у детей I и II групп диарея чаще регистрировалась на первом году жизни 44% из 16, у детей дошкольного возраста чаще наблюдался запор 69% из 16.
В структуре аллергических заболеваний у обследованных детей преобладал АД (91% из 32), при этом тяжелое непрерывно-рецидивирующее его течение, резистентность к стандартной терапии достоверно чаще диагностировалось у детей II группы (р=0,01) (рис.1).
В стационар пациенты в большинстве случаев поступали в период обострения АД (63% из 32), при этом детей II группы было существенно больше, чем пациентов I группы (р=0,04).
Доказана прямая корреляционная зависимость между наличием CMV- инфекции и функциональной диарей у детей до года (R=0,78, р=0,001).
Таблица 2. Анте- и интранатальные факторы риска у детей I и II групп
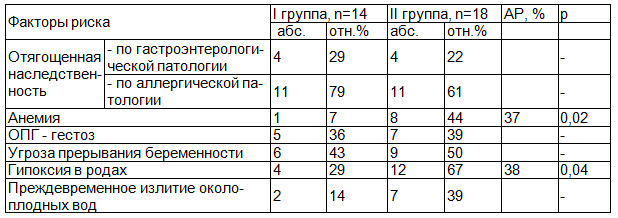
Примечание: n – число наблюдаемых детей; р – достоверность различий между руппами; АР – атрибутивный риск.
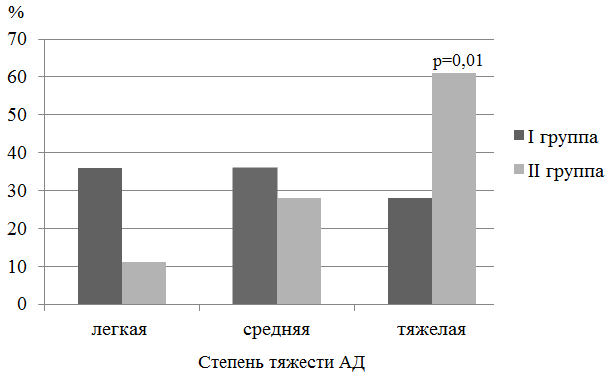
Рис. 1. Распределение детей, наблюдаемых групп в зависимости от степени тяжести АД по шкале SCORAD (в %); p - достоверность различий между детьми I-II групп.
При исследовании цитокинового профиля выявлено, что концентрация ИЛ-4 чаще была увеличена у детей II группы 72% из 18, в основном у детей с CMV-инфекции (g=1,0, р=0,004), при этом наивысший уровень ИЛ-4 отмечался при хроническом течении микстинфекциии (CMV+EBV в моче).
Уровень синтеза ИНФ-γ был снижен у большинства пациентов обеих групп - в I у 57% из 14, во II у 61% из 18 детей. У каждого второго ребенка из I группы в цитокиновом профиле были выявлены изменения характерные для ПА - смещение соотношения Th1/Th2-ответа в сторону Th2-хелперов (отмечался повышенный уровень ИЛ-4 и низкий INF-g). У 88% из 8 детей данной группы отмечалось легкое или средней тяжести течение АД и лишь 12% имели тяжелую форму заболевания (р=0,004).
Среди детей II группы смещение баланса в сторону Th2-ответа было выявлено у 44% из 18 обследованных, в основном это были пациенты до года 75% (7 из 9), что, очевидно, связано с анатомо-физиологическими особенностями иммунной системы ребенка - преобладанием Th2-ответ в первые годы жизни [2, 3, 11]. При этом, у всех детей с повышенным уровенем ИЛ-4 и низкими показателями INF-g выявлялась ДНК CMV в смешанной среде (моча+соскоб с задней стенки глотки), вирусемия CMV отмечена лишь у 50% из 8, вирусурия EBV у 38% из 8. Установлена взаимосвязь между низкими показателями ИФН и тяжелым течением АД (γ=-0,4, р=0,008).
Высокие уровни ИНФ-γ и ИЛ-4 имели 28% из 32 пациентов II группы, чаще это были дети дошкольного возраста 80% (4 из 5), ГВИ у них выявлялась в крови и в структуре преобладала EBV-инфекция 40% из 5, реже выявлялась вирусемия CMV 20% и микстинфекция CMV+EBV 20% из 5. Среди пациентов с высокими показателями ИНФ-γ и ИЛ4 в 100% случаев регистрировалось обострение АД, однако, степень тяжести по SCORAD была значительно легче (легкая у пациентов с микстинфекцией CMV+EBV 20% из 5, средняя 40% (2 из 5), тяжелая 40% из 5).
Таким образом, можно полагать, что при длительной персистенции герпесвирусных инфекций происходит снижение уровня (истощение) ИНФ-γ, активация ИЛ-4, что усугубляет течение АД с преобладанием пищевой аллергии у детей. В активную фазу ГВИ уровень ИНФ-γ наоборот повышается, что приводит к смещению иммунного ответа в сторону Th1типа и более легкому течению АД. В свою очередь в условиях ослабленного иммунологического контроля (снижение ИНФ-γ) не только становится невозможной полная элиминация вируса, но и создаются условия для формирования более тяжелых, резистентных к стандартной терапии форм пищевой аллергии у детей.
Определена взаимосвязь между наличием EBV-инфекцией и высокими показателями ИЛ-10 (g=0,72, р=0,01), известно что EBV способен продуцировать ИЛ-10 подобный белок. Способность EBV к персистенции, несмотря на высокую иммунногенность, указывает на то, что вирус способен вырабатывать механизм ускользания от иммунного ответа. Известно, что экспрессируемый EBV белок BCRF-1, по аминокислотной последовательности совпадающий с цитокином ИЛ-10 и вызывающий его мимикрию, способствует тем самым подавлению синтеза ИНФ-γ периферическими мононуклеарами. Это обеспечивает ускользание вируса от иммунного надзора при острой инфекции и при ее реактивации [14, 17, 18].
Выводы
- Для детей раннего и дошкольного возраста с пищевой аллергией и функциональными нарушениями желудочно-кишечного тракта характерна высокая частота герпесвирусной инфекции (56% детей), в том числе CMV - 50,0% случаев, EBV - 22%, микстинфекция (CMV+EBV) 39%.
- Выявлены анте- и интранатальные факторы риска инфицирования ГВИ у детей первых семи лет жизни: анемия (АР=37%, р=0,02), гипоксия плода (АР=38%, р=0,04).
- Для детей с пищевой аллергией и функциональными нарушениями желудочно-кишечного тракта на первом году жизни характерна высокая частота активной CMV-инфекции (р=0,01), у пациентов старше года существенно чаще диагностируется EBV-инфекция (р=0,02).
- Тяжелое непрерывно-рецидивирующее течение атопического дерматита, резистентного к стандартной терапии, существенно чаще диагностируется у детей c длительной персистенцией герпесвирусной инфекции (р=0,01), сопровождающейся нарушением баланса цитокинов (снижением ИФН и повышением ИЛ4). Это диктует необходимость проведения курсов иммунотропной терапии данному контингенту больных.
