По данным исследований, проведенных эндокринологическим научным центром РАМН, распространенность эндемического зоба в России составляет от 15 до 40%. Негативное влияние йодной недостаточности на развивающийся мозг плода и новорожденного обсуждается многими исследователями [1, 5, 6, 7, 13, 22]. По мнению ряда авторов, недостаток йода в период эмбриогенеза и первые 3 года жизни необратимо изменяют процессы дифференцировки мозга, влияя, таким образом, на интеллектуальное развитие [2, 3, 14, 15].
Отрицательное влияние дефицита йода на развивающийся мозг обусловлено сниженным уровнем гормонов щитовидной железы тироксина (Т4) и трийодтиронина (Т3), для которых йод является субстратом [1, 2, 3, 5, 15].
Достаточный уровень циркулирующего Т4 является решающим для нормального функционирования и созревания нервных клеток и развития нейрональных связей [17, 22].
Тиреоидные гормоны влияют на миелинизацию нервных волокон. [15]. Миелиновая оболочка многократно ускоряет проведение нервного импульса [10]. Развитие миелинизации подкорковых путей и неспецифических систем регуляции ствола мозга, и лимбических структур в анте- и раннем постнатальном периодах имеет первостепенное значение в онтогенетических изменениях электроэнцефалограмм (ЭЭГ) [10].
Электроэнцефалография является доступным и распространенным методом параклинической диагностики функциональных и метаболических нарушений мозга детей, в том числе новорожденных [10].
Изучение характера взаимосвязи между степенью йодной обеспеченности и функциональной активностью головного мозга поможет объективнее оценить влияние йодной дотации в анте и раннем постнатальном периоде на развитие головного мозга.
Среди большого количества работ, посвященных взаимосвязи йодобеспеченности и функционального состояния головного мозга, в том числе в детском возрасте, исследований по изучению развития одного и того же контингента детей с первых дней жизни до 3-х лет, с оценкой функциональной активности щитовидной железы, особенностей электроэнцефалограммы и их зависимости от наличия йодной профилактики в различные возрастные периоды, нами в литературе не найдены.
Целью настоящего исследования являлась объективизация вклада профилактического назначения йода в анте– и постнатальном периодах на функциональную активность тиреоидной системы и особенности биоэлектрической активности головного мозга у детей раннего возраста.
Материалы и методы. Объектом исследования стали 122 клинически здоровые дети. Все дети рождены от желанной запланированной беременности. Возраст женщин составил от 20 до 33 лет. Все матери состояли на учете в женских консультациях г. Нальчика. Настоящая беременность у всех женщин протекала без осложнений.
Роды во всех случаях произошли в срок, в головном предлежании. Родились дети без асфиксии, в родильном зале были приложены к груди матери. Ранний неонатальный период протекал без осложнений. Выписаны дети домой на 5-6 сутки жизни в удовлетворительном состоянии.
Обследование проводили в городской детской поликлинике №2 г. Нальчика в 1, 3, 6, 9, 12 месяцев жизни и 3 года.
Все дети были распределены в 4 группы.
Первую (контрольную) группу составили 56 детей (26 девочек и 30 мальчиков), матери которых получали йод во время беременности и в период грудного вскармливания. После окончания грудного вскармливания их дети получали препарат йода до 3-х лет.
Вторую группу 41 ребенок (22 девочки и 19 мальчиков) составили дети, матери которых не получали йод во время беременности и в период грудного вскармливания. После прекращения кормления грудью мамы не давали препараты йода своим детям.
В третью группу были включены 11 детей (7 девочек и 4 мальчика), матери которых не получали йодной поддержки во время беременности, но получали его в течение всего периода грудного вскармливания и их дети получали йод до 3-х летнего возраста.
Четвертую группу составили 14 детей, (14 девочек), матери которых получали йод во время беременности, но не получали его в период грудного вскармливания. Не получали йод и их дети после прекращения грудного вскармливания до достижения 3-х летного возраста.
При назначении препаратов йода женщинам во время беременности и в период грудного вскармливания доза его составляла 250 мкг в сутки. Детям йод назначался, исходя из потребности - 100 мкг в сутки [26].
Йод давался в виде отдельного таблетированного препарата (Йодомарин 100 или Йодомарин 200 фирмы «Берлин-Хеми»).
Посредством анкетирования родителей анализировалась информация о характере питания матери, типе молочной смеси, используемой для докорма, сроках введения в рацион блюд коррекции и прикормов, их характере, количестве и переносимости. Индивидуально рассчитывалась доза йода, получаемая ребенком со смесью.
Особое внимание обращали на продолжительность грудного вскармливания. До 9 месяцев жизни достоверных отличий по частоте грудного вскармливания у детей разных групп не отмечено. В 12 месяцев еще сохранялось грудное вскармливание у 6 детей (10,7%) из 1-й группы, 5 детей (12,1%) из 2-й группы, 2 детей (18,1%) из 3-й группы и отсутствовало в 4-й группе.
Уровень ТТГ, Т4, Т3 в сыворотке крови определяли в 1, 3, 6, 9, 12 и 36 месяцев жизни с помощью твердофазного иммуноферментного анализа набором «ИФА-БЕСТ». Минимальная достоверно определяемая концентрация для ТТГ не превышала 0,1мМЕ/л; для Т3-0,1 нмоль/л, и Т4-1,0 пмоль/л.
Регистрация ЭЭГ проводилась биполярно, монополярно с объединенным ушным индифферентным и с референтным электродами. Процедура наложения электродов, способ их расположения на голове ребенка соответствовали стандартной схеме «система 10-20» (активные электроды налагались в точках Fp1, Fp2, F3, F4, C3, C4, P3, P4, O1, O2, F7, F8, T3, T4, T5, T6). Запись осуществлялась на электроэнцефалографе «ТЕЛЕПАТ-104» фирмы «Потенциал» г. Санкт-Петербург. Постоянная времени – 0,3 с, фильтр высоких частот 30 Гц, сопротивление электродов не выше 15 кОм. Для идентификации ритма использованы критерии: 1 – частоты ритмического компонента, 2 – пространственного расположения топического максимума по коре головного мозга, 3 – реактивности к функциональным нагрузкам.
Дети 3-летнего возраста подготавливались родителями и персоналом для будущего исследования. Иногда демонстрировали исследование на примере других детей. Сытый, сухой ребенок помещался в звуко-светоизолированный кабинет. Ребенок сидел самостоятельно или находился на руках у матери. После адаптации к условиям камеры проводилась регистрация ЭЭГ. С целью выяснения характеристик онтогенетических вариантов у детей 3-х лет проводилась регистрация ЭЭГ в условиях спокойного бодрствования при полном затемнении камеры.
Выделялось 10 фрагментов длительностью 4 с, не содержащих артефактов. После монтажа непрерывной записи выделенный интервал подвергали периодометрическому и спектральному анализам. Спектры настроены: дельта-диапазон 1–3,5 Гц, тета-диапазон 4–6 Гц, альфа-диапазон 6,5–13 Гц и бета-диапазон 14–28 Гц. Данные автоматически переносились в программу Excel и подвергались статистической обработке.
С целью исключения пароксизмальной активности все паттерны оценены визуально. С этой же целью, осуществлялась регистрация электроэнцефалограммы с проведением проб с включением света и повторным выключением через 5 сек, фоностимуляцией, фотостимуляцией (на частотах 6, 8, 10, 12, 14 и 16 Гц и 7, 9, 11, 13, 15 Гц) и во все фазы сна.
Все дети осматривались узкими специалистами в 1, 3, 6, 9, и 12 мес., а также в 3 года. Все данные внесены в амбулаторную карту (форма №112/у).
Статистическая обработка результатов проводилась с использованием пакета прикладных программ STATISTICA 6.0. в соответствии с методиками статистического анализа, изложенными в книге Ребровой О.Ю. «Статистический анализ медицинских данных. Применение пакета прикладных программ Statistica» [9].
Для анализа и оценки полученных данных применялись стандартные методы вариационной статистики: вычисление экстенсивных, интенсивных показателей и их средних ошибок (М±m), средних величин и стандартных отклонений (M±σ). Достоверность разницы двух сравниваемых показателей оценивалась по критерию Стьюдента для зависимых и независимых выборок - Вилкоксона. В качестве уровня статистической значимости было принято р<0,05.
Результаты. Определение гормонального профиля щитовидной железы по уровню тиреоидных гомонов ТТГ, Т3, Т4 является критерием ее функционального состояния.
Полученные результаты у детей контрольной (первой) группы отнесены к нормативным и использованы для сопоставления с аналогичными данными у детей 2, 3 и 4 групп (табл.1).
Таблица 1. Динамика уровня гормонов щитовидной железы
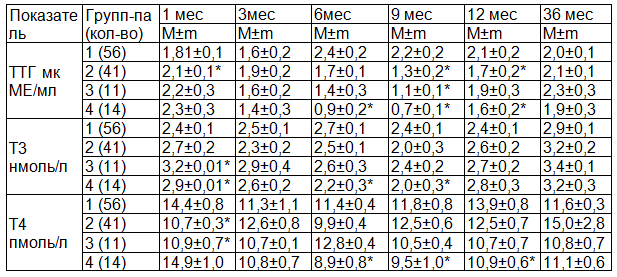
Примечание: * - достоверные различия в показателях в сравнении с 1 группой (р<0,05).
В возрасте 1 месяца самый низкий уровень ТТГ регистрировался в 1-й группе и достоверно отличался от 2-й группы (р1-2<0,001). Уровень Т3 в этот период достоверно выше в 3-й и 4-й группах в сравнении с 1-й группой (р1-3<0,001), (р1-4<0,004). Уровень Т4 в группах получавших йод с антенатального периода (1-я и 4-я группы) достоверно выше, чем во 2-ой и 3-й группах (р1-2<0,001), (р1-3<0,001), (р2-4<0,001), (р3-4<0,001), соответственно. Между группами 2 и 3 в возрасте 1 мес. достоверных отличий по уровню гормонов не выявлено.
В возрасте 3 мес. достоверных отличий, ни по одному из гормонов выявлено не было.
При сравнении уровня ТТГ у детей в 6 мес. и 3 мес., отмечено, что он увеличивается в 1-й группе, а во всех остальных группах - снижается. Достоверные отличия выявлены между 1-й и 2-й группами с 4-й группой (p1-4<0,01), (p2-4<0,01). Уровень Т3 имел тенденцию к снижению в 1-й, 2-й группах, а в 3-й и особенно в 4-й группе отмечается его снижение. Достоверное отличие выявлено только между 1-й и 4-й группами (p1-4<0,01). К 6 мес. уровень Т4 снижается во 2-й и 4-й группах, повышается в 3-й группе и неизменен в 1-й группе с достоверными отличиями между 1-й и 4-й группами (p1-4<0,01), 2-й и 3-й (p2-3<0,01), и 2-й и 4-й группами (p2-4<0,001).
К 9 месяцам уровень ТТГ снижается и достигает самых низких значений за весь период изучения во 2-й - 4-й группах. Их уровень достоверно меньше чем в 1-й группе (p1-2<0,01), (p1-3<0,01), (p1-4<0,001). Уровень Т3 имел тенденцией к снижению во всех группах без достоверных отличий между собой. Уровень Т4 в данный период увеличился в сравнении с 6 мес. в 1-й, 2-й и 4-й группах и снизился в 3-й группе с достоверными отличиями 1-й и 2-й групп от 4-й группы (p1-4<0,05), (p2-4<0,02).
В возрасте 12 мес. отмечена тенденция к повышению ТТГ во всех группах кроме 1-й. В данной группе уровень ТТГ остается на прежнем уровне и достоверно отличается от 2-й и 4-й групп (p1-2<0,04), (p1-4<0,02) соответственно. Уровень Т3 в 12 мес. изменяется в группах сравнения идентично уровню ТТГ, но без достоверных отличий. Уровень Т4 имеет тенденцию к увеличению в 1-й и 4-й группах, а во 2-й и 3-й группах - не меняется с достоверными отличиями 1-й группы от 3-й и 4-й групп (p1-3<0,01), (p1-4<0,01).
В возрасте 36 мес. уровень ТТГ во всех группах, кроме 1-й, с тенденцией к увеличению. Таким образом, во всех группах значение данного гормона уравнивается и достоверно не отличается в группах сравнения. Уровень Т3 увеличивается во всех группах без достоверных отличий. К 3-м годам уровень Т4 в 1-ой группе незначительно снижается, во 2-й и 4-й группах с тенденцией к увеличению, а в 3-й группе остается неизменным. Достоверных отличий по уровню Т4 в группах сравнения не выявлено.
Все изученные ЭЭГ паттерны укладывались в классическую норму. Ни у одного ребенка пароксизмальной активности не выявлено.
При оценке ЭЭГ паттернов 1-й группы в возрасте 36 мес. выявлено: альфа колебания регистрировались с максимальной амплитудой в затылочных отведениях О2 и О1 89,84±9,38 мкВ и 95,4±9,85соответсвенно. Минимальная амплитуда зарегистрирована по передним отведениям F4 25,2±3,25 мкВ и F3 23,5±2,38мкВ. Все 56 паттернов ЭЭГ (100%) имели градиент альфа ритма. Физиологическая межполушарная асимметрия по амплитуде альфа ритма зарегистрирована в отведениях О2-1, Р4-3, Fp2-1 и F4-3. Частота альфа ритма была 7 Гц у 3-х детей (5,3% случаев), 8Гц. у 51 ребенка (91,1% случаев) 9 Гц в 2-х детей (3,5% случаев).
Индекс альфа ритма менее 40% у 5 детей (8,9%) у всех остальных более 40%.
Медленноволновая активность тета диапазона, регистрируется во всех отведениях с максимальной амплитудой по передним отведениям Fр2 -25,8±3,31 мкВ и Fр1- 22,8±3,11 мкВ.
Частота тета активности 4 Гц у 12 детей (21,4% случаев), 5Гц- 23 детей (41,1%) и 6 Гц. у 21 ребенка (37,5% случаев). Индекс тета ритма менее 40% у 55 детей (98,2% случаев) и более 40% у 1 ребенка (1,7%).
Колебания дельта диапазона регистрировались только по передним отведениям с амплитудой по F4 25,2±3,32 мкВ и по F3 23,5±3,42мкВ. Частота дельта ритма у всех детей была 3 Гц. Индекс дельта ритма был менее 20% у всех детей (100%).
Данные спектрального анализа приведены в табл. 2.
Таблица 2. Данные спектрального анализа в возрасте 3-х лет в группах изучения, M±m
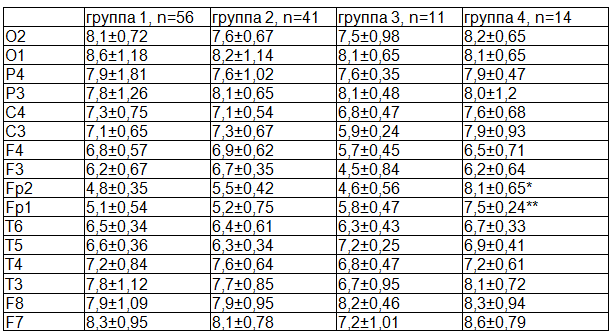
Примечание: *p1-4<0.045, p4-3<0,035, p4-2<0,054, ** p1-4<0.048, p4-3<0,041, p4-2<0,053.
При оценке ЭЭГ-паттернов у детей 2-й группы в возрасте 36 мес. выявлено: альфа-колебания регистрировались с максимальной амплитудой в затылочных отведениях О1 и О2 88,6±9,63мкВ и 78,4±8,24 мкВ соответственно. Минимальная амплитуда зарегистрирована по передним отведениям. F3 21,1±2,78 мкВ и F4 22,6±2,34 мкВ, что указывает на градиент альфа ритма.
Физиологическая межполушарная асимметрия по амплитуде альфа ритма зарегистрирована в отведениях О2-1, Р4-3, Fp2-1 и F4-3. Частота альфа ритма была 7 Гц у 12 детей (29,2% случаев), 8Гц у 26 детей (63,4% случаев) 9 Гц в 3 детей (7,3% случаев).
Индекс альфа ритма менее 40% у 3 детей (7,3%), у всех остальных более 40%.
Медленноволновая активность тета диапазона регистрируется во всех отведениях с максимальной амплитудой по передним отведениям F7 24,6±3,21 мкВ и F8 25,8±3,39 мкВ.
Частота тета активности 4 Гц у 10 детей (24,3% случаев), 5Гц у 23 детей (63,4%) и 6 Гц. 8 детей (19,5% случаев). Индекс тета ритма менее 40% у 36 детей (87,8% случаев) и более 40% у 5 детей (12,1%).
Колебания дельта диапазона регистрировались только по передним отведениям F4 и F3 с амплитудой 25,2±2,32 мкВ и 23,5±3,42 мкВ соответственно. Частота дельта ритма у всех детей была 3 Гц. Индекс дельта ритма был менее 20% у всех детей (100%).
При оценке ЭЭГ-паттернов в 3-й группе в возрасте 36 мес. выявлено: альфа-колебания регистрировались с максимальной амплитудой в затылочных отведениях О1 и О2 82,6±9,26 мкВ и 73,4±8,11 мкВ соответственно. Минимальная амплитуда зарегистрирована по передним отв. F3 24,3±3,83 мкВ и F4 22,6±2,14 мкВ, что указывает на градиент альфа-ритма. Превалирование амплитуды альфа-ритма в левых отделах по амплитуде альфа ритма выявлено в отведениях О1-2, Р4-3 С4-3, Fp2-1 и Т4-3.
Частота альфа ритма была 7 Гц у 2 детей (18,1% случаев), 8Гц у 6 детей (54,5% случаев), 9 Гц у 3 детей (27,2% случаев).
Индекс альфа ритма менее 40% у 2 детей (18,1%) у всех остальных более 40%.
Медленноволновая активность тета диапазона, регистрируется во всех отведениях с максимальной амплитудой по передним отведениям Fр1 24,6±3,21 мкВ и Fр28 25,8±3,39 мкВ.
Частота тета активности 4 Гц у 6 детей (54,5% случаев), 5 Гц 5 детей (45,5%). Индекс тета ритма менее 40% у 4 детей (36,2% случаев) и более 40% у 7 детей (63,6%) случаев.
Колебания дельта диапазона регистрировались по передним отведениям Fр1, Fр2, Т6, Т5 с максимальной амплитудой в отведениях F4 и F3 равной21,8±2,38 мкВ и 22,1±1,41 соответственно. Частота дельта ритма у всех детей была 3 Гц. Индекс дельта ритма был менее 20% у всех детей (100%).
При оценке ЭЭГ-паттернов в 4-й группе в возрасте 36 мес. выявлено: альфа-колебания регистрировались с максимальной амплитудой в затылочных отведениях О1 и О2 86,8±9,28 мкВ и 96,3±10,64 мкВ соответственно. Минимальная амплитуда зарегистрирована по передним отведениям Fp1 13,2±1,26 мкВ и Fp2 15,6±1,21 мкВ, что указывает на градиент альфа-ритма. Превалирование амплитуды альфа-ритма в правых отделах отмечено во всех отведениях кроме Т4-3.
Частота альфа ритма была 7 Гц у 2 детей (14,2% случаев), 8 Гц у 9 детей (64,2% случаев) 9 Гц в 4 детей (28,5% случаев).
Индекс альфа ритма у всех детей более 40%.
Медленноволновая активность тета диапазона регистрируется во всех отведениях с максимальной амплитудой по передним отведениям F7 26,6±4,21 мкВ и F8 23,8±3,21мкВ.
Частота тета активности 4 Гц у 2 детей (14,2%) случаев, 5 Гц у 9 детей (64,2%) случаев и 6 Гц у 3 детей (21,4% случаев). Индекс тета ритма менее 40% у всех 14 детей.
Колебания дельта диапазона регистрировались только по передним отведениям F4 и F3 с амплитудой 16,6±1,35 мкВ и 18,8±1,45мкВ соответственно. Частота дельта ритма у всех детей была 3 Гц. Индекс дельта ритма был менее 20% у всех детей (100%).
При вычислении спектральной мощности плотности выявлено, что в 4-й группе он выше в отведениях Fp1 и Fp2 с достоверными отличиями.
Обсуждение. При анализе средних величин гормонов щитовидной железы в группах изучения и оценке их динамики было отмечено, что уровень ТТГ в 1-й группе (контрольной) в месячном возрасте был ниже, чем во всех остальных группах, но к 6 мес. происходил его рост, в то время как в других группах он снижался. В результате этого к 6 месяцам существенных отличий по уровню ТТГ между группами не было. С 6 мес. до 3-х лет уровень ТТГ в группе 1 значимо не менялся, в то время как у детей других групп отмечалось снижение уровня ТТГ к 9-12 месяцам жизни с постепенным подъемом к 12-36 месяцам.
Уровень Т3 сохранялся на одном уровне на протяжении всего периода наблюдения в группе, где проводилась йодная дотация с антенатального периода, в других группах менялся разнонаправлено.
Уровень Т4 снижается к 3 мес. в контрольной 1-й группе и далее его уровень значимо не менялся. Во 2-й группе тенденция противоположная - в виде снижения уровня к 3 мес. и дальнейшего увеличениея к 3 годам. В 4-й группе уровень Т4 увеличивался после 6 мес.
В возрасте 3-х лет достоверных отличий по уровню всех гормонов щитовидной железы между группами не было.
При анализе полученных данных выявлено, что в 1-й и 4-й группах (дотированных йодом в анте- и постнатальном периодах, или только в антенатальном периоде) амплитуда альфа ритма выше, индекс медленно-волновой активности тета и дельта диапазонов меньше и топическое расположение дельта волн ограничено только передними отведениями в сравнении со 2-й и 3-й группами. По нашему мнению, это связано с тем, что в группах с йодной дотацией в антенатальном периоде миелинизация нервных волокон происходит в более ранние сроки с более ранним объединением ассоциативных путей в нейрональные ансамбли.
Выводы
- При наличии йодной дотации в анте- и постнатальном периоде уровень гормонов щитовидной железы характеризовался относительным постоянством в течение первого года жизни, в то время как отсутствие профилактики приводило к разнонаправленным существенным изменениям их уровня.
- Отличия по уровню гормонов щитовидной железы в зависимости от наличия йодной дотации, периода ее назначения носят транзиторный характер и в 36 месяцев жизни не выявляются.
- Отсутствие йодной дотации, особенно в антенатальном периоде сопровождается более высоким уровнем ТТГ, Т3 и низким Т4 у детей к концу неонатального периода.
- Высокие показатели амплитудно - частотного колебания альфа ритма были характерны для детей получавших йодную дотацию в анте и постнатальном периодах в сравнении с детьми не получавшими йодную дотацию ни в одном из этих периодов. Вероятно, это связано с уровнем миелинизации ретикулярной формации ствола мозга и более ранним объединением ассоциативных путей в нейрональные ансамбли при проведении йодной профилактики.
