Одной из наиболее значимых задач в современной анестезиологии является объективизация контроля адекватности общего обезболивания. Согласно современной концепции анестезиологического обеспечения, под анестезией подразумевается не только адекватное обезболивание, но и полное управление всеми жизненно важными функциями организма пациента во время операции, что требует как высокого профессионализма врача-анестезиолога, так и использования специальных методов диагностики состояния больного в интраоперационном периоде, позволяющих оценить адекватность проводимой анестезии [2,7].
Сознание у пациента может сохраняться даже на фоне вполне адекватной анестезии [5,6]. Сведения о частоте интраоперационного пробуждения во время общей анестезии весьма противоречивы. По данным зарубежных авторов частота их в целом колеблется от 0,1% до 4% даже при "хорошо проведенных анестезиях" [7].
Одним из основных показателей, отражающих адекватность течения анестезии, является оценка состояния функции центральной нервной системы, на которой основана современная теория контроля течения общей анестезии. Однако в настоящее время отсутствуют четкие критерии, с помощью которых можно абсолютно точно оценить состояние центральной нервной системы (ЦНС) в интраоперационном периоде, и которые могли бы быть использованы в повседневной клинической практике, что, в свою очередь, затрудняет проведение мониторинга адекватности анестезии [1,4].
Материалы и методы. Работа выполнена в детском хирургическом отделении и детском урологическом отделении ОБУЗ «Ивановская областная клиническая больница». Было обследовано 35 детей в возрасте от 5 до 14 лет, находившихся на плановом оперативном лечении по поводу грыж брюшной стенки различных локализаций, варикоцеле, водянок оболочек яичка и его придатков, фимозов. В качестве методов обезболивания были применены в первой группе - масочный наркоз по полузакрытому контуру с использованием комбинации ингаляционного анестетика фторотана и внутримышечного введения ненаркотического анальгетика кеторолака (n=21) возраст детей от 4 до 10 лет. Во второй группе – масочный наркоз по полузакрытому контуру использованием ингаляционного анестетика севорана и внутримышечного введения ненаркотического анальгетика кеторолака (n=7) возраст пациентов от 4 до 13 лет. В третьей группе применен внутривенный анестетик пропофол в комбинации с наркотическим анальгетиком фентанилом (n=8) возраст обследуемых 13-14 лет. С целью премедикации пациентам за 30 минут до операции внутримышечно вводился атропин в дозе - 0,02 мг/кг и седуксен - 0,2 мг/кг соответственно.
Для оценки глубины наркоза использовались клинические критерии и проводилась регистрация электроэнцефалограммы (ЭЭГ) с одного лобного датчика. Биофизической сущностью ЭЭГ является регистрация биопотенциалов огромного числа нейронов и их отростков, что составляет суммарную биоэлектрическую активность головного мозга. Эпохи анализа нативной ЭЭГ выбирались вручную в соответствии со стадией наркоза. Оценивались показатели средней мощности и средней частоты волн альфа, бета, тета и дельта диапазонов. Время для подготовки оборудования к регистрации параметров занимает в среднем 3-5 минут (наложение 3-х электродов (лоб, щека, Сz- земля), ввод данных в карточку пациента). Процедура регистрации параметров даже у самых юных пациентов не вызвала дополнительной стрессовой реакции, а наоборот, отвлекала от происходящего в операционном зале. Исследование выполнено при помощи прибора «НейроЭМГмикроМС», компания «Нейрософт» г. Иваново.
Результаты и обсуждение. Зафиксированные нами изменения конфигурации волн, их частотные и мощностные характеристики, независимо от комбинации применяемых анестетиков и возраста пациентов, подчиняются всеобщему правилу изменения картины ЭЭГ под действием анестетиков, предложенному Faulconer и Bickford [3]. Данное правило проявляется как замедление частоты и увеличение мощности волнового диапазона, за которым следует снижение мощности ЭЭГ в зависимости от клинического диапазона глубины анестезии.
Результаты проведенного анализа мощности и частоты волн альфа, бета, дельта и тета диапазона ЭЭГ по стадиям наркоза в группах представлены в табл. 1-4.
Таблица 1. Мощность и частота основных ритмов ЭЭГ. Группа 1, 4-6 лет, n=13
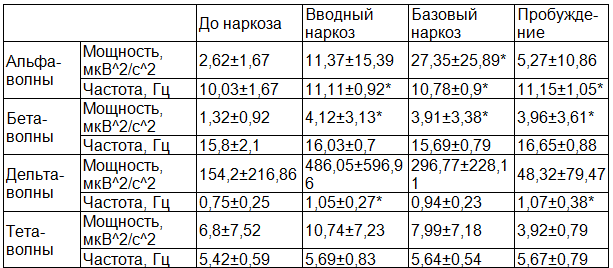
Примечание: здесь и далее * - p<0,05- показатели основных ритмов ЭЭГ, соответствующие стадиям наркоза, достоверно отличающиеся от исходных.
Достоверны различия на стадии вводного наркоза по частоте альфа-волн p<0,003, по мощности бета- волн p<0,005, по частоте дельта-волн p<0,007. В хирургическую стадию наркоза достоверно различаются мощность альфа-волн p<0,003, частота альфа-волн p<0,03 и мощность бета-волн p<0,02. В стадию пробуждения достоверно различаются частота альфа-волн p<0,004, мощность бета-волн p<0,02 и частота дельта-волн p<0,02.
Таблица 2. Мощность и частота основных ритмов ЭЭГ. Группа 1, 7-10 лет, n=8
Достоверны различия на стадии вводного наркоза по частоте альфа-волн p<0,05, по мощности бета- волн p<0,04, по частоте дельта-волн p<0,03. В хирургическую стадию наркоза достоверно различаются мощность альфа-волн p<0,005, мощность бета-волн p<0,002, частота бета-волн p<0,01, мощность дельта-волн p<0,004, частота дельта волн p<0,04, мощность тета-волн p<0,007 и частота тета-волн p<0,02. В стадию пробуждения достоверно различаются частота альфа-волн p<0,008, мощность бета-волн p<0<0,004, мощность дельта-волн p<0,02 и частота дельта-волн p<0,03.
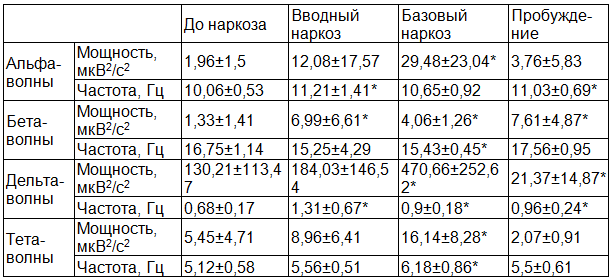
Таблица 3. Мощность и частота основных ритмов ЭЭГ. Группа 2, 4-13 лет, n=7

Достоверны различия на стадии вводного наркоза по мощности альфа-волн p<0,03, по мощности дельта- волн p<0,006, по частоте дельта-волн p<0,0006, по мощности тета-волн p<0,008. В хирургическую стадию наркоза достоверно различаются мощность дельта-волн p<0,006, частота дельта волн p<0,0004, мощность тета-волн p<0,002 и частота тета-волн p<0,002. В стадию пробуждения достоверно различаются частота альфа-волн p<0,0002, мощность бета-волн p<0<0,01 и мощность дельта-волн p<0,05.
Таблица 4. Мощность и частота основных ритмов ЭЭГ. Группа 3, 13-14 лет, n=8
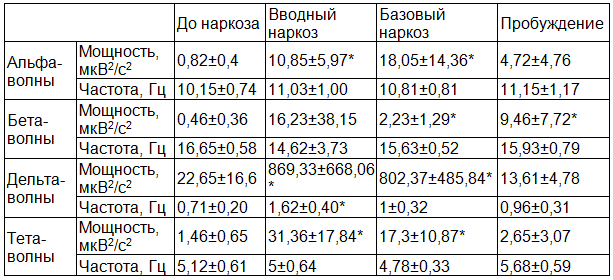
Достоверны различия на стадии вводного наркоза по мощности альфа-волн p<0,0004, по мощности дельта-волн p<0,003, по частоте дельта-волн p<5,77*10‾5, по мощности тета-волн p<0,0004. В хирургическую стадию наркоза достоверно различаются мощность альфа-волн p<0,005, мощность бета-волн p<0,002, мощность дельта-волн p<0,0005, мощность тета-волн p<0,002 . В стадию пробуждения достоверно различается мощность бета-волн p<0<0,006.
Выводы
Регистрация ЭЭГ интраоперационно позволяет объективизировать контроль адекватности обезболивания. Зафиксированные изменения частоты и мощности волн альфа, бета, дельта и тета диапазона могут служить для расчета объективных параметров глубины анестезии в новом программном обеспечении.
