Перекисное окисление липидов является физиологическим процессом, протекающим малоинтенсивно в стационарном режиме. Нарушение в организме системы антиоксидантов, в частности при воспалительных процессах, приводит к избыточной активации данного механизма. Коррекция нарушений перекисного окисления липидов может предотвратить развитие патологического процесса или облегчить его течение. Именно поэтому понимание характера изменений процессов пероксидации под влиянием лекарственного средства может являться одним из показателей, который определяет выбор препарата для лечения той или иной патологии [9].
Было доказано, что ксимедон (международное непатентованное наименование: гидроксиэтилдиметилдигидропиримидин; торговое наименование: ксимедон, производитель: ОАО «Татхимфармпрепараты», г. Казань) способствует подавлению процессов пероксидации при ряде патологических состояний, проявляя тем самым антиоксидантный эффект [2,5,8].
В структуре заболеваемости бронхо-легочной патологии у детей одно из ведущих мест занимает внебольничная пневмония [3; 6]. В последнее время в связи с устойчивостью бактериальных штаммов, этиологически обуславливающих внебольничную пневмонию [4], возникает необходимость в расширении спектра проводимой медикаментозной терапии, в частности засчет препаратов, обладающих антиоксидантным эффектом. Как приведено выше ксимедон может быть отнесен к данной группе препаратов, в связи, с чем появился интерес к исследованию его применения в комплексной терапии внебольничной пневмонии у детей школьного возраста.
Цель исследования: изучить влияние отечественного препарата пиримидинового ряда ксимедон на интенсивность процессов пероксидации в сыворотке крови в эксперименте, составе комплексной терапии внебольничной пневмонии у детей школьного возраста, а также на динамику основных клинических синдромов.
Материал и методы исследования. Эксперимент проводился на трех сериях молодых беспородных крыс обоих полов массой 130–150 г. Для исследования отбирались клинически здоровые животные без видимых дефектов на коже. Животные обеих серий содержались в равных условиях в вивариях (температура окружающей среды, пища, свет). Эксперимент проводился в соответствии с положениями, принятыми Европейской комиссией по надзору за проведением лабораторных и других опытов с участием экспериментальных животных разных видов.
Животным серии №1 за час до моделирования формалинового отека легких вводили ксимедон 15 мг/кг с помощью желудочного зонда. В серии №2 только моделировали формалиновый отек легких с последующим забором крови. Животных вводили в состоянии наркоза путем ингалирования 1 мл эфира. Ориентировочно через 5 минут животных помещали в эксикатор объемом 8 литров, куда добавляли 2,0 мл 10% раствора формалина (0,25 мл / 1 л объема эксикатора). Через 5 минут животных извлекали и помещали в стандартные условия с естественной сменой освещения и соблюдением общевиварийного рациона. Животным серии №1 со 2 дня после моделирования пневмонии вводили ежедневно ксимедон в течение 7 дней в желудок однократно в дозе 15 мг/кг. Затем животных вводили в состояние наркоза путем ингалирования эфира и производили декапитацию с целью забора крови для определения соединений, которые вступают в реакцию с тиобарбитуровой кислотой и суммарной антиокислительной активности в сыворотке крови.
Нами были обследованы 69 детей школьного возраста (средний возраст составил 11,8±0,3 лет) с рентгенологически подтвержденным диагнозом внебольничной пневмонии. Среди обследованных мальчиков – 38 человек (55%), девочек – 31 человек (45%).
Критериями включения пациентов в исследование были следующие: возраст от 7 до 17 лет, наличие установленного клинико-рентгенологического диагноза внебольничной пневмонии, отсутствие противопоказаний к применению ксимедона.
Критерии исключения пациентов из исследования: возраст моложе 7 лет, неподтвержденный рентгенологически диагноз внебольничной пневмонии, наличие противопоказаний гематологического характера к применению ксимедона.
Дети были госпитализированы в стационар на 4-8 сутки от момента заболевания. При анализе анамнестических данных нами было отмечено, что из 69 исследуемых детей более 50% относились к группе часто болеющих детей и 21% ранее болели пневмонией, в том числе дважды.
При поступлении в стационар состояние детей было расценено как средней степени тяжести за счет признаков интоксикации, синдрома респираторных нарушений. При физикальном исследовании у 30% больных аускультативная характеристика проявлялась скудно либо типичные для пневмонии локальные влажные хрипы не прослушивались.
В комплекс лечебных мероприятий включали антибактериальную терапию (на амбулаторном этапе – аминопенициллины, в стационаре преимущественно назначали цефалоспорины 3 поколения, лишь отдельным пациентам в связи с аллергической реакцией или неэффективностью данных лекарственных препаратов назначали макролиды или аминогликозиды. У всех пациентов протокол антибактериальной терапии был практически идентичен. Также применялись дезинтоксикационные средства, муколитические препараты, физиотерапия и лечебная гимнастика.
В зависимости от вида лечения дети были распределены на 2 группы: группа №1 составила 37 человек, которым наряду с традиционной терапией внебольничной пневмонии со 2-го дня госпитализации назначали отечественный препарат пиримидинового ряда ксимедон в суточной дозе 15 мг/кг, разделенной на 3 приема, курсом 7 дней. Дети группы №2 в составе 32 детей получали лечение по традиционной схеме. Дети в исследуемых группах были сопоставимы по полу и возрасту.
При анализе клинической симптоматики выявлены особенности физикальных изменений в легких, а также показатели гемограммы.
В сыворотке крови пациентов и животных исследовали уровень малонового диальдегида (МДА) [7] и суммарной антиокислительной активности (АОА) [1].
Для оценки статистической значимости различий применяли непараметрические критерии Манна-Уитни и Вилкоксона при помощи программных пакетов Microsoft Excel и AtteStat. Выборочные параметры представлены как Ме [Q1; Q3] и имеют следующие обозначения: Ме-медиана, Q1-верхний квартиль, Q3-нижний квартиль, N-объем анализируемой группы, р - уровень значимости исследуемых показателей. Также вычислялись средняя арифметическая и стандартное отклонение.
Результаты и их обсуждение. Поскольку патогенезе механизмов развития воспалительных изменений в бронхо-легочной системе большое внимание уделяется процессам пероксидации [8]. Нами были изучены конечный продукт перекисного окисления липидов – малоновый диальдегид в присутствии тиобарбитуровой кислоты и суммарная антиокислительная активность в сыворотке крови животных и детей.
Результаты исследований представлены в табл. 1, 3.
Таблица 1. Уровень малонового диальдегида и суммарной антиокислительной активности в сыворотке крови молодых крыс
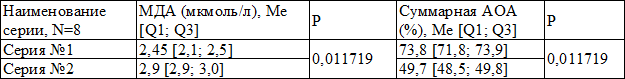
На фоне курсового введения крысам препарата ксимедон концентрация МДА составила 2,45 [2,1; 2,5] мкмоль/л, тогда как группе №2 (без применения ксимедона) этот показатель 2,9 [2,9; 3,0] мкмоль/л (p=0,011719). Суммарная АОА к завершению эксперимента (на 8-е сутки) в серии №1, получавших ксимедон в дозе 15 мг/кг курсом 7 дней составила 73,8 [71,8; 73,9], тогда как в серии №2, не получавшей данный препарат – 49,7 [48,5; 49,8] % (p=0,011719). При извлечении легких у всех животных в исследуемых сериях отмечались геморрагические очаги в обоих легких.
Синдром интоксикации в группе №1 у 80% детей купировался на 3 день, тогда как у 75% пациентов из группы №2 на 6 день стационарного лечения. Проявления синдрома интоксикации у 70% детей из группы №1 продолжались до 8 дня, а в группе №2 до 10 дня госпитализации.
В табл. 2 представлены физикальные параметры в легких у обследуемых детей, статистическая значимость различий между группами №1 и №2 оценивалась с помощью критерия Манна-Уитни.
Назначение ксимедона в комплексную терапию внебольничной пневмонии способствовало статистически значимому более раннему регрессу физикальных параметров в легких у детей группы №1.
Таблица 2. Физикальные параметры в легких у обследуемых детей

Примечание: * - уровень значимости 1 (≤0,01)
Таблица 3. Показатели МДА и суммарной АОА в сыворотке крови у детей школьного возраста с внебольничной пневмонией
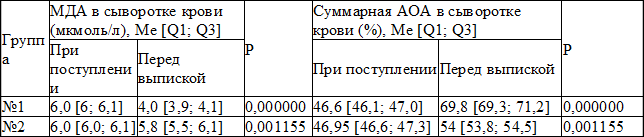
Уровень МДА к моменту выписки детей из стационара у детей группы №1 составил 4,0 [3,9; 4,1] мкмоль/л (p=0,000000), тогда как в группе сравнения 5,8 [5,5; 6,1] мкмоль/л (p=0,001155). Динамика суммарной АОА в сыворотке крови у пациентов, применявших ксимедон была существенно более выражена и достигала 69,8 [69,3; 71,2] % (p=0,000000) в отличие от детей группы сравнения, где показатель достигал 54,0 [53,8; 54,5] % (p=0,001155). И как видно из приведенных результатов данные высказывания имеют математическое подтверждение.
Заключение. Таким образом, проведенное нами экспериментально-клиническое исследование позволяет отметить выраженный эффект ксимедона на подавление процессов пероксидациин при моделировании формалинового отека легких у молодых крыс, у пациентов школьного возраста в составе комплексной терапии внебольничной пневмонии, а также на регресс основных клинических синдромов данного заболевания у детей. Назначение ксимедона в клинике не вызывало у детей побочных реакций, что также обуславливает перспективность его применения в педиатрической практике.
