Бронхолегочная дисплазия (БЛД) формируется преимущественно у недоношенных детей, имеет хроническое течение [1, 4, 9], занимает ведущее место в структуре заболеваемости и смертности новорожденных и грудных детей [6, 8]. Патологические процессы, развивающиеся в организме недоношенного ребенка, как правило, приводят к развитию оксидативного стресса (ОС) и дизрегуляции процессов на уровне межклеточного взаимодействия [2, 3]. Незрелость системы антиоксидантной защиты сопровождается риском повреждения тканей активными формами кислорода [14]. Применение искусственной вентиляции легких (ИВЛ) является жизненно необходимым, однако, вызывает неуправляемые процессы воспаления [16, 20]. Избыток активных форм кислорода (АФК) в сочетании с недостаточностью системы антиоксидантной защиты (АОЗ) вызывает повреждение ткани легкого и активацию воспалительных процессов [11, 12, 15, 17]. Воспаление легочных структур, вызываемое свободными радикалами, часто сочетается с бактериальным воспалением. Массивное повреждение альвеол, присоединение инфекции добавляет к асептическому воспалению инфекционный компонент, что стимулирует выброс провоспалительных цитокинов (ФНО-α, IL-1) [18]. В результате активации макрофагов увеличивается количество IL-1, который выступает в качестве одного из главных медиаторов в формировании местной воспалительной реакции и острофазного ответа при инфекционном поражении. Это, в свою очередь, посредством воздействия на Т-лимфоциты приводит к увеличению количества IL-4, что обеспечивает активность В-лимфоцитов и продукцию достаточного количества специфических антител [5, 10]. IL-4 ограничивает синтез макрофагами провоспалительных IL-1β, -6, -8, -12, TNF-α, образование высокоактивных метаболитов кислорода и азота.
Одним из основных ростовых факторов, приводящих к фиброзированию ткани легкого, является трансформирующий фактор роста β1 (TGF-β1), содержание которого в легких детей с БЛД повышено. Ответной реакцией на повышение синтеза TGF- β1 является увеличенное образование IL-4. [13, 19]. Все выше изложенное отражает разнообразие механизмов, посредством которых ОС ведет к повреждению легочной ткани, развитию бронхоспазма и вазоконстрикции, а также повышению проницаемости эпителия и эндотелия и усилению секреции слизи в дыхательных путях. Изучение оксидантной и антиоксидантной систем, особенностей баланса про- и противовоспалительных цитокинов у недоношенных детей с БЛД в грудном и раннем возрасте. Оценка данных показателей является актуальной задачей для диагностики, прогноза течения и формирования данного состоянии и формирования осложнений.
Цель работы. Определить иммунобиохимические маркеры воспаления и состояние оксидантной и антиоксидантной системы при бронхолегочной дисплазии у детей раннего возраста.
Материалы и методы исследования. В исследование включены 45 пациентов, находящихся на лечении в отделении раннего возраста Краевой детской клинической больнице (КДКБ), в возрасте от 1 до 4 мес. Все дети были разделены на 2 группы.
В 1 основную группу, вошли 25 детей (15 мальчиков и 10 девочек), имеющие бронхолегочную дисплазию в качестве основного диагноза и другие сопутствующие патологии (перинатальное поражение центральной нервной системы (ПП ЦНС) в 100% случаев, анемию у 23 (92%) детей, травму шейного отдела позвоночника (ШОП) у 6 (24%) детей, некротизирующий энтероколит у 6 (24%) детей).
Во 2 группу сравнения включены 20 детей (9 мальчиков и 11 девочек), без бронхолегочной дисплазии, с основным диагнозом перинатальное поражение центральной нервной системы и сопутствующей патологией (анемия у 19 (95%) детей, травма шейного отдела позвоночника у 11 (55%) детей, некротизирующий энтероколит (НЭК) у 6 (30%) детей).
Сравниваемые группы не имели статистических различий по гестационному возрасту, среднему возрасту, массе тела при рождении, оценке по шкале Апгар (Р>0,05) (табл. 1).
Таблица 1. Распределение больных по сроку гестации, возрасту, массе при рождении, оценке по шкале Апгар (М±SD)
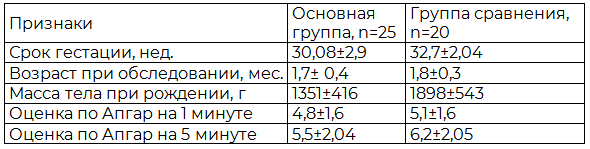
Примечание: *р – различия между группами при помощи критерия Стьюдента.
Так как во 2 группу сравнения вошли дети, не имеющие патологию органов дыхания, но имеющие другую патологию (перинатальное поражение ЦНС, травму ШОП, анемию, НЭК), дополнительно создана 3 группа сравнения, которую составили здоровые дети (n=14), средний возраст составил 5,3±1,3 лет, показатели которых расценивались как референтные.
Проведено исследование прооксидантной (ПОА) и антиоксидантной активности (АОА) сыворотки крови, по методу Маянского Д.Н. [7] , определено содержание про- (IL-1b, TNF-α) и противовоспалительных (IL -4) цитокинов, трансформирующего фактора роста β (TGF-β1) иммуноферментным методом с использованием коммерческих тест-систем «Протеиновый контур». Забор венозной крови проводился при поступлении ребенка в отделение патологии раннего возраста, не более 0,5 мл, что не превышало допустимую норму и не приводило к гиповолемии.
Статистическая обработка полученных данных проводилась с использованием компьютерных программ «Statistica-6.0», Microsoft Exсel 2010. Проверку на нормальность распределения статистических показателей проводили путем построения гистограмм в программе «Statistiсa-6.0», а также с использованием критерия Колмогорова-Смирнова. При соответствии данных нормальному распределению значения количественных признаков представляли в виде M±SD, где М – среднее значение количественного признака, SD – стандартное отклонение среднего. Различия между группами выявлялись при помощи критерия Х2, критерия Стьюдента. При ненормальном распределении количественных признаков данные представляли в виде Me (25-75 перцентили), где Ме – медиана. Использовались методы непараметрической статистики с применением U-критерия Манна–Уитни (сравнение двух независимых переменных). Различия считались статистически значимыми при р<0,05.
Результаты собственных исследований. В развитии воспалительных процессов в легких приоритетная роль принадлежит про- и противовоспалительным цитокинам, которые индуцируют процессы свободно-радикального окисления, дисбаланс в системе «протеолиз – антипротеолиз» и оксидативный стресс.
Как известно, провоспалительные цитокины (в частности, IL-1b и TNF-α) играют ключевую роль и определяют активность воспалительного процесса, при этом противовоспалительные цитокины (IL-4 и трансформирующий фактор роста-β (TGF-β1) участвуют в процессах репарации, в том числе за счет активации фиброгенеза.
Результаты исследования показали, что содержание провоспалительных цитокинов IL-1b и TNF-α в сыворотке крови (таблица 2) лиц контрольной группы (здоровые дети) в среднем составили 38,8 и 41,4 пг/мл, в то время как при БЛД 53 и 49,5 пг/мл соответственно, а у детей без БЛД 57 и 50,3 пг/мл. Вероятно, это обусловлено тем, что 2 группа детей не имела патологии органов дыхания, но у пациентов данной группы регистрировалась патология со стороны других органов и систем, что не исключало наличия воспалительного процесса. Скорее всего, это свидетельствует о неспецифическом характере выявленных изменений IL-1b и TNF-α. Содержание противовоспалительного цитокина IL-4 и трансформирующий фактор роста-β (TGF-β) в сыворотке крови здоровых детей контрольной группы и пациентов без патологии органов дыхания отличались друг от друга не значительно, однако в группе детей с БЛД эти показатели оказались в 2 раза выше.
Анализ результатов расчета индекса соотношения про- и противовоспалительных цитокинов (КС) выявил, что в сыворотке крови больных БЛД баланс про- и противовоспалительных цитокинов смещен в сторону противовоспалительного цитокина IL-4 (таблица 2), что может свидетельствовать о степени выраженности воспалительного процесса.
В патогенезе различных патологических процессов важную роль играют реакции свободно-радикального окисления (СРО), выраженность которых зависит от баланса «оксидантов и антиоксидантов». Результаты исследования показали, что у детей с БЛД заболевание сопровождается активацией процессов свободнорадикального окисления, о чем свидетельствуют высокие показатели ПОА (0,91 условных единиц, против 0,62 и 0,55 у детей в группах сравнения) сыворотки крови. В тоже время низкая АОА (4,69 условных единиц), что в 1,5 раза ниже, чем у детей без патологии органов дыхания и 2 раза ниже, чем у здоровых детей. Об этом же свидетельствует коэффициент соотношения КС, который увеличивается у детей с БЛД в 2 раза по сравнению с детьми без патологии дыхательной системы и в 3 раза по сравнению со здоровыми детьми (табл. 2).
Таблица 2. Содержание про- и противовоспалительных цитокинов в сыворотке крови и показатели антиоксидантной и прооксидантной активности (Ме (25-75 перцентили))
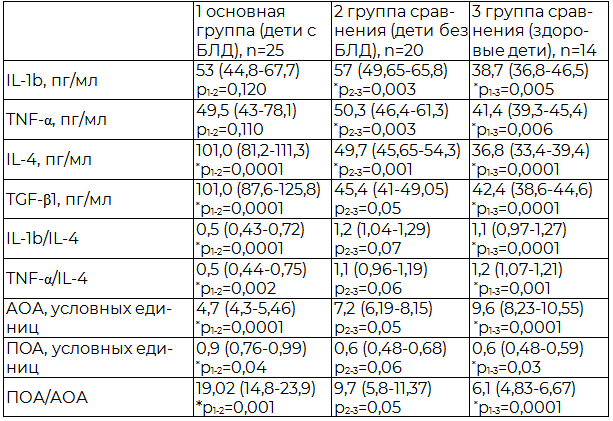
Примечание: *р - различия между группами выявлялись при помощи критерия Манна-Уитни.
На основании выше изложенного можно предположить приоритетные патогенетические механизмы в развитии фиброгенеза у пациентов с БЛД. Возможно, сначала происходит усиление прооксидантной активности сыворотки крови, повышение содержания провоспалительных цитокинов IL-1β и TNF-α и снижение антиоксидантной активности сыворотки крови, это лежит в основе острой фазы воспаления (данные изменения происходят в периоде новорожденности), затем наступает хроническая фаза воспаления, в которую происходит снижение про- и антиоксидантной и активности сыворотки крови и повышение содержания противовоспалительных цитокинов IL-4 и трансформирующего фактора роста-β TGF-β1. Что вероятно, приводит к изменению структуры стенки бронха и играет роль в развитии легочного фиброза.
Выводы
1. Течение бронхолегочной дисплазии у детей сопровождается дисбалансом в системе «ПОЛ-АОЗ».
2. У пациентов с БЛД наблюдаются высокие показатели прооксидантной и низкие - антиоксидантной активности.
3. Содержание про- (IL-1b, TNF-α) и противовоспалительных цитокинов (IL-4) и трансформирующего фактора роста-β (TGF-β) повышено у детей с бронхолегочной дисплазией, в сравнении со здоровыми детьми.
4. Баланс про- и противовоспалительных цитокинов смещен в сторону противовоспалительного цитокина IL-4 у пациентов с данной патологией.
