Введение. Проблема герпетических инфекций (ГИ) остается актуальной уже в течение длительного времени и не теряет своей актуальности в настоящий период. Это обусловлено повсеместной распространенностью вирусов семейства герпеса в человеческой популяции, морфологической разнородностью представителей семейства, особенностями взаимодействия вируса с иммунной системой человека, что определяет пожизненную персистенцию вируса в организме и склонность к реактивации на фоне различных иммуносупрессивных состояний, а также полиорганностью и неспецифичностью клинической картины, наличием различных клинических вариантов от нетяжелых малосимптомных и бессимптомных форм до тяжелых генерализованных процессов, сходных с течением сепсиса [1-7].
Является неоспоримой роль герпетических вирусов (ГВ) в формировании патологии перинатального периода. Среди врожденных инфекций цитомегаловирусная инфекция (ЦМВИ) занимает лидирующее положение [1-4,7].
Тяжелые формы ГИ в неонатальном периоде протекают с генерализацией инфекции по типу септических процессов. Частота возникновения врожденных менингитов и менингоэнцефалитов является достаточно высокой, это определяет формирование тяжелых неврологических последствий в дальнейшем. Лимфотропность ГВ обуславливает нарушения в становлении иммунной системы у детей раннего возраста, обуславливая возникновение вторичных иммунодефицитных состояний после перенесенной тяжелой инфекции [2-4,6,9].
Несколько иначе выглядит картина при бессимптомных и малосимптомных вариантах течения инфекции, обусловленной ГВ. Учитывая отсутствие специфических клинических проявлений, данные формы зачастую протекают под «масками» различных заболеваний и находят свое отражение в статистике в виде «отдельных состояний перинатального периода» и не подлежат четкой регистрации [2-4]. Этим обуславливается и сложность их диагностики, и несвоевременность назначения терапии.
По данным литературы известно, что высокий тропизм ГВ к нервной системе, раннее инфицирование и длительная персистенция в организме способны привести к морфологическим изменениям в нервной ткани в виде нарушения процессов миелинизации нервных волокон, преимущественно коры, демиелинизации, некроза отдельных нейронов, пролиферации глии. Кроме того, доказано влияние ГВ на состояние мозговых сосудов и снижение мозгового кровотока, что в свою очередь, может усугублять имеющиеся изменения головного мозга, обусловленные гипоксией другой этиологии [1,3,4,7,11].
В связи со всеми выше изложенными данными можно предположить негативное влияние этих возбудителей на нервно-психическое (НПР) и физическое развитие (ФР), а также резистентность детей первого года жизни при раннем инфицировании и длительной персистенции вируса в организме, что определяет необходимость разработки новых подходов к ведению детей из группы риска на первом году жизни.
Цель исследования – изучить показатели НПР, ФР и резистентности организма при раннем инфицировании (внутриутробное, интранатальное и постнатальное в первые три месяца жизни) герпетическими вирусами (цитомегаловирус (ЦМВ) и вирус простого герпеса 1 и 2 типа (ВПГ-1,2)) и определить тактику ведения данных пациентов на первом году жизни.
Материал и методы. В исследование включено 75 детей и их матерей, поступивших на лечение в отделение патологии новорожденных и недоношенных детей (ГБУЗ НО «Детская городская клиническая больница №1», главный врач – Н.В. Кисель).
В исследование были включены дети с гестационным возрастом более 30 недель, имеющие риск реализации внутриутробной инфекции (ВУИ) без специфических клинических признаков на момент поступления. Подозрение на врожденные пороки развития нервной системы, наследственную патологию, болезни обмена веществ, признаки токсико-метаболического или травматического поражения нервной системы, а также признаки ВУИ любой другой этиологии послужили критериями исключения из исследования.
Детям проведены: оценка жалоб и анамнеза путем анкетирования матери, анализа истории болезни и выписки из истории новорожденного; оценка соматического и неврологического статуса по стандартной методике; лабораторно-инструментальное обследование согласно стандартам лечения основного заболевания; исследование специфического гуморального иммунитета к ЦМВ и ВПГ-1,2 методом иммуноферментного анализа (ИФА) на наличие антител (АТ) классов IgM, IgG с определением авидности АТ класса IgG при поступлении в стационар и в динамике в 3, 6 и 12 месяцев, исследование биологических жидкостей (раздельно кровь, моча и ликвор по показаниям) на наличие дезоксирибонуклеиновой кислоты (ДНК) ЦМВ, ВПГ-1,2 методом полимеразной цепной реакции (ПЦР). Кровь матерей методом ИФА исследовалась однократно при поступлении ребенка в стационар.
Все дети после выписки из стационара находились под динамическим наблюдением в течение года с оценкой показателей ФР центильным методом, НПР по методике Пантюхиной Г.В., Печоры К.Л., Фрухт Э.Л., (1983 г.) [8], резистентности по количеству и тяжести перенесенных острых заболеваний на первом году жизни. Оценка ФР и НПР у недоношенных детей проводилась с учетом их скоррегированного возраста.
Результаты и обсуждение. Среди включенных в исследование детей преобладали мальчики – 57,3% (43 пациента; доношенными родились 64% (48 детей), 36% (27 пациентов) были недоношенными. Гестационный возраст детей колебался от 30 до 40 недель, в среднем составил 38,17±2,43 недель. У 12% (9 детей) отмечалась задержка внутриутробного развития, у остальных 66 пациентов (88%) показатели массы тела и роста при рождении соответствовали гестационному возрасту.
Анализ факторов риска данных анамнеза показал высокую частоту встречаемости факторов инфекционного характера. Чаще других в данной группе встречались: наличие патологии мочеполовых органов воспалительного характера у женщин и их обострение во время данной беременности (97,1% и 49,2% соответственно), эпизоды острых инфекционных заболеваний во время настоящей беременности (59,4%), синдром гиперандрогении (50,7%), длительный безводный период (56,5%), осложнения во время родов (60,9%).
Клинические проявления у детей отличались полиморфностью, полиорганностью и имели неспецифический характер. Среди клинических синдромов доминировали изменения со стороны нервной системы постгипоксического генеза (100%), при этом преобладали клинические проявления легкой степени (в 68%, 51 пациент), остальные дети имели поражение головного мозга средней степени тяжести (21,3%, 16 пациентов) и тяжелой степени (10,7%). На втором месте по частоте встречаемости регистрировалась патология со стороны сердечнососудистой системы. Так у 90,6% (68 пациентов) отмечалась малая аномалия развития сердца (дополнительная диагональная трабекула в полости левого желудочка). Открытое овальное окно было выявлено у 76% (57 пациентов), открытый артериальный проток – у 8% (6 пациентов). У 77,3% обследованных детей (58 пациентов) отмечалась неонатальная желтуха. Преобладали среднетяжелые формы (в 65% случаев). Затяжное течение желтухи отмечалось у 15 детей (26,3%). У 35% пациентов были диагностировано тяжелое течение желтухи. Но во всех случаях на фоне проводимой терапии удалось добиться быстрого снижения цифр билирубина и купирования клинических проявлений, клинических проявлений билирубиновой энцефалопатии не было отмечено ни у одного ребенка. Реже встречались проявления со стороны дыхательной системы, анемия различной степени тяжести, гепатопатия, нефропатия.
Изучение состояния специфического гуморального иммунитета к ЦМВ и ВПГ-1,2 у детей в период новорожденности проводилось в сопоставлении с аналогичными показателями у матерей.
Исследование состояния гуморального иммунитета у матерей при первичном обследовании детей показало высокую частоту встречаемости серопозитивных к ЦМВ среди женщин фертильного возраста. При этом регистрировалась высокая частота реактивации ЦМВИ к моменту родов (18,8% обследованных женщин).
При изучении состояния специфического гуморального иммунитета матерей к ВПГ-1,2 было получено, что большинство матерей – 87% (60 человек) являются серопозитивными к данному инфекционному агенту без признаков активации инфекции. Признаки реактивации латентной формы герпетической инфекции имели 5 матерей (7,2%), лишь 4 матери (5,8%) не имели антител к ВПГ-1,2.
Первичное исследование специфического гуморального иммунитета детей к ЦМВ показало, что наиболее часто выявляются специфические АТ класса Ig G с высокой авидностью. Серологические признаки первичной инфекции были зарегистрированы в единичных случаях (4%) и совпали с положительными результатами ПЦР исследования.
При изучении специфического гуморального иммунитета к ВПГ-1,2 при первичном обследовании у детей было установлено, что 88% (66 младенцев) имеют АТ класса Ig G с высоким показателем индекса авидности. Остальные 12% (9 пациентов) являются серонегативными к ВПГ-1,2. Признаков активного инфекционного процесса не было зарегистрировано ни у одного из пациентов. Также ДНК ВПГ-1,2 не был выделен ни в одном случае.
В дальнейшем изучение специфического гуморального иммунитета к ЦМВ и ВПГ-1,2 типа у детей проводилось в 3, 6 и 12 месяцев.
В зависимости от показателей специфического гуморального иммунитета к ВПГ-1,2 все дети были разделены на две группы. I группа включила в себя пациентов (9 детей; 12%), серонегативных при первичном обследовании. Во II группу вошли дети (66 пациентов; 88%), у которых при первичном обследовании определялись АТ к ВПГ-1,2 класса Ig G. Анализ динамики антителообразования к ВПГ-1,2 в I группе детей показал сохранение серонегативности в динамике к 3 месяцам жизни у всех пациентов. Во II группе детей, у которых при первичном обследовании были выявлены АТ класса Ig G, в динамике к 3 месяцам отмечалось, что у 5 пациентов отмечалась элиминация АТ к ВПГ-1,2, что свидетельствует об их материнском происхождении. Также снижение титра материнских защитных АТ отмечалось у 2 детей, у остальных 59 пациентов сохранялись АТ класса Ig G в прежнем титре. Динамика антителообразования к ВПГ-1,2 на первом году жизни показала постепенную элиминацию материнских антител из кровотока ребенка и увеличение доли серонегативных детей к 12 месяцам в обеих группах (100% детей I группы и 75,8% детей II группы).
Таким образом, из полученных данных серологического обследования видно, что у детей, не имеющих специфических проявлений герпетической инфекции в неонатальный период, в первые три месяца жизни не определяются лабораторные признаки течения активного инфекционного процесса, что свидетельствует об отсутствии легких субклинических и малосмптомных форм инфекции обусловленной ВПГ-1,2 типа.
Оценка антителообразование к ЦМВ в трех месячном возрасте показала увеличение частоты регистрации серологических признаков активности ЦМВИ по сравнению с периодом новорожденности: Ig класса M были выявлены у 14,7%, появление Ig класса G с низкой и переходной авидностью отмечалось у 4% обследованных детей. Обращает на себя внимание, что почти половина детей (32 пациента из 75 включенных в исследование, 42,6%), имеющих при первичном обследовании в период новорожденности высокоавидные Ig класса G, как правило, расцениваемые как материнские, в возрасте 3 месяцев имели серологические признаки активности инфекционного процесса.
По результатам оценки состояния специфического гуморального иммунитета к ЦМВ в возрасте 3 месяцев все дети были разделены на две группы. В I группу вошли дети, имеющие серологические признаки внутриутробного или раннего постнатального инфицирования (39 пациентов). Критерии включения в I группу: 1. наличие Ig М при первичном исследовании; 2. появление Ig М в динамике; 3. появление Ig G в динамике у ранее серонегативных детей; 4. снижение показателя авидности Ig G и появление Ig G с низким и переходным индексом авидности к 3 месяцам в динамике.
II группу составили дети, у которых не было зарегистрировано серологических признаков течения активного инфекционного процесса в первые три месяца жизни (36 пациентов). Критерии включения во вторую группу: 1. сохранение серонегативности; 2. сохранение в динамике Ig G с высоким индексом авидности; 3. сохранение в динамике Ig G с переходным индексом авидности при отсутствии тенденции к снижению индекса авидности в динамике в первые три месяца жизни.
В возрасте 6 месяцев реже регистрируются серологические признаки активной ЦМВИ; при этом обращает на себя внимание, что серологические признаки активного инфекционного процесса чаще обнаруживаются в группе детей с внутриутробной и ранней постнатальной инфекцией (30,8% детей I группы по сравнению с 22,2% во II группе). В возрасте 12 месяцев в I группе детей отмечается снижение частоты регистрации активной ЦМВИ (23,1%); во II группе выявляются единичные случаи позднего постнатального инфицирования (8,4%).
Оценка показателей НПР, ФР, резистентности и была проведена всем детям в возрасте 12 месяцев в 1-ой и 2-ой группе в зависимости от состояния специфического гуморального иммунитета при ЦМВИ. Оценка состояния здоровья детей в зависимости от состояния специфического гуморального иммунитета к ВПГ-1,2 типа не проводилась ввиду отсутствия субклинических форм инфекции, вызванной ВПГ-1,2 типа, в неонатальный и постнатальный в первые три месяца жизни период.
Оценка показателей НПР показала следующую достоверную зависимость (R=0,715; р=0,000). У пациентов I группы чаще встречалась задержка НПР по сравнению со II группой детей. Так у 25 детей (64,1%) I группы была выявлена задержка в развитии на 2 эпикризных срока, у 6 детей (15,3%) – на 3 эпикризных срока. Задержку в развитии на 1 эпикризный срок имели 4 пациента I группы (10,3%), и только у 4 детей (10,3%) на первом году жизни показатели НПР были в норме. При этом задержка в формировании речи была отмечена у 11 детей I группы (28,2%), у большинства пациентов (24 человека; 61,5% детей I группы) выявлялось отставание в формировании как речевых, так и двигательных навыков. Дети II группы в 47,2% случаев (17 пациентов) имели нормальные показатели НПР, у остальных 52,8% детей (19 пациентов) отмечалось отставание в формировании НПР на 1 эпикризный срок, при этом у 22,2% была зафиксирована задержка в формировании речи, у 30,6% детей выявлялось отставание речевых и моторных навыков. Грубых задержек в формировании НПР детей данной группы не было зафиксировано.
Большинство детей обеих групп имели нормальные показатели ФР (R=-0,239; р=0,038). В I группе ФР было средним гармоничным у 32 пациентов (82%), во II группе – у 22 пациентов (61,1%). Высокое развитие имели 4 пациента (10,2%) I группы. Остальные дети имели низкое ФР в виде гипотрофии: гипотрофию 1 степени имел 1 ребенок (2,6%), гипотрофию 2 степени – 2 пациента (5,2%). Во II группе детей дефицит массы тела 1 степени имело 3 пациента (8,3%), а 2 степени – 11 детей (30,6%). Полученные данные свидетельствуют, что инфицирование ЦМВ в первые три месяца жизни имеет меньшее влияние на показатели ФР.
Анализ резистентности детей показал достаточно высокую частоту заболеваемости в обеих группах детей (R=0,273; р=0,017). Так в 1 группе, включающей пациентов с внутриутробной и ранней постнатальной ЦМВИ, только 5,13% (2 пациента) болели менее 4 раз на первом году жизни, и их резистентность была расценена как высокая. 25,64% (10 пациентов) имели средние показатели резистентности, у остальных 69,23% (27 детей) показатели резистентности были низкими, дети болели чаще 6 раз на первом году жизни, эпизоды острых заболеваний имели тенденцию к затяжному течению, часто возникали осложнения, обусловленные наслоением вторичной бактериальной микрофлоры, требовавшие назначения антибактериальной терапии.
Во II группе детей, не имеющих серологических признаков внутриутробного и раннего постнатального инфицирования, отмечается больший процент детей с высокой резистентностью – 19,44% (7 пациентов). Средние показатели резистентности имели 36,12% (13 детей). Но также как и в первой группе детей, большую долю составляют дети с низкими показателями резистентности, 44,44% (16 пациентов).
Таким образом, анализ полученных нами данных подтвердил имеющиеся в литературе данные о негативном влиянии ЦМВ на иммунную систему детей раннего возраста. Дети с серологическими признаками внутриутробной и ранней постнатальной ЦМВИ достоверно чаще и тяжелее болели острыми заболеваниями по сравнению с детьми, не имеющими серологических признаков инфицирования в первые три месяца жизни.
Изучение факторов риска реализации ВУИ, особенностей становления специфического гуморального иммунитета к ГИ, а также анализ состояния здоровья ребенка на первом году жизни позволило нам определить современные подходы по ведению пациентов из группы риска по реализации ВУИ и/или с бессимптомными или малосимптомными вариантами инфекционного процесса (рис. 1).
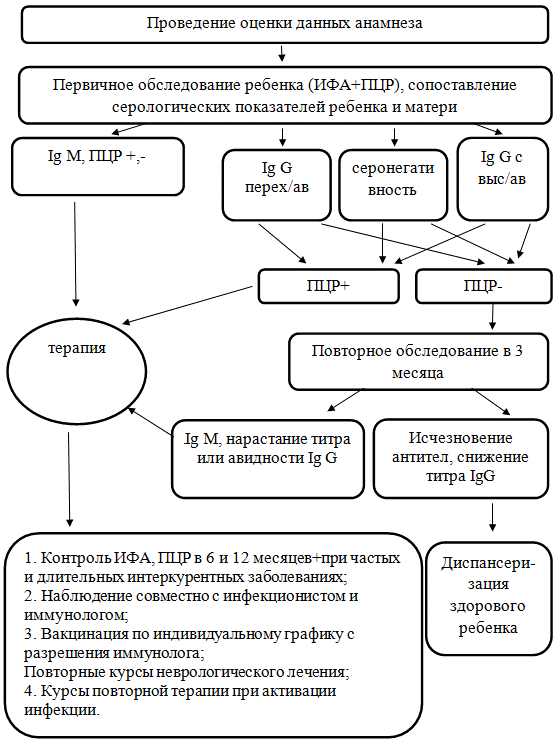
Рис. 1. Алгоритм ведения детей с риском реализации ВУИ на первом году жизни.
При проведении оценки данных анамнеза необходимо обращать особое внимание на наличие факторов риска инфекционного характера, таких как: наличие патологии мочеполовых органов воспалительного характера у матерей и ее обострение во время настоящей беременности, эпизоды острых инфекционных заболеваний во время беременности, синдром гиперандрогении, требующий приема кортикостероидов, обладающих иммуносупрессивной направленностью, длительный безводный период, осложнения во время родового акта, потребовавшие инвазивных вмешательств. При наличии данных факторов риска, даже при отсутствии специфических для ЦМВ или ВПГ-1,2 клинических проявлений, показано проведение обследования для уточнения характера инфекционного процесса у матери и ребенка.
Проведение первичного обследования должно включать в себя комплекс исследований, включающий изучение показателей серологии к данным инфекционным агентам и анализ различных биологических жидкостей (кровь, моча, ликвор по показаниям) на наличие ДНК возбудителей. Анализ данных серологии должен проводиться в сравнении с аналогичными показателями матери. Это обусловлено наличием в кровотоке ребенка материнских антител класса Ig G, перешедших трансплацентарно.
Наличие Ig класса М у ребенка или выделение ДНК возбудителей свидетельствуют о течении ВУИ, что требует проведения специфической терапии и дальнейшего пристального наблюдения за пациентом. Выделение Ig класса G с переходной или высокой авидностью и ДНК ЦМВ и/или ВПГ-1,2 хотя бы в одной из биологических жидкостей также свидетельствует о течении активной инфекции, определяя дальнейшую тактику – проведение специфической терапии и динамическое наблюдение на первом году жизни. Отрицательные же результаты анализа методом ПЦР при определении в серологии Ig класса G не позволяет судить об активности инфекционного процесса и требуют дальнейшего наблюдения и повторное исследования серологии в возрасте 3 месяцев. Появление серологических признаков активности инфекционного процесса в 3 месяца свидетельствует о раннем постнатальном инфицировании ребенка, определяя дельнейшую тактику ведения данного пациента как относящегося к группе риска по формированию нарушений в развитии и снижению резистентности. Отсутствие же признаков активности инфекционного процесса по данным серологии позволяет снять диагноз высокого риска реализации ЦМВИ, данный пациент не требует в дальнейшем дополнительного наблюдения.
Учитывая полученные нами данные о способности ЦМВ при раннем инфицировании (перинатальном и постнатальном до 3-х месяцев) вызывать задержу в формировании НПР, снижать уровень резистентности, то можно определить круг специалистов, наблюдение которых необходимо ребенку. Требуется наблюдение инфекциониста и продолжение серологического обследования для уточнения характера инфекционного процесса и оценки эффективности проводимой терапии. Также данным пациентам показано проведение серологического обследования и проведение ПЦР исследования при частых и/или затяжных острых инфекционных заболеваниях. Необходимо наблюдение иммунолога и проведение вакцинации по индивидуальному графику. Учитывая возможность ЦМВ к формированию вторичных иммунодефицитных состояний, вакцинация должна проводиться строго при отсутствии признаков активности инфекционного процесса, вызванного ЦМВ, в виду высокого риска развития реакций и осложнений вакцинации. Учитывая способность ЦМВ вызывать нарушения в формировании НПР, требуеться обязательное наблюдение невролога и повторные курсы нейрометаболической терапии на первом году жизни.
Выводы. Установлено отсутствие малосимптомных и бессимптомных форм инфекции, вызванной вирусом простого герпеса 1 и 2 типа, в неонатальном периоде и на первом году жизни, отсутствие негативного влияния данного инфекционного агента на показатели нервно-психического, физического развития и резистентности детей первого года жизни.
Доказано негативное воздействие раннего инфицирования (внутриутробного, интранатального и постнатального в первые три месяца жизни) цитомегаловирусной инфекцией на показатели здоровья детей на первом году жизни.
Выявлена достоверная зависимость нарушений нервно-психического развития и резистентности от раннего инфицирования (внутриутробного, интранатального и постнатального в первые три месяца жизни) и активности инфекционного процесса, обусловленного цитомегаловирусной инфекцией, у детей на первом году жизни.
Обоснована тактика ведения детей на первом году жизни с риском реализации внутриутробной или ранней постнатальной цитомегаловирусной инфекции, а также с малосимптомными клиническими проявлениями цитомегаловирусной инфекции в неонатальном периоде, определены показания для проведения лечения в зависимости от варианта течения инфекционного процесса.
