Введение. Болезни органов дыхания, по данным официальной статистики, занимают одно из ведущих мест в структуре общей заболеваемости детей. Одной из актуальных проблем клинической педиатрии и детской пульмонологии на современном этапе по-прежнему остается проблема бронхообструктивного синдрома (БОС) у детей грудного возраста [3]. Под маской БОС протекает множество заболеваний и состояний, таких как бронхит, бронхиальная астма, бронхолегочная дисплазия (БЛД), врожденные пороки развития (ВПР) бронхо-легочной системы (трахеобронхомаляция, трахеобронхомегалия, пороки развития легкого и др.), муковисцидоз, аспирационный синдром, инородное тело и т.д. [4]. Существование такого широкого спектра заболеваний, протекающих с БОС, уже само по себе затрудняет постановку диагноза[1]. На сегодняшний день не существует четких критериев диагностики разновидности БОС в раннем возрасте, так как ни один из клинико-анамнестических признаков в отдельности не является достоверным [5].
В настоящее время все большее распространение в медицине получают компьютерные технологии. Известны различные математические способы обработки информации, одним из которых являются искусственные нейронные сети, имитирующие работу человеческого головного мозга, которые могут применяться для диагностики и дифференциальной диагностики заболеваний в детской пульмонологии [1,2].
Цель исследования: оптимизировать диагностику заболеваний, протекающие под «маской» бронхообструктивного синдрома у детей грудного возраста с использованием метода нейросетевого анализа.
Пациенты и методы. Проведен анализ 352 случаев БОС у детей грудного возраста с бронхообструктивным синдромом. Все дети с бронхообструктивным синдромом были разделены на две группы: обучающая группа (230 детей), и контрольная (тестируемая) группа (122 детей).
В обучающую группу включены дети в возрасте от 1 до 12 мес., и выделены 4 класса: 1 класс (46 детей) – «БОС на фоне отягощенного аллергологического анамнеза», 2 класс (166 детей) – «БОС на фоне неотягощенного аллергологического анамнеза», 3 класс (6 детей) – «БОС на фоне врожденных пороков развития (ВПР)», 4 класс (12 детей) – «БОС на фоне бронхолегочной дисплазии (БЛД)».
Контрольную группу составили 122 ребенка в возрасте от 1 до 12 мес, в нее вошли больные дети, поступившие в стационар с диагнозом острый бронхит с обструкцией (J20.9).
Стартовое обучение классификатора нейронной сети проводилось на примерах обучающей группы, клинико-анамнестические данные для которых были взяты из историй болезни пациентов с уже подтвержденным диагнозом. Таким образом, набор входных параметров отражал полное клиническое обследование пациента в условиях специализированного отделения. С помощью обученной программы нейросети проводилось тестирование контрольной группы. При постановке задачи для обучения нейросетей мы исходили из того, что экспертная система должна выбирать один из предполагаемых классов (диагнозов) из заданного набора (4 классов) на основании 60 параметров (данные анамнеза, клинической, рентгенологической картины) пациента. Для эксперимента была создана нейронная сеть с четырехклассовым классификатором, который решает задачу и выдает в качестве ответа 1 диагноз из 4.
Для создания компьютерной экспертной системы дифференциальной диагностики варианта бронхообструктивного синдрома у детей грудного возраста использовался нейросетевой модулятор Panalyzer 2000, разработанный Д.А. Россиевым [2]. Программа работает с показателями таблиц баз данных Microsoft Access и генерирует отчеты в Microsoft Excel.
Перед нейронной сетью были поставлены задачи:
1. Проведение оценки значимости входных параметров и минимизация их набора: данные анамнеза, объективного обследования, результатов выполненных на момент поступления инструментальных методов исследования,
2. Проведение дифференциальной диагностики заболеваний, протекающих с БОС, с помощью нейросетевых экспертных систем.
Результаты и обсуждение. Для осуществления первой задачи проведен анализ значимости 60 входных параметров отдельно для каждой из нейросетей, затем по каждому параметру подсчитывалась сумма относительных показателей значимости, которая выдавалась каждым экспертом нейросети. Параметр, набравший минимальную сумму, считался наименее значимым и исключался из обучения (у всех нейросетей закрывались входные синапсы, соответствующие этому параметру).
В первом блоке данных, важных практически для всех нейросетей, находятся такие параметры, как данные анамнеза болезни, анамнеза жизни. В число более значимых входных параметров нейросеть (эксперт) выделила основные сведения о перенесенных заболеваниях/состояниях в анамнезе у детей с БОС: «Искусственная вентиляция легких (ИВЛ) в первые сутки жизни» 0,12 баллов и отмечалось у 12 (0,05%) детей; длительность «ИВЛ 28 дней и более» 0,19 баллов и встречалось у 7 (0,03%) детей; перенесенные «пневмония» 0,14 баллов у 16 (0,07%) детей и «острый бронхиолит» 0,12 баллов у 9 (0,04%) детей, «Острая респираторная вирусная инфекция более 2-х эпизодов» 0,09 баллов у 32 (13,9%) детей; «число эпизодов БОС более 2-х раз» в анамнезе - 0,11 баллов у 22 (9,8%) детей (рис.1).
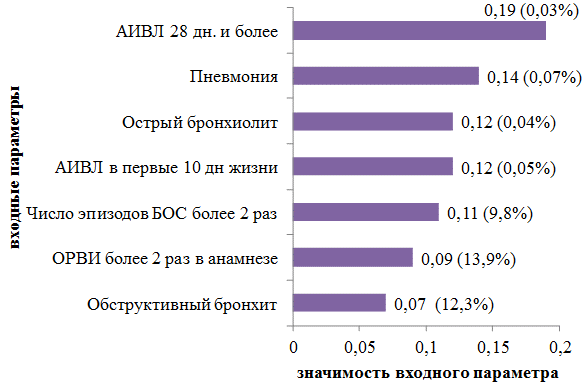
Рис. 1. Диагностическая значимость перенесенных заболеваний бронхолегочной системы у детей грудного возраста с БОС.
Второй блок данных составили сопутствующие заболевания пациента и его ближайших родственников. Наиболее значимые сопутствующие заболевания и отягощенный аллергоанамнез у детей с БОС: «аллергический дерматит» 0,29 баллов регистрировался у 43 (18,9%) детей; «острая крапивница, отек Квинке» 0,22 балла в анамнезе отмечались у 9 (4,1%) детей; «ВПС» 0,17 баллов встречался у 11 (4,9%) детей; «бронхиальная астма (БА) у родственников I линии» 0,13 баллов и встречалась у 13 (5,7%) детей; «деформация грудной клетки» 0,09 баллов отмечалась у 4 (1,6%) детей; такие параметры как «аллергический ринит», «БА у родственников II линии», «аллергические заболевания у родственников I линии» в экспертной системе так же составили 0,09 баллов по шкале значимости (рис. 2).
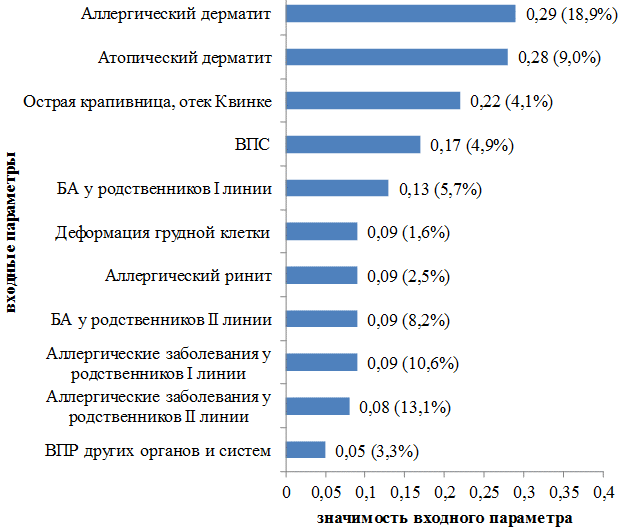
Рис. 2. Диагностическая значимость сопутствующих заболеваний и отягощенного аллергоанамнеза у детей с БОС.
Третий блок данных составили наиболее значимые факторы риска у детей с БОС: «аллергические заболевания матери во время беременности» 0,15 баллов встречались у 4 (1,6%) детей; «выкидыши в анамнезе у матери» 0,14 баллов – у 13 (5,7%) детей; «угроза выкидыша у матери в I триместре» 0,12 баллов – у 45 (19,7%) детей; «вес при рождении менее 1000 гр.» 0,11 баллов отмечался у 6 (2,5%) детей; «простудные заболевания матери во время беременности» 0,07 баллов – у 32 (13,9%) детей. По 0,06 баллов составили такие факторы риска как: «курение матери» 49 (21,3%), «недоношенность ребенка» 47 (20,5%) детей, «дефицит массы тела» регистрировался у 39 (17,2%) детей (рис.3).
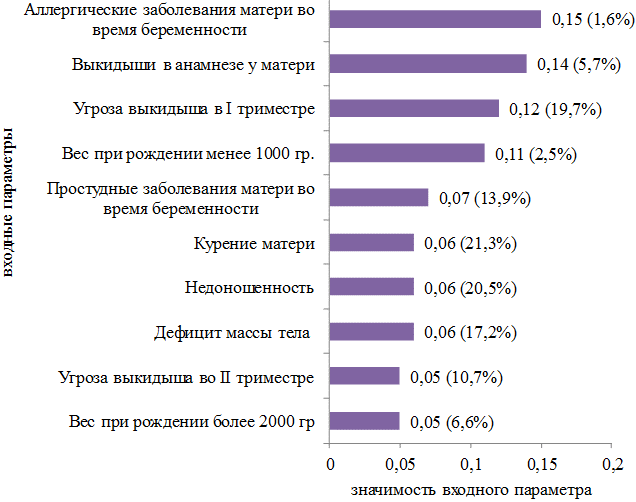
Рис. 3. Диагностическая значимость факторов риска развития БОС у ребенка грудного возраста.
В результате проведенного анализа выделены наиболее значимые критерии диагностики: наличие в анамнезе у ребенка перенесенных заболеваний бронхолегочной системы (пневмонии, бронхиты, бронхиолиты), проведение ребенку ИВЛ в первые сутки жизни, длительность ИВЛ 28 дней и более; отягощенный личный и семейный аллергоанамнез; среди факторов риска можно выделить аллергические заболевания матери во время беременности, выкидыши у матери, угроза прерывания беременности у матери в I триместре, очень низкая масса тела при рождении, недоношенность ребенка, курение матери.
С целью проведения дифференциальной диагностики заболеваний, протекающих с БОС, были выделены две группы детей обучающая (n=230) и контрольная (n=122). Для обучения нейросетей мы исходили из того, что экспертная система должна выбирать один из предполагаемых классов (диагнозов) из заданного набора (4 класса) на основании 60 параметров пациента. Для эксперимента была создана экспертная система - четырехклассовый классификатор, состоящий из 3 нейросетей-классификаторов (эксперт 1, эксперт 2, эксперт 3), который решает задачу и выдает в качестве ответа один диагноз из четырех и имеет следующие параметры:
- число нейронов - 4;
- время отклика – 3 такта функционирования;
- нейросеть имеет характеристику 0,1;
- входные данные – 60 параметров пациента;
- ответ – один из предполагаемых диагнозов из заданного набора (4 диагноза).
При работе экспертной системы в тестировании каждого примера принимали участие три эксперта одного четырехклассового классификатора, которые в результате голосования выдавали одно решение.
Интерпретация результатов проводилась с помощью нейросети где в качестве ответа, определялся номер выходного нейрона, который выдавал наибольший сигнал и для каждого диагноза устанавливался вес, величина которого складывалась из сигналов нейронов всех сетей, причем именно тех нейронах, которые были ответственны за данный класс (диагноз). В итоге мы получали 4 числа, показывающих суммарный вес каждого диагноза. Диагноз, набравший наибольший вес и выданный всеми 3 экспертами консилиума, на основании ответов нейронов, считался окончательным ответом системы.
Таблица 1. Результаты теста экспертной системы на примерах контрольной выборки
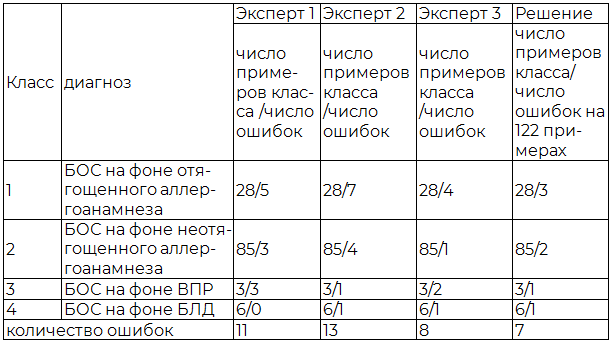
Примечание: нейросеть (с характеристикой 0,1); БОС – бронхообструктивный синдром, ВПР – врожденный порок развития, БЛД – бронхолегочная дисплазия.
В результате интерпретации ответов нейросетевого консилиума были получены следующие результаты: общее количество ошибок, допущенных нейросетью (экспертом) 1 равно 11; нейросетью (экспертом) 2 равно 13; нейросетью (экспертом) 3 равно 8 (табл. 1). Большинство примеров, на которых нейросеть делала ошибки, были одни и те же для всех экспертов. В этом случае, результат работы эксперта интерпретировался после решения консилиума. Общее количество ошибок, допущенных нейросетевым консилиумом, равно 7.
Тестирование созданной экспертной системы показало достаточно высокую прогностическую способность (94%) на примерах, не входящих в обучающую выборку. Наиболее точно нейросистема диагностирует БОС на фоне БЛД и ВПР. При анализе ошибки, по данным проведенного тестирования, для нейросетевой системы представлял определенные трудности дифференциальный диагноз между бронхообструктивным синдромом на фоне отягощенного и неотягощенного аллергологического анамнеза.
Таким образом, с помощью искусственных нейронных сетей может проводиться дифференциальная диагностика контрольной выборки и выявляться наиболее значимые диагностические параметры и факторы риска. Полученные данные подтверждают высокую значимость подробного анамнеза и течения заболевания, по сравнению с данными лабораторных и инструментальных методов исследования. Созданная экспертная система может быть использована для оптимизации дифференциальной диагностики различных вариантов бронхообструктивного синдрома у детей грудного возраста в сложных диагностических случаях.
