Метаболический синдром (МС) является одной из приоритетных и социально-значимых проблем современной медицины. Растущая распространенность ожирения у детей и подростков, высокая частота нарушений углеводного и жирового обмена, а также обусловленные этим высокие риски кардиоваскулярной патологии обусловливают необходимость изучения метаболического синдрома в этой возрастной группе [1-6]. Одним из компонентов МС является артериальная гипертензия (АГ). АГ при метаболическом синдроме развивается при гиперактивации ренин-ангиотензин-альдостероновой системы (РААС). Ее гиперактивация запускает «альдостероновый «механизм повышения артериального давления, что приводит в конечном счете к гломерулосклерозу [12]. Самым распространенным методом, визуализирующим органы мочевой системы, является ультразвуковое исследование. Однако ультразвуковое исследование (УЗИ) при гломерулопатиях, когда нет процесса склерозирования почечной паренхимы, недостаточно информативно. Больше информации дает допплеровское исследование сосудов почек [7-11], а также современный метод диагностики - эластография. Эластичность ткани может быть рассчитана, исходя из скорости распространения сдвиговых волн. В результате действительная эластичность ткани исследуемой области, выраженная в килопаскалях, отображается с помощью цветового картирования, наряду с обычной визуальной информацией в виде В-изображения. Карта с цветовым кодированием демонстрирует плотную ткань, характеризующуюся высокими показателями в килопаскалях, в красной цветовой гамме. Мягкая ткань с низкими показателями в килопаскалях (кПа) изображается в голубой цветовой гамме [8].
Целью исследования явилось изучение особенностей состояния паренхиматозного слоя почек у детей, страдающих ожирением и метаболическим синдромом, методом соноэластографии сдвиговых волн.
Материалы и методы. На базе педиатрического отделения №1 ОГБУЗ «Детская клиническая больница» были обследованы 42 ребенка в возрасте от 11 до 17 лет. Все пациенты были разделены на три группы. Первая группа - дети с метаболическим синдромом (абдоминальное ожирение + артериальная гипертензия + дислипидемия) (n=14), вторая группа - дети с ожирением (n=16). В контрольную группу вошли дети 2-й группы здоровья с нормальной массой тела (n=12), не имеющие патологии мочевыделительной системы. У всех обследованных детей оценивали клинико-анамнестические данные, проводился общий и биохимический анализы крови с определением параметров липидного и углеводного обменов, протромботического статуса, определение функции почек по пробе Зимницкого, скорости клубочковой фильтрации расчетным методом по формуле Шварца, пероральный глюкозотолерантный тест, определение микроальбуминурии (тест-система Микроальбуфан), проведение суточного мониторирования артериального давления (СМАД). Ультразвуковое исследование почек проводилось при помощи цифровой ультразвуковой портативной системы АНГИОДИН-Соно/П-Ультра (НПФ «БИОСС», Россия) в положении больного лежа на животе. Исследование включало: В режим с оценкой размеров, расположения, контуров почек; режим энергетического допплера и эластографию паренхиматозного слоя почек в 6 точках электронным конвексным датчиком 3-6 МГц по методике сдвиговых волн с оценкой среднего показателя в кПа (рис. 1).
Рис. 1. Точки эластометрии паренхимы почек.
Дети 1-й, 2-й и контрольной групп были однородными по полу и возрасту. Статистическую обработку данных проводили с использованием пакетов прикладных программ Microsoft Excel 2000 и Statistica 7.
Результаты. При оценке антропометрических показателей была выявлена тенденция (p>0,05) к более высоким показателям массы тела в группе детей с метаболическим синдромом (93,17±19,13 кг) по сравнению с детьми с ожирением (89,75±14,77 кг). Аналогичная тенденция отмечена и относительно показателей индекса массы тела, который в первой группе составил 32,54±4,98 кг/м2 против 30,93±3,1 кг/м2 во второй группе.
При оценке углеводного обмена в группе детей с метаболическим синдромом регистрировался один случай выявления показателей сахара крови, соответствующего нарушенной гликемии натощак. В целом различий по уровню гликемии у детей 1-й и 2-й групп получено не было: средние показатели гликемии натощак в первой группе составили 5,5±0,64 ммоль/л, во второй группе - 5,27 ±0,41 ммоль/л.
Анализ показателей липидного спектра выявил достоверное повышение триглицеридов у детей с метаболическим синдромом по сравнению с детьми с ожирением: показатель триглицеридов в первой группе составил 1,58±0,08 ммоль/л против 1,01±0,03 ммоль/л у детей с ожирением. Показатели средних уровней общего холестерина (ОХ), ОХ ЛПВП, ОХ ЛПНП, коэффициента атерогенности достоверных различий не имели.
По результатам СМАД у всех детей 1-й группы регистрировалась артериальная гипертензия (АГ): у 10 детей - лабильная (71,4%) и у 4 детей - стабильная (28,6%). АГ у всех детей с метаболическим синдромом была 1 степени, высокого риска.
По результатам эластографии (табл. 1) были выявлены достоверные различия эластичности почечной паренхимы между детьми с метаболическим синдромом и детьми с ожирением, а также между детьми с метаболическим синдромом и детьми контрольной группы. Показатель эластичности почечной паренхимы у детей с ожирением имел тенденцию к повышению (p>0,05) по сравнению с детьми контрольной группы.
Таблица 1. Показатели эластичности почечной паренхимы по данным эластографии у обследованных детей

Примечания: * - достоверность различий (р<0,05) между детьми с МС и детьми контрольной группы; ** - достоверность различий (р<0,05) между детьми с МС и детьми с ожирением.
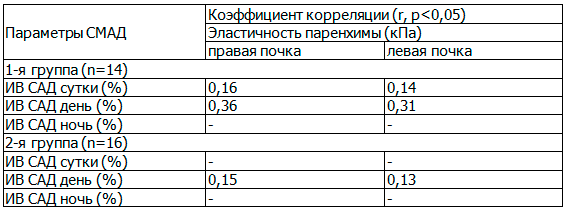
Проведенный корреляционный анализ между параметрами СМАД (индексом времени систолического АД (ИВ САД (%)) и эластичностью паренхимы почек (кПа) по данным эластографии выявил наличие достоверной слабой прямой корреляционной связи между ИВ САД (день) и эластичностью паренхимы почек у детей с метаболическим синдромом (табл. 2). При этом у детей с ожирением такая корреляционная связь была очень слабой.
Таблица 2. Корреляционная связь между параметрами СМАД и эластичностью почек по данным эластографии у детей 1-й и 2-й групп
Выявленные изменения показателей эластичности почечной паренхимы у детей с метаболическим синдромом могут свидетельствовать о вазоспазме на капиллярном уровне (клубочки почек), что в последующем может сопровождаться ремоделированием их сосудистой стенки, в том числе и на фоне системного повышения артериального давления. Это усиливает риск формирования порочного круга: ишемия паренхимы почек и активация юкста-гломерулярного аппарата ↔ сохранение и усиление артериальной гипертензии.
Выводы
- С учетом полученных данных эластография сдвиговых волн является информативным неинвазивным методом оценки состояния микроциркуляторного русла почек у детей.
- Выявленные структурно-функциональные изменения со стороны почек у детей с артериальной гипертензией на фоне ожирения требуют назначения корригирующей метаболической терапии: эндотелиопротекторные препараты; препараты, улучшающие микроциркуляцию.
