Всё большую роль в структуре респираторных заболеваний у детей различного возраста, в том числе и при внебольничных пневмониях, играют роль атипичные микроорганизмы Chlamydophila pneumoniae (Chl. pneumoniae), Mycoplasma pneumoniae (M. pneumoniae) от 6,2 до 50% [4,11]. Важно, что атипичные возбудители могут персистировать, являясь условно-патогенной флорой верхних дыхательных путей и, при определённых обстоятельствах становиться активным инфекционным агентом, например, при контакте с вирусной инфекцией [7]. В то же время, несмотря на определённые успехи, достигнутые в диагностике этих инфекций, открытии важных патогенетических звеньев, полученных данных о формировании аутоиммунных заболеваний, до сих пор существуют мало изученные вопросы о схемах и продолжительности курса антибактериальной, иммуномодулирующей терапии, а так же противорецидивной эффективности немедикаментозного восстановительного лечения.
В связи с тем, что в последние годы отмечается существенное ухудшение в состоянии здоровья детей, перенёсших Chl. pneumoniae, M. pneumoniae с тенденцией к хронизации, актуальным является развитие и внедрение восстановительных методов в комплексную терапию у детей, перенёсших эти инфекции.
Цель исследования. Для предупреждения рецидивирования и хронизации течения респираторной хламидийной и микоплазменной инфекций, а так же формирования и утяжеление течения бронхиальной астмы (БА) у детей, перенёсших Chl. pneumoniae, M. pneumoniae разработать схемы длительного медикаментозного и немедикаментозного лечения.
Материал. Работа проводилась на базе Центра восстановительного лечения (далее ЦВЛ) для детей с аллергологическими заболеваниями Московского административного района (Санкт-Петербургское государственное бюджетное учреждение здравоохранения Детская городская поликлиника №35) и СПб ГБУЗ ДГП №35. В исследование включили 417 детей (от 2 до 17лет 11 месяцев 29 дней), направленных на консультацию к пульмонологу/аллергологу, а так же детей, наблюдавшихся инфекционистом и педиатром по поводу длительного кашля (продолжительностью более 3, но менее 8 недель [20]), не поддающегося симптоматической противокашлевой терапии. У 197 пациентов с диагностировали респираторную хламидийную и/или микоплазменную инфекции и распределили по следующим группам:
I группа - 47 детей, терапия проводилась только антибактериальными препаратами с неадекватной длительностью курса лечения (общая продолжительность от 3 до 5 дней). Пациенты получали терапию по назначению участковых педиатров СПб ГБУЗ ДГП №35.
II группа - 45 детей, наблюдались в кабинете инфекциониста СПб ГБУЗ ДГП №35. Дети получали пролонгированный курс антибактериальной терапии и иммуномодулирующее лечение.
III группа - 105 детей, наблюдались у пульмонолога/аллерголога ЦВЛ. Пациенты данной группы получали пролонгированный курс антибактериальной терапии, иммуномодулирующее и немедикаментозное восстановительное лечение.
Методы. Анамнестические данные получены при опросе пациентов, родителей, анализе всей предоставленной медицинской документации. Состояние пациентов оценивалось в динамике (длительность катамнеза не менее 1 года). Иммунологическое обследование II и III групп включало определение иммуноглобулинов (Ig): общего IgЕ (тест системы «Алкор-био»); IgA, IgM, IgG в сыворотке крови к Chl. pneumoniae, M. pneumoniae, Cytomegalovirus, титра антител к коклюшу и паракоклюшу (тест-системы ЗАО “Вектор-Бест”, Новосибирск). Молекулярная диагностика: выделение ДНК патогенов (Chl. pneumoniae, M. pneumoniae, Cytomegalovirus) из браш-биоптатов слизистой носоглотки методом полимеразной цепной реакции (ПЦР) (наборы «АмплиСенс», Россия). В III группе проводилось функциональное обследование: спирография (спирограф Micro Medical Limitid, Еngland), бронходилятационный тест с ß2 агонистом (200 мг сальбутамола), ингаляционный проверочный тест (ИПТ) с возрастающими концентрациями гипертонических растворов NaCl на аппарате PARI Master Провотест II, результаты которого оценивали в баллах (0,9% - 7 баллов, 1,8% - 6 баллов, 3,6% - 5 балла, 7,2% - 4 балла, 14,4% - 3 балла, 28,8% - 2 балла, 57,6% - 1 балл - эмпирическая величина, использовалась для статистических расчётов, при отрицательных результатах предыдущего разведения).
Терапия хламидийной и микоплазменной инфекций проводилась во II и III группах азитромицином в дозе 10 мг/кг 1 раз в сутки раз в сутки 7 дней, затем 10 мг/кг 1 раз в сутки на 14, 21, 28 дни. В I группе схема антибактериальной терапии отличалась (общая продолжительность от 3 до 5 дней).
Бронхообструктивный синдром купировали по рекомендованным схемам: ингаляции через небулайзер растворов беродуала +будесонид, дозу препаратов подбирали индивидуально. В ряде случаев применяли симбикорт (будесонид+форматерол).
Детям с затяжным и рецидивирующим течением бронхообструктивного синдрома, с клинически выявленной высокой степенью неспецифической гиперреактивностью бронхов (НГРБ), проводили противовоспалительную (противорецидивную) терапию будесонидом и/или антилейкотриеновым препаратом.
Противомикробную, противовоспалительную терапию назначали в сочетании с иммуномодулирующими препаратами (циклоферон, виферон по рекомендуемым схемам) и восстановительным лечением (табл. 1).
Таблица 1. Комплексная программа немедикаментозного лечения детей
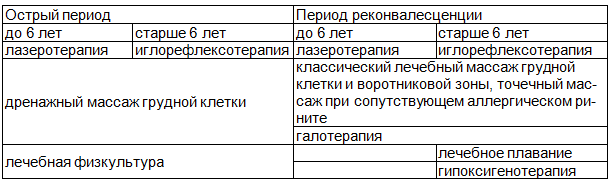
Обоснованность включения методов восстановительного лечения объясняется противовоспалительным, бронхолитическим, иммуномодулирующим и др. механизмами, представленными ниже, широко изученных как отечественными, так и зарубежными авторами.
Иглорефлексотерапия:
- повышает уровень циклического аденозинмонофосфата (цАМФ) в плазме крови, снижает чувствительность слизистых к аллергенам (по результатам эндоназального провокационного теста) [5];
- снижает чувствительность бронхов к неспецифическим стимулам (проверочный тест с гистамином, метахолином, разведения NaCl);- повышает миграционную активность макрофагов [9,16], усиливает фагоцитоз [13];
- увеличивает активность диаминоксидазы, моноаминоксидазы, что приводит к уменьшению содержания гистамина и серотонина в плазме крови [7,17];
- повышает чувствительность β2-адренорецепторов (увеличивается количество эндогенного адреналина, глюкокортикоидов, что приводит к активации β2-адренорецепторов, повышая, таким образом, уровень цАМФ) [1,7,17];
- снижает чувствительность афферентных рецепторов; увеличивает выделение эндогенных морфинов и нейропептидов специфическими нейронами; снижает чувствительность М1-холинорецепторов и Н1-рецепторов; блокирует прохождение афферентных импульсов на уровне желатинозной субстанции боковых рогов спинного мозга; повышает свободного кортизола и адренокортикотропного гормона (АКТГ) в плазме крови [5, 9, 16, 17].
Галотерапия:
- снижает НГРБ (тренирующий эффект на уровне афферентных рецепторов) [2];
- восстанавливает количество натрия хлорида в бронхиальном секрете до уровня, необходимого для нормального функционирования реснитчатого эпителия бронхов [14];
- предотвращает развитие и прогрессирование воспалительного процесса (бактерицидное и бактериостатическое действие) [12].
Лечебные эффекты нормоборической гипоогсигенотерапии реализуются через следующие механизмы:
- улучшает микроциркуляцию, проявляющееся увеличением количества капилляров в единице объема ткани и повышением кислород транспортной функции крови с увеличением способности гемоглобина связывать кислород в легких и отдавать его периферическим тканям [3, 9];
-повышает количество антителпродуцирующих клеток и синтеза иммуноглобулинов и фагоцитарную активность лейкоцитов, синтез лизоцима и других неспецифических факторов защиты [8, 10];
- активизирует антиоксидантную систему, на фоне которой снижается перекисное окисление липидов в мембранах клеток, что предупреждает патологическое повышение проницаемости мембран и нарушение работы ферментных систем в клетках [8,15].
Результаты собственных исследований. Для выявления причин длительного кашля, детям проведено многопрофильное обследование. Из 417 обследованных на носительство M. pneumoniae, Chl. pneumoniae детей у 197 пациентов (48%) с диагностировали респираторную хламидийную и/или микоплазменную инфекции. Для повышения достоверности диагностики использовали не менее двух методов исследования из-за возможности получения ложноотрицательных или ложноположительных результатов. При этом для диагностики достаточно одного из методов (желательно подтвержденного в динамике) при наличии характерной клинической картины.
Причины длительного кашля у 220 детей, без выявленных M. pneumoniae или Chl. pneumoniae, следующие: коклюш у 35 детей (16%), паракоклюш - 23 (10,4%), цитомегаловирусная инфекция - 25 (11,4%), вирус эбштейн-барра - 6 (2,6%), герпес-вирус 1-2 типов - 11 (5%), аденоидит - 30 (13,6%), респираторный тик - 1 (0,6%), заболевания нижних дыхательных путей: трахеобронхит 30 детей (13,6%), бронхит с обструктивным синдромом - 12 (5,4%), обострение БА - 47 (21,4%).
Оценка результата терапии в I, II и III группах основывалась на анализе динамики кашлевого синдрома (рис. 1), сборе катамнеза по количеству острых респираторных инфекций (ОРИ) (рис. 2). В III группе дополнительно оценивали ИПТ с NaCl (в баллах), основные показатели спирографии. У больных I и II группы не проводили спирографию и ИПТ с NaCl.
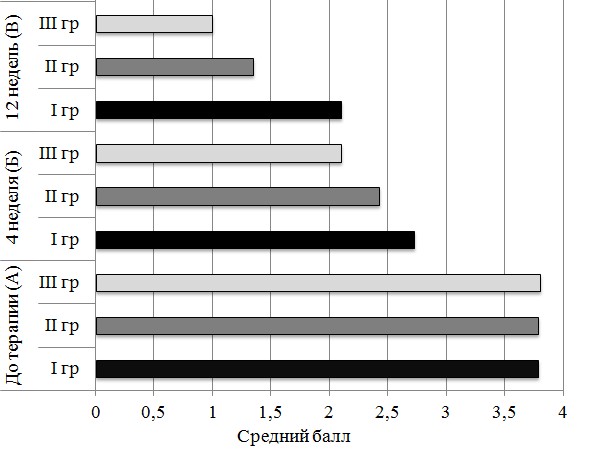
Рис. 1. Динамика кашлевого синдрома, в зависимости от проводимой терапии (pАI-ВI<0,05; pАII-ВII<0,01; pАIII-ВIII<0,01; t-критерий Стьюдента для связанных выборок).
Из рис. 1 следует, что до лечения выраженность кашлевого синдрома в трёх группах не различалась и составила в среднем 3,8 балла. Через 4 недели отмечено достоверное снижение кашлевого синдрома во II и III группе по сравнению с I группой (pБ I-II<0,05; pБ II-III<0,05; pБ I-III <0,01). После 12 недель наблюдения выявлено достоверно более выраженное снижение кашлевого синдрома во II и III группе и особенно по сравнению с I группой (p<0,05).
При анализе медицинской документации выявлены различия в частоте регистрации острых респираторных инфекций в наблюдаемых группах детей (рис. 2).
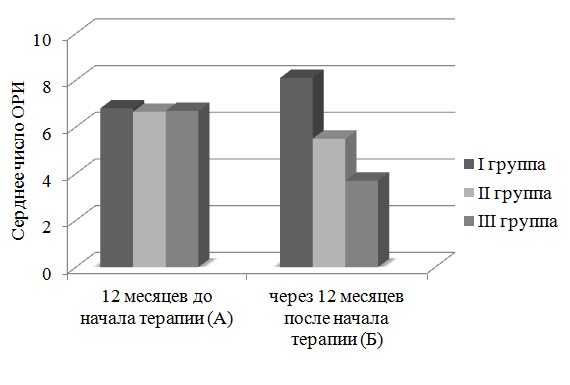
Рис. 2. Среднее число острых респираторных инфекций у детей изучаемых групп, по данным амбулаторных карт.
Из рисунка следует, что после комплекса лечебно-реабилитационных мероприятий у детей III группы среднее количество острых респираторных инфекций в течение года значительно уменьшилось (p АIII-БIII<0,01; t-критерий Стьюдента для связанных выборок), хотя до выявления и лечения Chl. рneumoniae, M. рneumoniae существенных различий в группах не выявлено. Во II группе детей на фоне антибактериальной и иммуномодулирующей терапии так же отмечено снижение числа ОРИ, однако в меньшей степени чем в III группе (p АII-БII<0,05, t-критерий Стьюдента). В I группе, через 12 месяцев после начала терапии, отмечается статистически недостоверное увеличение частоты заболевания (p БI-АI>0,05, t-критерий Стьюдента).
Для определения особенностей течения бронхиальной астмы (БА) на фоне хламидийной и микоплазменной инфекций (БА [инфекция "+"], n=45) в качестве группы сравнения, выбраны дети с БА, у которых Chl. pneumoniae, M. pneumoniae по результатам диагностики не выявлены (БА [инфекция "−"], n=35).
Детальный анализ степени тяжести заболевания, наследственности по аллергическим заболеваниям, сопутствующей аллергопатологии, спектре сенсибилизации к бытовым и пыльцевым аллергенам, не выявил статистической достоверности между группами.
У 66,6% детей с БА [инфекция "+"] на момент включения в исследование выявлена следующая патология ЛОР органов: отит - 11%, синусит - 28,9%, аденоидит - 26,7%. В группе БА [инфекция "−"] у 54% пациентов диагностированы заболевания верхних дыхательных путей: синусит - 11,4%, аденоидит - 43%.
У детей с обострением БА с 7 лет проводили спирометрию с оценкой пробы на обратимость бронхиальной обструкции. Результаты представлены в табл. 2.
Таблица 2. Сравнение показателей функции внешнего дыхания у детей с бронхиальной астмой (%)
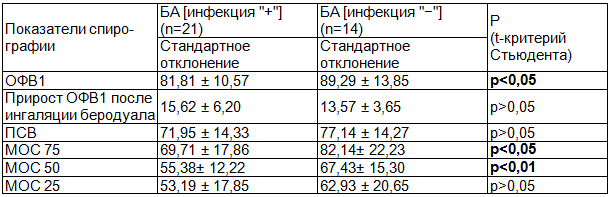
Примечание: ОФВ1 - объём форсированного выдоха за первую секунду, МОС - мгновенная объёмная скорость после выдоха - 75-50-25% форсированной жизненной ёмкости легких; ПСВ - пиковая скорость выдоха.
Представленные данные демонстрируют достоверное снижение объёмных скоростных показателей (ОФВ1, МОС 75-50) у детей с Chl. pneumoniae, M. pneumoniae. Проба с бронхорасширяющим препаратом в обеих группах положительная, степень прироста по ОФВ1 не различается.
Среди патогенетических механизмов, характеризующих течение респираторных Chl. pneumoniae, M. pneumoniae, важное место занимает формирование НГРБ и, как следствие, синдрома бронхообструкции.
Вентиляционные нарушения подтверждаются объёмом бронхолитической и противовоспалительной терапии у детей сравниваемых групп.
Сравнение длительности и объёма терапии двух групп пациентов с БА [инфекция"+"], БА [инфекция "−"] представлено в табл. 3.
Таблица 3. Объём противовоспалительной и бронхоспазмолитической терапии для купирования обострения БА у детей
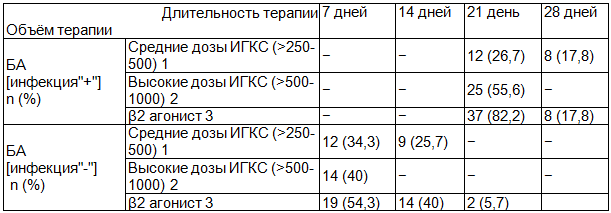
Примечание: ИГКС - ингаляционные глюкокортикостероиды; БА [+] 1-2 - БА [-] 1-2 p<0,05; БА [+] 3 - БА [-] 3 p<0,01 (t-критерий Стьюдента для двух независимых выборок). Средние и высокие дозы представлены в соответствии с рекомендациями GINA 2014. В вертикальных столбцах указано число детей, завершивших применение β2 агонистов быстрого начала действия и переведённых на более низкие дозы ИГКС.
Основываясь на полученных данных, инфицирование Chl. pneumoniae, M. pneumoniae при бронхиальной астме приводит к неконтролируемому течению заболевания и существенно более продолжительному использованию бронхорасширяющих препаратов, что требует более частого и длительного использования ингаляционных глюкокортикостероидов в качестве базисной терапии. При не диагностированных инфекциях, купирование обострения БА, достигается более низкими дозами ингаляционных глюкокортикостероидов и коротким курсом бронхораширяющих препаратов.
Для оценки НГРБ использовали ИПТ с возрастающими концентрациями растворов NaCl. Тестирование проводили после завершения антибактериальной и иммуномодулирующей терапии у детей III группы - через 4 недели и через 6 месяцев от начала комплексной (медикаментозной противовоспалительной и немедикаментозной) терапии. ИПТ провели у 68 детей с выявленной Chl. рneumoniae или M. рneumoniae. Пациенты разделены на следующие подгруппы: БА - дети с атопической бронхиальной астмой (n=21), БОС - дети с синдромом бронхообструкции (n=22, из которых у 9 в дальнейшем диагностирована БА), ИБ - дети с инфекционным бронхитом, у которых бронхообструктивный синдром не выявлен (n=25). Результаты представлены на рис. 3.
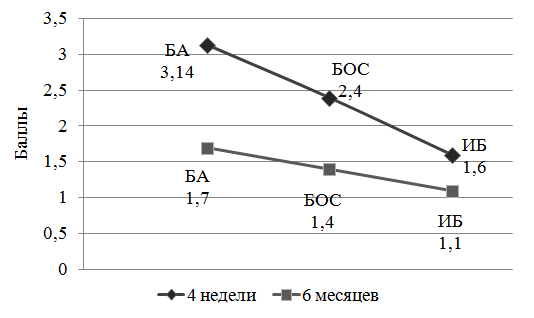
Рис. 3. Реактивность бронхов по результатам ИПТ (в баллах) у детей с Chl. pneumoniae, M. pneumoniae через 4 недели и через 6 месяцев терапии (статистическая достоверность оценивалась двухвыборочным тестом Колмогорова-Смирнова).
Данные, представленные на рис. 3, показывают, что во всех исследуемых группах на фоне терапии степень НГБР достоверно снизилась (p БА 4-6 месяцев <0,01; p БОС 4-6 месяцев<0,01; p ИБ 4-6 месяцев<0,01). Однако в группе БОС у 9 детей сохранялась высокая степень НГРБ, что привело к формированию БА.
По данным катамнеза со сроком не менее 12 месяцев изучена частота возникновения БА в трёх группах больных, в зависимости от проводимой терапии (рис. 4).
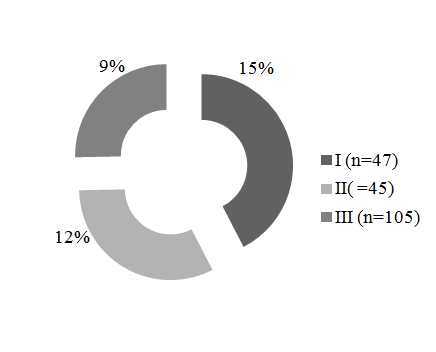
Рис. 4. Формирование БА у детей с хламидийной и микоплазменной инфекцией в зависимости от проводимой терапии.
Из рис. 4 следует, что при проведении адекватного противовоспалительного и восстановительного лечения (III группа) БА формируется статистически реже (9%) по отношению к I группе детей (15%) - p<0,01(t-критерий Стьюдента). Во II группе детей, получавших адекватную антибактериальную и иммуномодулирующую терапию БА возникала в 12% случаев (p I-II<0,05; t-критерий Стьюдента).
Заключение. Проведенное исследование показало, что адекватная антибактериальная, иммуномодулирующая терапия, восстановительное немедикаментозное лечение приводят к снижению риска дебюта БА. У детей с БА уменьшается объём противовоспалительной терапии, а так же частота рецидивирования атипичной инфекции в дальнейшем.
Кроме того, проведение адекватной терапии способствует снижению частоты острых респираторных заболеваний.
И наконец, показано, что для повышения достоверности обследования необходимо использовать не менее двух методов (иммуноферментный анализ (ИФА), ПЦР). При этом для постановки диагноза возможно проведение одного из методов (в динамике) при наличии характерной клинической картины.
