Введение. Общепризнанно, что в организме больного с заболеваниями легких и верхних дыхательных путей в результате патологического процесса развиваются изменения на клеточном и молекулярном уровне, которые в норме практически отсутствуют [2-4]. Эти сдвиги могут быть оценены с помощью лабораторного изучения биологических образцов: например, жидкости, получаемой при бронхоальвеолярном лаваже, промывании носа, исследовании крови, проб ткани легкого [2].
В настоящее время известно, что изменения процессов свободнорадикального окисления (СРО) и нарушения функции антиоксидантной системы (АОС) вносят существенный вклад в развитие ряда заболеваний, сопровождающихся сдвигами цитохимических характеристик верхних дыхательных путей. В частности, активные формы кислорода играют важнейшую роль в патогенезе бронхиальной астмы (БА) [1, 3, 12]. Для всех патологических состояний, течение которых сопровождается увеличением концентрации активных форм кислорода, характерно развитие окислительного стресса, в том числе для острых респираторных заболеваний у часто болеющих детей (ЧБД) [4, 9].
В настоящее время изучению роли активных форм кислорода при различных патологических процессах посвящено много работ обзорного и экспериментального характера, это свидетельствует о признании фундаментального значения активных форм кислорода в патогенезе различных заболеваний [5, 14, 15]. Основной механизм развития окислительного стресса связан со свободнорадикальным повреждением плазматических, митохондриальных и ядерных мембран, ядерного и митохондриального генома, липопротеинов крови, что приводит к повреждению сосудов и гистогематичских барьеров [8]. В то же время сообщения о патогенетической роли процессов СРО и нарушений состояния АОС при патологии легких и верхних дыхательных путей не систематизированы. В полной мере это относится к оценке характеристик этих процессов у детей с различной патологией дыхательной системы, в частности, при бронхиальной астме, а также у часто болеющих детей, которые периодически переносят острые респираторные заболевания. В доступной литературе данные такого рода отсутствуют.
Цель работы - сравнительное изучение показателей свободнорадикального окисления в различных биологических средах у детей с заболеваниями системы дыхания.
Материалы и методы лечения. На базе аллергологического отделения Ошской межобластной детской клинической больницы проведено обследование 215 детей, которые были разделены на 3 группы:
- 58 здоровых детей (1 группа - контрольная);
- 74 ребенка (группа 2) - часто болеющие дети;
- 83 ребенка (группа 3) - дети с бронхиальной астмой.
Распределение пациентов по возрасту, полу, средней длительности заболевания приведено в табл. 1.
Таблица 1. Распределение пациентов по возрасту и полу и длительности заболевания
У детей, включенных в исследование, был выполнен сбор конденсата выдыхаемого воздуха по методу Белова Г.В. и др. (2005) [2], а также назальных смывов общепринятым методом. В этих биологических средах определяли концентрации ряда веществ и показатели: уровни суммарных липидов, гидроперекисей, диеновых конъюгат, оценивали окислительный индекс.
Также оценивали оценку активности процессов свободнорадикального окисления и антиоксидантной системы у обследуемых пациентов. При этом определяли концентрации диеновых конъюгат, малонового диальдегида, активность каталазы и супероксиддисмутазы (СОД). Определение малонового диальдегида в крови проводили флуориметрическим методом, основанном на том, что тиобарбитуровая кислота в кислой среде взаимодействует с низкомолекулярными диальдегидами (главным образом с малоновым) с образованием окрашенного в розовый цвет комплекса [7].
Определение диеновых коньюгат в плазме крови осуществляли по УФ-поглощению гептановых и изопропанольных экстрактов, который основан на измерении интенсивности поглощения в области 232-234 нм, обусловленной конъюгированными диеновыми структурами (предварительно экстрагированными из плазмы), возникающими при образовании гидpoперекисей полиненасыщенных жирных кислот [7].
Активность каталазы оценивали методом, основанным на определении скорости разложения перекиси водорода мМ/мин спектрофотометрически при длине волны 230 нм. Для стабилизации гемолизата и разложения комплекса каталаза - Н2О2 добавляли этанол [7].
Определение активности супероксиддисмутазы осуществляли методом, предложенным Костюк В.А. и др. (1990), основанным на реакции окисления кверцетина [6].
Статистическую обработку данных проводили с помощью пакета программ STATISTICA 8.0. Для определения статистически значимых различий показателей в группах обследуемых пациентов U-критерий Манна-Уитни (тест Колмогорова-Смирнова показал, что распределение значений параметров существенно отличалось от нормального). При значении p<0.05 результаты оценивались как статистически значимые.
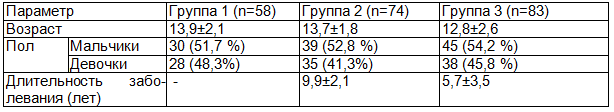
Результаты. Анализ показателей свободнорадикального окисления эндоназальных смывов показал, что концентрация суммарных липидов в контроле составила 0,492±0,023 мг/мл, в группах ЧБД и детей с БА уровни этого параметра были значимо ниже, составив соответственно 0,426±0,021 и 0,412±0,031мг/мл (рис. 1).
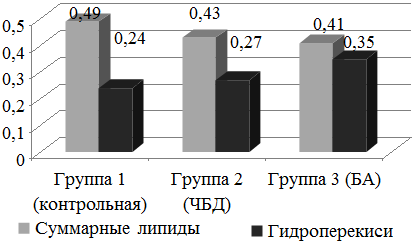
Рис. 1. Концентрация суммарных липидов и гидроперекисей в назальных смывах обследуемых детей.
Уровень содержания гидроперекисей в эндоназальных смывах у обследуемых контрольной группы составил 0,242±0,016 мг/мл, в группе ЧБД был несколько выше - 0,267±0,016 мг/мл, его значение достоверно не превышало таковое в контроле. У детей с БА этот показатель был почти в 1,5 раза выше, чем в контроле, значимо превышая этот уровень, а также соответствующее значение в группе 2 (ЧБД).
Сравнение концентраций диеновых конъюгат показало, что у часто болеющих детей уровень этого показателя составил 0,045±0,011 мг/мл, существенно не отличаясь от такового в контроле - 0,037±0,004 мг/мл. Максимальным было значение данного показателя в группе детей с бронхиальной астмой - 0,051±0,003 мг/мл, достоверно превышающее контрольный уровень (рис. 2).
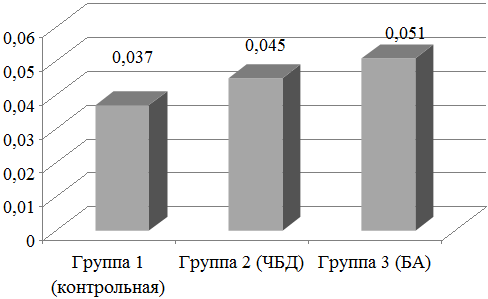
Рис. 2. Уровни диеновых конъюгат в назальных смывах обследуемых детей.
Оценка показателя окислительного индекса выявила существенные различия в группах обследуемых детей. Так, если в контрольной группе уровень его составил 0,483±0,019, у часто болеющих детей значение этого показателя было достоверно выше (p<0,05) - 0,628±0,021. У детей с БА уровень окислительного стресса был максимальным, составив 0,849±0,034 и достоверно превышал (p<0,05) соответствующие уровни в группах 1 и 2 (рис. 3).
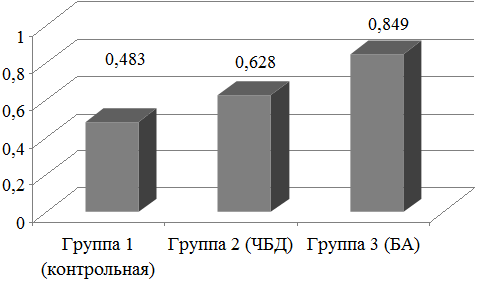
Рис. 3. Окислительный индекс назальных смывов обследуемых детей.
Исследование процессов свободнорадикального окисления в конденсате выдыхаемого воздуха свидетельствовало о том, что концентрация суммарных липидов у пациентов контрольной группы составила 0,106±0,007 мг/мл, в группах ЧБД и детей с БА уровни этого параметра были несколько ниже, составив соответственно 0,093±0,0005 и 0,091±0,008 мг/мл, однако значимых межгрупповых различий при этом выявлено не было (рис. 4).
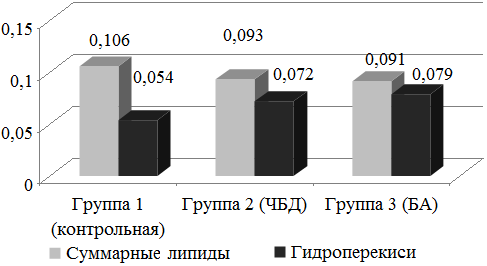
Рис. 4. Концентрация суммарных липидов в конденсате выдыхаемого воздуха у обследуемых детей.
Уровень содержания гидроперекисей в конденсате выдыхаемого воздуха (КВВ) у обследуемых контрольной группы составил 0,054±0,006 мг/мл, в группе ЧБД значение данного параметра было достоверно выше (p<0,05) - 0,072±0,007 мг/мл, в группе детей с БА этот показатель был еще выше 0,079±0,005 мг/мл, значимо превышая (p<0,05) уровень контрольной группы.
При сравнении уровней диеновых конъюгат показало, что у часто болеющих детей значение этого показателя составило 0,017±0,004 мг/мл, существенно не отличаясь от такового в контроле - 0,013±0,002 мг/мл. Максимальным было значение данного показателя в группе детей с бронхиальной астмой - 0,023±0,003 мг/мл, что достоверно превышало (p<0,05) соответствующий уровень контрольный группы.
Сравнение значений показателя окислительного индекса выявило существенные различия в группах обследуемых детей. В контрольной группе уровень его составил 0,485±0,018, у часто болеющих детей значение этого показателя было достоверно выше (p<0,05) - 0,781±0,021. У детей с БА уровень окислительного стресса был максимальным, составив 0,856±0,033, что значимо превышало (p<0,05) соответствующие уровни в группах 1 и 2 (рис. 5).
Очевидно, что выявленные изменения показателей свободнорадикального окисления в эндоназальных смывах и конденсате выдыхаемого воздуха являются проявлением системных нарушений в организме обследуемых пациентов из групп часто болеющих детей и детей с бронхиальной астмой. Безусловно, аналогичные сдвиги должны при этом выявляться и в периферической крови этого контингента больных, что и было выявлено в наших дальнейших исследованиях.

Рис. 5. Окислительный индекс конденсата выдыхаемого воздуха у обследуемых детей.
Сравнительная оценка показателей активности СРО и антиоксидантной системы периферической крови у обследуемых детей также продемонстрировала ряд изменений, представленных в табл. 2. Как видно, у часто болеющих детей и детей с БА отмечается значимое повышение (p<0,05) концентраций диеновых конъюгат и малонового диальдегида относительно контрольного уровня, в то время как значения активности ферментов антиоксидантной системы супероксиддисмутазы и каталазы были достоверно снижены относительно соответствующих значений в контрольной группе.
Таблица 2. Состояние процессов свободнорадикального окисления и активность антиоксидантной системы плазмы крови у обследуемых детей
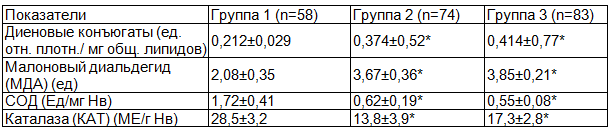
Примечание: различия достоверных (при p<0,05) относительно соответствующих значений показателей контрольной группы.
Заключение. Таким образом, в настоящее время описана роль процессов СРО в целом ряде процессов гомеостаза, в том числе - в основе синтеза многих биологически активных соединений - лейкотриенов, пуриновых дезоксирибонуклеотидов, мочевой кислоты, макроэргических соединений - изменений концентраций которых в тканях могут способствовать развитию целого ряда патологических состояний [11, 13]. Активные формы кислорода (АФК) и свободные радикалы образуются в основном при последовательном присоединении электронов к кислороду, в процессе перекисного окисления липидов (ПОЛ). ПОЛ является одним из путей утилизации кислорода в клетке, на мембранах ПОЛ представляет собой защитную реакцию, которая способствует обновлению фосфолипидов мембран [9, 10, 14]. Очевидно, что эти изменения являются проявлениями процессов, происходящих на молекулярном и клеточном уровне в слизистой оболочке верхних дыхательных путей при рассматриваемых патологиях, лежащих в основе патогенеза этих нозологий. Одним из таких путей патогенеза являются сдвиги процессов свободнорадикального окисления и нарушения антиоксидантной защиты.
Проведенные исследования показали, что у обследуемых детей - часто болеющих и с диагнозом бронхиальная астма - наблюдалось повышение активности процессов свободнорадикального окисления, в частности повышение концентрации малонового диальдегида и диеновых конъюгат в плазме крови и в КВВ. Наряду с этим выявлено снижение активности антиоксидантной системы у этих пациентов, что проявлялось ослаблением ферментных систем - супероксиддиссмутазы (СОД) и каталазы. Выявленные биохимические сдвиги подтверждают высказываемое многими авторами мнение, что оптимизация баланса про- и антиоксидантных систем организма должна стать важнейшим механизмом и необходимым условием комплекса лечебно-профилактических мероприятий, проводимых детям с частыми инфекционными заболеваниями, развивающимися на аллергическом фоне.
