Введение. Поликистозная болезнь почек широко распространена во всем мире [1,2]. Все случаи заболевания могут быть разделены на генетически детерминированные и ненаследственные случаи образования кист. Поликистозная почка - обычно спорадическая, несиндромальная врожденная аномалия. Заболевание возникает в результате тазово-мочеточниковой дисплазии или атрезии, с формированием увеличенной почки и кист различного размера, не сообщающихся между собой.
Аутосомно-доминантная поликистозная болезнь почек (АДПБП) возникает в результате мутации генов PKD1 (поликистозная болезнь почек 1 [polycystic kidney disease 1]) и PKD2 (поликистозная болезнь почек 2 [polycystic kidney disease 2]), кодирующих белки полицистины. Формирование аутосомно-доминантной поликистозной болезни почек требует помимо генетической предрасположенности дополнительного провоцирующего фактора в течение жизни [3]. Аутосомно-рецессивная поликистозная болезнь почек (АРПБП) возникает в результате мутации PKHD1 (поликистозная болезнь почек и печени [polycystic kidney and hepatic disease 1]), крупного гена, кодирующего фиброцистин/полидуктин, играющий важную роль в формировании собирательных трубочек и билиарной системы. Поликистозная болезнь почек - вторая по распространенности причина возникновения припухлости в поясничной области. Диагноз может быть установлен внутриутробно при ультразвуковом исследовании или при пальпации объемного образования в животе при обследовании новорожденного. Клинические симптомы проявляются редко, за исключением случаев, когда заболевание осложняется инфекцией. Контралатеральная почка обычно развивается нормально, но может наблюдаться гидронефроз, эктопия, рефлюкс, дисплазия или отсутствие почки. У пациентов с АДПБП первые симптомы (боли в поясничной области или эпизоды гематурии) появляются после 20 лет. Размер почек экспоненциально увеличивается вследствие увеличения объема кист. Течение заболевания вариабельно. Печеночные кисты - наиболее частое внепочечное проявление заболевания, распространенность которого увеличивается с возрастом. По современным данным, распространенность составляет 20% и 75% в возрасте 20-30 лет и 50-60 лет, соответственно [4].
У пациентов с генотипом PKD1 отмечается более быстрое прогрессирование заболевания. АРПБП оказывает влияние на развитие почек и печени с различной степенью вовлеченности органов в зависимости от возраста. Заболевание может становиться причиной неонатальной гибели в результате поражения легких как следствия нефромегалии и олигогидрамниона. У детей младшего возраста отмечаются гипертония, снижение способности к концентрации мочи, почечная недостаточность. Почти у половины пациентов в течение первого десятилетия жизни развивается терминальная почечная недостаточность. При возникновении заболевания у детей в возрасте 4-8 лет отмечается преимущественное поражение печени с меньшим вовлечением почек [5,6].
Помимо патологии органов мочевой системы у детей с поликистозной болезнью почек часто выявляется патология сердечно-сосудистой системы (CCC) [7,8], однако имеющиеся данные противоречивы и требуют проведения дополнительных исследований, в связи, с чем целью данного исследования явилось оценка характера частоты соединительнотканной дисплазии CCC у детей с поликистозной болезнью почек.
Материалы и методы исследования. На базе уронефрологического отделения Государственного бюджетного учреждения «Детская республиканская клиническая больница» г. Махачкалы, и лаборатории общей патологии Федерального государственного учреждения Московского научно-исследовательского института педиатрии и детской хирургии Росздрава обследовано 60 детей, из которых у 30 (50,0%) была поликистозная болезнь почек (I группа - основная) и 30 (50,0%) были здоровы (II группа - контрольная). В I группе было 14 (46,7%) мальчиков и 16 (53,3%) девочек в возрасте от 3 до 16 лет (средний возраст 7±5,82 лет), во II - 13 (43,3%) мальчиков и 17 (56,7%) девочек в возрасте от 4 до 15 лет (средний возраст 6±6,73 лет).
Для оценки состояния здоровья детей применялись общепринятые клинические методы исследования органов и систем, включая общий и биохимический анализы крови, общий анализ мочи, анализ суточной мочи и оценку спонтанного ритма мочеиспускания. Функциональное состояние почек изучалось с использованием пробы Зимницкого и скорости клубочковой фильтрации (СКФ) по формуле Шварца. Комплекс инструментальных методов исследования включал в себя ультразвуковое сканирование почек с оценкой внутрипочечного кровотока путем цветного допплеровского картирования и мочевого пузыря, эхокардиографическое и электрокардиографическое (ЭКГ) исследование, холтеровское мониторирование пульса, артериального давления и ЭКГ.
Статистическая обработка результатов исследования проводилась с использованием Microsoft Excel и статистического программного обеспечения Биостат (издательский дом «Практика», 2006), SPSS 15.0 и Statistica 8.0 for Windows (StatSoftInc., USA). Корреляционный анализ проведен с использованием методов Пирсона и Спирмана. Различия считались статистически значимыми при уровне ошибки p<0,05.
Результаты исследования. Первый этап исследования заключался в оценке наследственной предрасположенности и дополнительных триггерных факторов риска прогрессирования поликистозной болезни почек у детей. В наследственном анамнезе поликистозную болезнь и другие аномалии развития почек чаще выявлялись у матери (46,7%) и у дедушек со стороны матери (40,0%). Вместе с тем нередки были случаи наличие указанной патологи по отцовской линии. Так частота аномалий мочевой системы у отцов детей с поликистозов составила 16,7 %, у бабушек по линии отца - 23,3%, у братьев и сестер - 20,0%.
Наиболее значимыми факторами оказались порядковый номер беременности и наличие длительно действующих производственных вредностей как у матери, так и у отца ребенка.
При оценке порядкового номера беременности выявлено, что дети с поликистозной болезнью почек в 6,9 раза чаще рождались от 4-й беременности, чем дети без патологии органов мочевой системы (p<0,05). (рис.1).
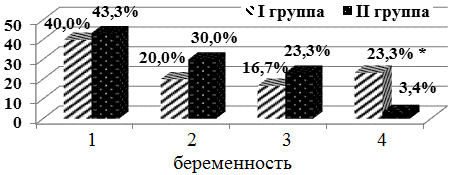
Рис. 1. Распределение детей по порядковому номеру беременности. Здесь и далее * - p<0,05 - статистически значимые различия между I и II группами.
Таким образом, частая беременность, по-видимому, явилась триггерным фактором соматических мутаций, способствовавших реализации аутосомно-доминантного варианта поликистоза почек у наблюдавшихся детей.
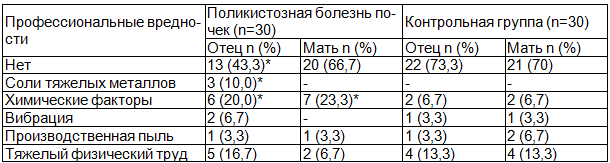
Выявлено, что матери детей I и II групп имели контакт с профессиональными вредностями до рождения ребенка с одинаковой частотой, однако, матери детей с поликистозной болезнью почек в 3,5 раза чаще работали с химическими веществами по сравнению с матерями контрольной группы.
При оценке профессиональных вредностей у отцов обследуемых детей выявлено, что в I группе отцы в 1,54 раза чаще работали с профессиональными вредностями, чем отцы II группы, среди которых чаще всего встречалось воздействие различных химических факторов и солей тяжелых металлов (табл. 1).
Таблица 1. Профессиональные вредности у родителей обследованных детей
Среди осложнений пороков почек и сопутствующих нефрологических заболеваний у детей I группы были хронический пиелонефрит - 10 (33,3%), стойкая кристаллурия - 22 (73,3%), хроническая почечная недостаточность 1степени - 5 (16,7%) и ренальная гипертензия - 19 (63,3%).
Активный микробно-воспалительный процесс и выраженная кристаллурия сопровождались статистически значимым увеличением уровня С-реактивного белка (0,145 ЕД и 0,003 ЕД соответственно) (р<0,05). Выявлено нарушение циркадного ритма при проведении пробы Зимницкого с тенденцией к никтурии (р<0,05), дневной диурез составил 641,21 и 696,12 мл в I и II группах соответственно, ночной - 258,17 и 197,2 мл, соотношение дневного и ночного диуреза - 2,48 и 3,53 соответственно.
Оценка СКФ по формуле Шварца с учетом уровня креатинина в сыворотке крови позволила установить стадию прогрессирования хронической болезни почек (ХБП). У части больных (в 15 случаях) была выявлена гиперфильтрация (СКФ ≥ 130 мл/мин/1,73м2). У 5 больных была зарегистрирована ХБП 1 стадии (СКФ - 95,35 мл/мин/1,73м2) и в 10 случаях - ХБП 2 стадии (СКФ - 80,87 мл/мин/1,73м2). Эти показатели достоверно (р<0,05) отличались от данных контрольной группы (СКФ - 115,71 мл/мин/1,73м2).
При проведении ультразвукового исследования (УЗИ) почек у детей I группы выявлены неровный контур (20,0%), деформация и сдавление чашечно-лоханочной системы (16,7% и 10,0% соответственно), эхопозитивные образования (16,7%), повышенная визуализация пирамидок (23,3%); При оценке внутрипочечного кровотока методом цветного допплеровского картирования у большинства (75%) было отмечено в разной степени нарушение скорости кровотока, участки обеднения артериального кровотока и замедление скорости венозного оттока крови.
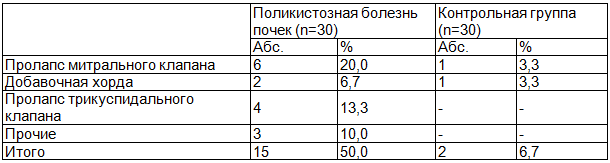
При оценке патологии ССС у детей с поликистозной болезнью почек были выявлены соединительнотканные дисплазии сердца у 15 (50%) человек, в контрольной группе - у 4 (13,3%). Структура соединительнотканных дисплазий сердца представлена в табл. 2. Указанные дисплазии соединительной ткани в основном касались клапанных структур в виде их пролапса.
Таблица 2. Структура соединительнотканных дисплазий сердца у обследованных детей
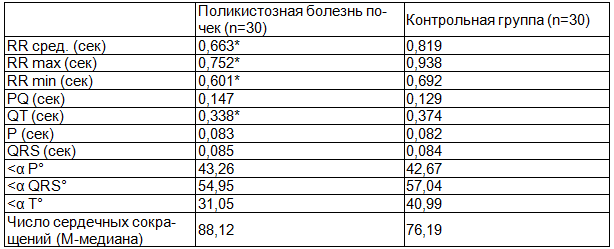
При проведении ЭКГ у детей с поликистозной болезнью почек была выявлена статистически значимо меньшая средняя продолжительность интервала R-R, а также изменения минимальной и максимальной продолжительности R-R по сравнению с детьми II группы (р<0,05). Интервал Q-T у детей с поликистозной болезнью почек был статистически значимо короче, чем у детей без патологии органов мочевой системы (р<0,05). Не было выявлено статистически значимых различий при оценке направления зубцов P (<αP), T (<αT), и комплекса QRS (<αQRS) между I и II группами (табл. 3).
Таблица 3. Данные электрокардиографического исследования
При проведении суточного мониторирования выявлено, что у детей с поликистозом минимальная частота сердечных сокращений (ЧСС) днем и максимальная ЧСС ночью составила 146,2 и 137,4 и была статистически значимо выше, чем у детей контрольной группы ( 110,3 и 87,5 соответственно) (р<0,01). При проведении суточного мониторирования у пациентов с поликистозной болезнью почек часто выявлялись желудочковые экстрасистолии (ЖЭС) (у 23 (76,7%) детей), которые преимущественно наблюдались в дневное время (60,9%). В контрольной группе ЖЭС были зарегистрированы лишь у 2 (6,7%) пациентов.
Таким образом, в проведенном исследовании было выявлено, что у детей с поликистозной болезнью почек в патологии ССС преобладают соединительнотканные дисплазии сердца, а также присутствуют нарушения при проведении ЭКГ и суточного мониторирования.
Заключение. Киста почки представляет собой заполненное жидкостью образование, возникающее в результате дилатации любого отдела нефрона или собирательных трубочек. Кисты со временем могут отделяться от нефронов или трубочек и продолжать увеличиваться. В большинстве случаев образуются простые кисты; считается, что кисты почек имеются примерно у трети людей в возрасте 50 лет и старше. В зависимости от типа кист, симптомы заболевания могут возникать в любом возрасте, а во многих случаях могут проявляться уже внутриутробно у плода. При отсутствии своевременной диагностики и лечения заболевание прогрессирует с формированием ХБП и терминальной стадии почечной недостаточности.
Исход заболевания в развитых и развивающихся странах значительно различается, преимущественно в связи с поздним появлением симптомов, недостатком оборудования, необходимого для своевременного установления диагноза, а также отсутствием в развивающихся странах технических возможностей, условий и специалистов, необходимых для проведения внутриутробного вмешательства. Особенно в случае возникновения симптомов во внутриутробном периоде развития.
Полученные данные согласуются с исследованием С.В. Папиж (2013) с соавт., в котором у детей поликистозной болезнью почек артериальная гипертензия выявлена в 30,5% случаев, гипертрофия миокарда левого желудочка в 11% и ремоделирование миокарда по концентрическому типу в 2,8% [7].
Таким образом, проведенное исследование позволило установить, что у обследованных больных по анамнестическим данным, по характеру течения, данным УЗИ поликистозная болезнь почек укладывается в аутосомно-доминантный вариант.
Ведущими триггерными факторами прогрессирования поликистозной болезни почек являются воздействие вредных химических и производственных факторов на организм родителей, а также частые беременности у матери (4 и более).
У 50% обследованных детей и подростков с поликистозной болезнью почек имелись соединительнотканные дисплазии сердца (пролапс митрального и трикуспидального клапана, добавочная хорда и другие), у 63,3% - артериальная гипертензия, преимущественно ночной и эпизодический вариант.
При поликистозной болезни почек выявлено снижение средней продолжительности интервала R-R, а также минимальной и максимальной продолжительности интервала R-R, укорочение интервала QT по сравнению с нормальными показателями (р<0,05). У 12% обследованных регистрирована гипертрофия левого желудочка сердца.
Полученные нами данные обосновывают необходимость включения в стандарт диспансерного наблюдения детей с поликистозной болезнью почек осмотра детским кардиологом 1-2 раза в год с дополнительным обследованием ССС (проведение ЭКГ, ультразвукового исследования сердца, и суточного мониторирования артериального давления).
