Введение. Ведущая роль иммунопатологических реакций в патогенезе развития заболеваний верхних дыхательных путей и бронхоспастического синдрома при основных клинико-патогенетических вариантах бронхиальной астмы (БА) в настоящее время является общепризнанной [1, 2, 7, 8]. При этом в последние годы накоплены новые данные о механизмах развития заболевания, хотя в течение долгого времени исследователи полагали, что в основе нарушений иммунной регуляции при БА лежит снижение дисбаланс между уровнями Т-хелперами (CD4+) и Т-супрессорами (CD8+), в то время как изменения количества и активности В-лимфоцитов являются вторичными [5, 7, 10]. По мере прогресса теоретической иммунологии, открытия цитокиновой системы и разработки новых методов исследования наблюдалась трансформация взглядов на изменения иммунорегуляторных процессов при БА. Накопление данных, характеризующих интерлейкина-2 (ИЛ-2) как основной цитокин, стимулирующий пролиферацию и дифференцировку Т-лимфоцитов, открытие рецептора к этому цитокину (поверхностного маркера CD25) на CD4+ лимфоцитах и выявление повышенного уровня CD4+CD25+ клеток у пациентов с БА способствовало усиленному вниманию к изменениям регуляции при инфекционно-аллергических процессах [1, 4, 9, 12].
Дети, страдающие БА, нередко относятся к группе детей, часто и длительно болеющих респираторными инфекциями [6]. По мнению ряда авторов, изучение иммунного статуса у часто болеющих детей (ЧБД) и сравнение этих данных с данными детей, страдающих БА, способствуют выявлению закономерностей патогенеза этих заболеваний и позволяют выявить ряд факторов, влияющих на «переход» ребенка из статуса ЧБД в статус больных БА [6, 10].
В связи с вышеизложенным представляется актуальным изучение состояния иммунной системы, в частности состояния клеточного и гуморального звеньев иммунитета и сравнение этих показателей с аналогичными показателями часто болеющих детей. Однако в литературе такие сообщения единичны и несистематизированы.
Цель работы - сравнительная характеристика иммунного статуса детей с бронхиальной астмой и часто болеющих детей.
Материалы и методы лечения. На базе аллергологического отделения Ошской межобластной детской клинической больницы проведено обследование 215 детей, которые были разделены на 3 группы:
- 58 здоровых детей (1 группа - контрольная);
- 74 ребенка (группа 2) - часто болеющие дети;
- 83 ребенка (группа 3) - дети с бронхиальной астмой.
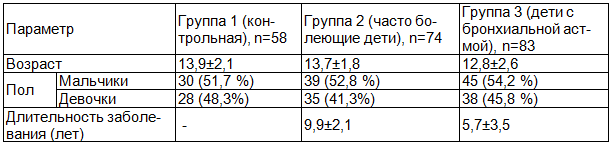
Распределение пациентов по возрасту, полу, средней длительности заболевания приведено в табл. 1.
Таблица 1. Распределение пациентов по возрасту и полу и длительности заболевания
У детей, включенных в исследование, было выполнено клиническое обследование больных с оценкой общего состояния и лабораторное исследование, которое включало изучение иммунного статуса, в частности, содержание основных субпопуляций лимфоцитов в периферической крови обследуемых детей, оценку показателей гуморального и исследование концентраций ряда цитокинов.
Все пациенты были опрошены с помощью теста контроля астмы - Asthma Control Test (АСТ). АСТ был разработан в 2002 году компанией Quality Metric Incorporated, в 2003 г. представлен на Международном конгрессе по аллергологии и иммунологии [2].
Оценку субпопуляций лимфоцитов проводили с использованием метода проточной цитофлуориметрии на приборе FacsCanto II («Beckton Dickinson», США). Исследование производили стандартным методом в общей фракции мононуклеарных клеток. Поверхностный фенотип клеток определяли с помощью моноклональных антител (мАТ). В качестве флюорохромных меток использовали флюоресцеин изотиоционат (FITC) и фикоэритрин (РЕ).
Процедуру окрашивания и фиксации клеток проводили стандартным способом в соответствии с указаниями фирмы-разработчика. При проведении проточной цитометрии клетки использовали в конечной концентрации 1x106 кл/мл. К 50 мкл суспензии клеток в концентрации 1x106 кл/мл одновременно добавляли 20 мкл мАТ, меченных FITC и 20 мкл мАТ, меченых РЕ, инкубировали в темноте при комнатной температуре в течение 30 минут, затем клетки отмывали в 1 мл фосфатного буфера (PBS), содержащего 0,1% азид натрия, и фиксировали в соответствии со стандартной процедурой.
C помощью стандартных наборов (Beckton Dickinson, США) определяли абсолютное и относительное содержание лимфоцитов с фенотипом CD3+ (Т-лимфоцитов), CD4+ (Т-хелперов), СD8+ (цитотоксических Т-лимфоцитов), CD20+ (В-лимфоцитов), CD16+ (NK-клеток- клеток-естественных киллеров), CD25+ - клеток (лимфоцитов, несущих рецепторы к интерлейкину-2).
Содержание IgA, M и G определяли иммунотурбодиметрическим методом с использованием наборов «ВИТАЛ» (Россия). Оценку реакции проводили на спектрофотометре СФ-26 (ЛОМО, Россия) при длине волны 450 нм. Уровень общего IgE определяли методом иммуноферментного анализа с использованием наборов «Полигност». Определение специфических IgE в сыворотке крови проводили иммунохемилюминесцентным методом с применением MAST-панелей на 36 аллергенов (HitachiDiagnostics, США).
Для определения цитокинового профиля использовали образцы сыворотки крови больных. Определение концентрации свободных цитокинов осуществляли с использованием наборов реагентов для ИФА фирмы «Вектор Бест», РФ, в соответствии с инструкцией производителя. При этом оценивали концентрации интерлейкинов (ИЛ)-2, 4, фактора некроза опухоли-альфа (ФНО-α), интерферона - гамма (ИНФ-γ).
Статистическую обработку данных проводили с помощью пакета программ STATISTICA 8.0. Для определения статистически значимых различий показателей в группах обследуемых пациентов U-критерий Манна-Уитни (тест Колмогорова-Смирнова показал, что распределение значений параметров существенно отличалось от нормального). При значении p<0.05 результаты оценивались как статистически значимые.
Результаты. Оценка количества CD3+ лимфоцитов в периферической крови обследуемых детей показала, что если у детей контрольной группы 1 их абсолютное содержание составило 1,48±0,15 x103 /мкл, то у часто болеющих детей значение этого показателя было достоверно ниже (p<0,05) 1,12±0,10 x103 /мкл. Также значимо ниже, чем в контроле было количество клеток с данным фенотипом у детей группы 3 (БА) - 1,18±0,08 x103 /мкл (табл.2).
Сравнение количества клеток с фенотипом CD4+ (хелперов) показало, что в контрольной группе значение данного показателя было на уровне 0,82±0,06 x103 /мкл, у детей группы 2 (часто болеющие дети) несколько ниже - 0,72±0,11 x103 /мкл, тогда как у обследуемых с бронхиальной астмой (группа 3) абсолютное содержание CD4+ лимфоцитов составило 1,06±0,13 x103 /мкл и было достоверно выше (p<0,05), чем в остальных группах.
Оценка количества CD8+ лимфоцитов (супрессоров/цитотоксических) свидетельствовала о том, что у здоровых и часто болеющих детей их абсолютное содержание в периферической крови практически не различалось, составив соответственно 0,54±0,08 и 0,52±0,06 x103 /мкл. У детей с бронхиальной астмой (группа 3) значение данного показателя было ниже - 0,43±0,06 x103 /мкл, хотя при этом значимых межгрупповых различий выявлено не было.
Исследование количества CD19+ клеток (В-лимфоцитов) в периферической крови обследуемых детей свидетельствовало о том, что в контрольной группе 1 их абсолютное содержание было минимальным и составило 0,58±0,12 x103 /мкл. В группе 2 (часто болеющие дети) значение данного показателя было выше - 0,77±0,08 x103 /мкл, но достоверно не отличалось от такового в контроле. Максимальным был уровень В-лимфоцитов в периферической крови детей с бронхиальной астмой - 0,86±0,11 x103 /мкл, значение данного параметра было достоверно выше (p<0,05), чем в группе 1.
Оценка уровня CD25+ лимфоцитов (несущих рецепторы в интерлейкину-25) показала, что если у здоровых детей его уровень составил 0,07±0,01 x103 /мкл, то максимальным было значение этого показателя у детей с бронхиальной астмой - 0,16±0,03 x103 /мкл, что было достоверно выше (p<0,05), чем в остальных группах, при этом в группе 2 (часто болеющие дети) отмечен промежуточный уровень данного параметра 0,11±0,02 x103 /мкл, значимо не отличавшийся от таковых в группах 1 и 3.
Следует отметить, что абсолютное количество клеток с фенотипом CD16+ (естественных киллеров) было максимальным у детей контрольной группы - 0,37±0,05 x103 /мкл, тогда как в группах 2 и 3 количество этих клеток было достоверно ниже (p<0,05), составив соответственно 0,27±0,04 x103 /мкл и 0,23±0,05 x103 /мкл.
Оценка относительных количеств лимфоцитов с различными детерминантами в периферической крови показала несколько иное распределение. Так, значение процентного содержания CD3+ клеток у детей контрольной группы составило 62,3±4,5 % и было значимо выше (p<0,05), чем в группе 2 (ЧБД) - 46,2±5,1 %. У детей с бронхиальной астмой значение данного показателя было на промежуточном уровне (55,5±6,1 %) и достоверно не отличалось от таковых в группах 1 и 2.
Сравнение уровня CD4+ лимфоцитов свидетельствовало о том, что максимальным было количество клеток-хелперов у детей с бронхиальной астмой - 56,1±4,4 %, это значение было достоверно выше соответствующих показателей в контрольной группе 1 - 47,5±3,2 % и у часто болеющих детей - 39,0±5,2 %. В последних двух группах достоверных отличий по данному показателю отмечено не было.
Сопоставление относительных количество CD8+ клеток показало, что максимальным был уровень этого показателя у здоровых детей - 29,5±3,4 %, тогда как в группах 2 и 3 его значение было достоверно ниже (p<0,05), составив соответственно 20,1±2,4 и 22,5±3,5 %.
Оценка процентного содержания клеток с фенотипом CD19 показала, что если в контроле значение этого показателя было на уровне 18,3±4,2 %, то у часто болеющих детей его значение было достоверно ниже (p<0,05) - 11,5±3,1 % , а у детей с бронхиальной астмой - достоверно выше (p<0,05), чем в контрольной группе - 22,4±2,5 %.
Сравнение значений показателя для лимфоцитов, несущих рецептор к ИЛ-2 (CD25), показало, что максимальным было их относительное количество в контроле - 12,4±3,2 %, в то время как в группе 2 (ЧБД) значение данного показателя было достоверно ниже (p<0,05) - 7,2±1,1 %. У детей с БА количество этих клеток в периферической крови было на промежуточном уровне - 9,5±3,3 %, достоверно не отличаясь от таковых в группах 1 и 2.
Наконец, оценка относительного количества CD16+ лимфоцитов показала, что уровень клеток - естественных киллеров у детей контрольной группы был максимальным - 12,2±2,2 %, у часто болеющих детей несколько ниже - 9,5±3,4 %, но достоверно не отличался от показателя в контроле. Минимальным было значение этого показателя в группе 3 (БА) - 8,4±1,1 %, достоверно ниже (p<0,05), чем в группе здоровых детей.
Таблица 2. Абсолютное содержание иммунокомпетентных клеток в периферической крови у часто болеющих детей и детей с бронхиальной астмой (M±m)
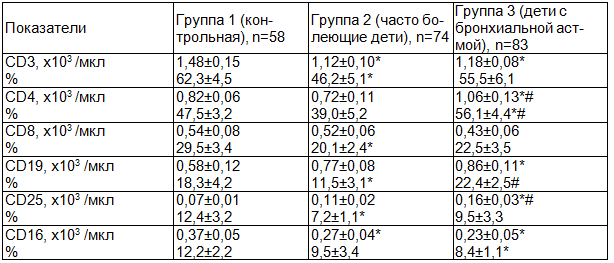
Примечание: здесь и далее * - различия достоверны (при р<0,05) относительно значений группы 1 (критерий Манна-Уитни); # - различия достоверны (p<0,05) относительно значений группы 2 (критерий Манна-Уитни).
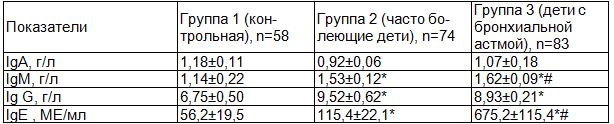
Оценка концентраций иммуноглобулинов показала, что уровень Ig A у детей контрольной группы 1 составил 1,18±0,11 г/л, в группе 2 (часто болеющие дети) - 0,92±0,06 г/л, группа 3 (дети с бронхиальной астмой) - 1,07±0,18 г/л (табл.3). При этом значимых межгрупповых различий выявлено не было.
Сравнение уровней Ig M у обследуемых детей выявило, что в контроле его значение было минимальным и составило 1,14±0,22 г/л, тогда как в группах 2 и 3 уровень этого показателя был значимо выше (p<0,05) и составил соответственно 1,53±0,12 и 1,62±0,09 г/л.
Уровень Ig G у детей контрольной группы 1 составил 6,75±0,50 г/л. Максимальным было значение данного показателя у часто болеющих детей - 9,52±0,62 г/л, что достоверно превышало (p<0,05) соответствующий уровень в контроле. У детей с бронхиальной астмой концентрация Ig G также была значимо выше (p<0,05), чем в контрольной группе и составила 8,93±0,21 г/л.
Сопоставление уровней Ig E у обследуемых детей показало, что у в группе 3 (дети с бронхиальной астмой) его значение было закономерно максимальным - 675,2±115,4 МE/мл, что достоверно превышало (p<0,05) соответствующие уровни в контроле 56,2±19,5 МЕ/мл и у часто болеющих детей - 115,4±22,1 МЕ/мл. Последнее значение также достоверно превышало (p<0,05) показатель контрольной группы.
Таблица 3. Характеристика гуморального звена иммунитета у часто болеющих детей и детей с бронхиальной астмой (M±m)
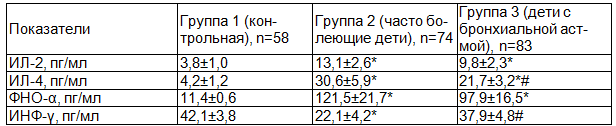
Анализ уровня интерлейкинов показал, что минимальной была концентрация ИЛ-2 в сыворотке детей контрольной группы 1 - 3,8±1,0 пг/мл, тогда как в группе 2 (часто болеющие дети) значение данного параметра было максимальным - 13,1±2,6 пг/мл, достоверно превышающим (p<0,05) соответствующий уровень в контроле (табл.4). У детей с бронхиальной астмой) концентрация этого цитокина также была значимо выше (p<0,05), чем в контроле - 9,8±2,3 пг/мл, но при этом не отличалась от таковой в группе ЧБД.
Оценка концентраций ИЛ-4 свидетельствовала о его существенном повышении (p<0,05) относительно уровня в контроле (4,2±1,2 пг/мл), у часто болеющие детей и детей с БА, соответственно до 30,6±5,9 и 21,7±3,2 пг/мл.
Концентрация ФНО-α у детей контрольной группы также была минимальной и составила 11,4±0,6 пг/мл, тогда как в группе 2 (часто болеющие дети) ее значение было на порядок выше (p<0,05) - 121,5±21,7 пг/мл. У детей с бронхиальной астмой уровень этого цитокина также был существенно выше (p<0,05) , чем в контроле 97,9±16,5 пг/мл, при этом значимо не отличаясь от соответствующего показателя в группе ЧБД.
Уровни ИНФ-γ в меньшей степени различались в группах обследуемых детей, составив к контрольной группе 42,1±3,8 пг/мл, у детей с БА- 37,9±4,8 пг/мл. В группе 2 (ЧБД) концентрация интерферона была значимо ниже (p<0,05), чем в остальных группах - 22,1±4,2 пг/мл.
Таблица 4. Концентрации цитокинов у часто болеющих детей и детей с бронхиальной астмой (M±m)
Заключение. Таким образом, проведенные исследования показали, что у обследованных детей наблюдаются сдвиги клеточного и гуморального иммунитета, которые проявляются у больных БА:
- снижением количества CD3+ лимфоцитов в периферической крови, повышением уровня CD4+ клеток (хелперов), снижением количества CD8+ лимфоцитов (супрессоров/цитотоксических), увеличением уровней CD19+ клеток (В-лимфоцитов), CD25+ лимфоцитов (несущих рецепторы в интерлейкину-2) и снижением количества CD16+ клеток - естественных киллеров; многократным увеличением уровня иммуноглобулина Е и повышением концентраций интерлейкинов 2, 4 и ФНО-α (при этом уровень интерферона-γ существенно не отличался от такового в контроле);
У часто болеющих детей:
- снижением количества CD3+ лимфоцитов, увеличением уровня CD19+ клеток, уменьшение уровня клеток с фенотипом CD16+ (естественных киллеров), повышением концентрации иммуноглобулинов M и G, увеличением уровня Ig E, повышением концентраций ИЛ-2, ИЛ-4 и ФНО-α наряду со снижением уровня ИНФ-γ.
Выявленные нами особенности клеточного и гуморального иммунитета согласуются с данными других авторов [4, 6, 11]. В частности, Рамазановой и др. (2005) установлено, что изменения состояния иммунной системы детей с БА и часто болеющих детей имеют одну направленность, но различную выраженность выявляемых сдвигов [6].
