Введение. Железо играет исключительно важную роль в биохимических процессах метаболизма, роста и пролиферации клеток, являясь обязательным и незаменимым компонентом различных белков и ферментативных систем организма. Наиболее распространенным проявлением дефицита железа является железодефицитная анемия (ЖДА), которая широко распространена среди детей. Около 800 миллионов людей, страдающих анемией, главным образом, сконцентрированы в Южной Азии, Центральной и Западной Африке [1].
Недостаточность железа является основной причиной анемии, хотя не во всех случаях анемия обусловлена недостаточностью железа, а при недостаточности железа не сразу проявляется анемия. Анемия может быть вызвана многими факторами: дефицитом железа, цинка, витамина В12 и фолиевой кислоты, глистной инвазией и малярией, а также наследственными нарушениями [2-3]. Оценить недостаточность железа в организме можно с помощью нескольких биохимических индикаторов, включая ферритин, растворимый белок рецептора трансферрина (рТФ) и гемоглобин. В среднем, распространенность недостаточности железа встречается в разы чаще, чем ЖДА.
В Кыргызской Республике медико-демографическим исследованием (МДИ) [4] установлено, что 42,6% детей в возрасте от 6 до 59 мес. страдают анемией. Однако в ходе МДИ оценивалась только распространенность анемии в целом, измеренная экспресс-фотометром «Hemocue 201+» по уровню гемоглобина в капиллярной крови, без уточнения этиологии и учета сопутствующих факторов, например, воспаления.
Целью настоящей работы явилась оценка истинной распространенности ЖДА среди детей в возрасте 6-29 месяцев в Кыргызской Республике. Оценка проводилась на основе измерения дефицита железа в организме и с учетом возможного сопутствующего воспалительного процесса.
Методология и методы исследования. Объектом исследования явились дети в возрасте от 6 до 29-ти полных месяцев жизни. Для отбора детей применялась вероятностная двухступенчатая кластерная выборка.
На первом этапе проводилось отбор кластеров, где будет проводиться исследование. Республиканским медико-информационным центром МЗ КР был предоставлен список первичных медучреждений (групп/центров семейной медицины и фельдшерско-акушерских пунктов, далее ГСВ и ФАП) с количеством детей от 6 до 29 полных месяцев жизни, приписанных к каждой организации. Каждый ФАП/ГСВ стал «первичной единицей выборки» (ПЕВ).
На момент проведения обследования имелось 1599 ФАП и ГСВ. Выборка 80 ПЕВ была осуществлена с использованием вероятности пропорциональной размеру элемента выборки, то есть вероятность выбора ПЕВ зависела от количества детей в возрасте 6-29 месяцев, приписанных к ПЕВ.
На втором этапе выборки, из каждого отобранного ФАП/ГСВ были собраны списки всех детей, родившихся в период с 1 февраля 2011 г. по 31 января 2013 г. Из всех списков, предоставленных выбранными ФАП/ГСВ случайным методом, было отобрано по 30 детей - всего ожидалось 2400 детей, однако в одном отобранном ПЕВ было всего 22 приписанных ребенка. Таким образом, общее количество подлежащих обследованию детей оказалось равным 2392.
До начала полевого обследования медработники ФАП/ГСВ сообщали всем отобранным респондентам в каждой ПЕВ о дате и времени, когда они должны прийти в ФАП/ГСВ для участия в исследовании. Дети из списков, которые не пришли в медучреждение, должны были посещаться и обследоваться на дому. При этом замены не отобранных детей не допускались. Строгое соблюдение вышеописанных процедур отбора было призвано предотвратить неконтролируемое смещение выборки и искажение результатов.
Уровень гемоглобина измеряли экспресс фотометром HemoCue-301. Фотометр HemoCue-301 имеет встроенный контроль качества (самопроверка) и не нуждается в дополнительной калибровке. Лабораторный персонал собирал образцы капиллярной крови с использованием выдвижного ланцета одноразового использования. При проведении анализа, первая и вторая капли крови вытирались проспиртованной салфеткой, а только третья капля крови использовалась для измерения уровня гемоглобина фотометром.
Анемия диагностировалась при уровне Hb менее 110,0г/л с учетом поправки на высоту [5], которая вычиталась из показаний фотометра при статистической обработке данных.
Для исследования уровней ферритина, свободных рецепторов трансферрина (sTfR) и маркеров воспалительного процесса С-реактивного белка (СРБ) и α1-гликопротеиновой кислоты (AGP) проводили забор капиллярной крови в специальные микро-контейнеры с антикоагулянтом EDTA-2.
Для предотвращения гемолиза в образцах не допускалось выдавливание крови из пальца и соскребание крови с кожного покрова. Также не допускался контакт образцов крови с холодовыми элементами при траспортировке в контейнерах. Капиллярная кровь, собранная таким образом в микроконтейнеры с ЭДТА, немедленно помещалась в сумку-холодильник, где поддерживалась температура в пределах 4-10 °C.
Образцы крови в холодовых контейнерах доставлялись в лабораторию, где плазма выделялась на центрифуге и далее замораживалась при температуре -20°С. После завершения полевых исследований замороженные образцы крови отправлялись в сертифицированную лабораторию Германии для проведения биохимического анализа на ферритин, sTfR, СРБ и AGP.
Так как в процессе воспаления/инфекции происходит повышения уровня ферритина (и снижение уровней ретинола и РСБ), то недостаточность железа, измеренная по сывороточному ферритину, будет занижена, если не учитывать фактор воспаления.
Дефицит железа определялся при уровне ферритина менее 12 мкг/л и sTfR более 8,3 мг/л. Критериями ЖДА были Hb<110г/л, ферритин<12 мкг/л и sTfR>8,3 мг/л.
Наличие инфекционного агента исключалось при уровне СРБ≤5 мг/л и AGP≤1,0 г/л.
На стадии статистической обработки данных, для исключения ошибок ввода, применялся двойной ввод. Образовавшиеся две базы данных сверялись на тождественность и в случае расхождения проводилась сверка с «бумажной» информацией и соответствующая корректировка базы данных.
Анализ получившейся сводной базы данных был проведен с помощью программного обеспечения «SPSS» (версии 17 и 19). Коэффициенты взвешивания, доверительные интервалы и дизайн-эффекты для основных переменных были рассчитаны автоматически, с учетом применявшегося метода отбора (а именно, двухступенчатой кластерной выборки). Ввод данных и расчеты статистических показателей были проведены специалистами Национального статистического комитета Кыргызской Республики.
Результаты и обсуждение. Исследованием было охвачено 2156 детей в возрасте 6-29 месяцев, что соответствует 90,1% от количества отобранных детей. Из общего количества необследованных детей необследованны по причинам временного отсутствия ребенка дома в 36,9% случаев, в связи со сменой места жительства - в 24,7% случаев. ребенок оказался старше или младше необходимого возраста - в 17,6% случаев, по причине отказа родителей от участия - 14,9%, по другим причинам -5,9%.
Показатели недостаточности железа, анемии и железодефицитной анемии были рассчитаны для всех участников и далее стратифицированы по наличию воспаления. По результатам исследования биохимических маркеров воспалительного процесса (СРБ и AGP) у 1436 (66,6%) детей отсутствовало сопутствующее острое воспаление.
Анемия обнаружена у почти каждого третьего ребенка (табл. 1). После внесения поправок на высоту над уровнем моря, в целом распространенность анемии составила 32.7%, в том числе 29.5% среди детей без признаков воспаления. При этом необходимо отметить, что распространенность анемии среди детей после двух лет жизни на 10,6 процентных пункта ниже, чем среди детей в возрасте от 6-ти до 24-х месяцев. Мальчики страдают анемией несколько чаще, чем девочки.
Таблица 1. Распространенность анемии среди детей в возрасте 6-29 месяцев
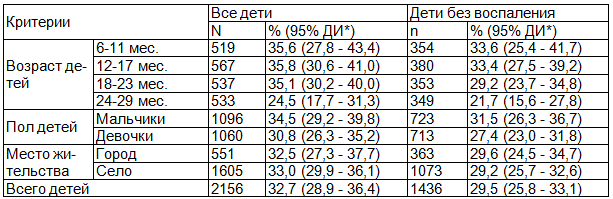
Примечание: здесь и далее ДИ * - доверительный интервал.
У детей без сопутствующего острого воспаления распространенность анемии несколько ниже, что указывает на определенную роль воспалительного процесса в генезе анемии (χ2=4,092, P<0,05; χ2 с поправкой Йейтса=3,945, P<0,05; χ2 с поправкой на правдоподобие=4.109, P<0,05).
Уровень недостаточности железа, измеренный по ферритину, составил 34.2% (в том числе 39.7% среди детей без воспаления), а измеренный по sTfR составил 39.3% (в том числе 38.9% среди детей без воспаления). Распространенность дефицита ферритина среди детей без биохимических маркеров воспаления была выше (табл. 2), чем среди всех детей (χ2=11,226, P<0,01; χ2 с поправкой Йейтса=10,990, P<0,01; χ2 с поправкой на правдоподобие=11,187, P<0,01).
Таблица 2. Распространенность низкого ферритина среди детей в возрасте 6-29 месяцев
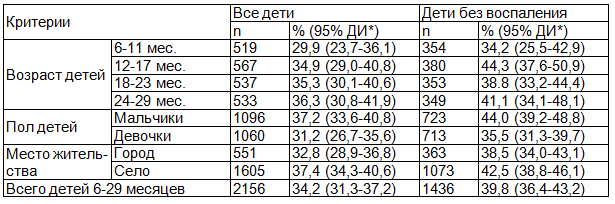
Очевидно, что низкие показатели распространенности дефицита ферритина - белка острой фазы воспаления среди всех детей были обусловлены повышенным содержанием его в плазме крови у детей с сопутствующим воспалительным процессом.
Распространенность повышенного уровня sTfR среди всех детей (39,3% при 95% ДИ 35,6 - 43,1%) и среди детей без биохимических маркеров воспаления (38,9% при 95% ДИ 34,6 - 43,1%) не имела достоверного различия (χ2=0,053, P>0,05; χ2 с поправкой Йейтса=0,038, P>0,05; χ2 с поправкой на правдоподобие=0,053, P>0,05).
Общая недостаточность железа, определенная либо по низкому уровню ферритина, либо высокому уровню sTfR, в целом составили 48,0% среди обследованных детей, в том числе 49,8% среди детей без признаков воспаления.
Распространенность ЖДА в целом составила 23.6% (табл. 3), в том числе 22.4% среди детей без признаков воспаления. Распространенность ЖДА среди детей в возрасте 6-29 месяцев была значительно ниже (χ2=41,579, P<0,01; χ2 с поправкой Йейтса=41,142, P<0,01; χ2 с поправкой на правдоподобие=41,711, P<0,01), чем распространенность анемии.
Таблица 3. Распространенность железодефицитной анемии среди детей в возрасте 6-29 месяцев
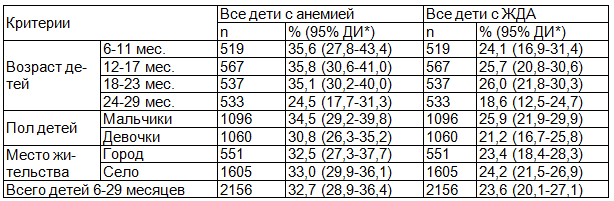
Наибольшая распространенность анемии и ЖДА определена среди детей в возрасте от 6 до 23 месяцев, у которых показатели соответственно на 11,1 и 5,5 процентных пункта были выше, чем у детей в возрасте 24-29 месяцев (табл. 3). Анемия и ЖДА чаще диагностировалась среди мальчиков, чем среди девочек. Распространенность анемии и ЖДА среди городских и сельских детей была примерно одинаковой. В структуре анемий удельный вес ЖДА составил 72,7%.
Заключение. Таким образом, установлено, что 32,7% детей страдают анемией и 23,6% детей - железодефицитной анемией (ЖДА). Общий дефицит запасов железа был обнаружен у почти половины обследованных детей. Распространенность анемии и ЖДА среди детей в возрасте от 6 до 23 месяцев была выше, чем среди детей в возрасте 24-29 месяцев. ЖДА чаще диагностируется у мальчиков, чем среди девочек.
Удельный вес ЖДА составил 72,7% в структуре всех анемий, хотя в литературе имеются данные о том, что у детей раннего возраста на долю ЖДА приходится 90% [6]. Данный факт требует проведения дальнейших исследований в целях расшифровки генеза анемии у 1/3 детей в возрасте 6-29 месяцев, проживающих в разных регионах Кыргызской Республики, и дифференцированных подходов к организации профилактических мероприятий.
Анемия и высокий уровень ферритина чаще регистрируются при наличии сопутствующего воспаления. Следовательно, для изучения истинной распространенности дефицита запасов железа в организме по уровню ферритина следует параллельно проводить исследование биохимических маркеров воспаления. В наших исследованиях содержание в плазме крови sTfR от наличия или отсутствия сопутствующих маркеров воспаления не зависело.
Выражение благодарности. Автор выражает свою искреннюю признательность лаборантам, водителям, интервьюерам и сотрудникам статистического комитета, участвовавшим в сборе и обработке данных обследования, специалистам Центра по контролю заболеваемости США под руководством г-жи М. Сердула и Детского Фонда ООН в Кыргызской республике под руководством д.м.н. Ч.А. Иманалиевой, без финансовой и технической поддержки которых данное обследование было бы невозможно, а также д.м.н, проф. Т.Т. Мамырбаевой за ее направляющую роль, неустанную поддержку и ценные советы.
