В последние десятилетия получены данные, свидетельствующие о том, что иммунная система человеческого организма тесно интегрирована с его нейроэндокринной системой и всеми системами гомеостаза на протяжении всей жизни индивидуума [1]. В постнатальном периоде нейроиммуноэндокринное кооперирование обеспечивает адаптацию ребенка к постоянно меняющимся условиям внешней среды. Соответственно от того, насколько оптимально складываются условия для морфофункционального созревания иммунной и нейроэндокринной систем детского организма и механизмов их взаимодействия в первые годы жизни ребенка зависят, в частности, эффективность адаптивного процесса и сопротивляемость к инфекциям как один из важнейших аспектов адаптации.
Соответственно склонность детей к возникновению повторных респираторных заболеваний и длительному их течению формируется именно в раннем возрасте в результате воздействия различных неблагоприятных факторов, которые приводят к развитию тканевой гипоксии, активации процессов перекисного окисления липидов (ПОЛ) и другим сдвигам в гомеостазе, нарушают нормальный ход развития детского организма и истощают резервные возможности его адаптационных систем [2].
В настоящее время получено большое количество экспериментальных и клинических данных, позволяющих считать, что микробиота толстого кишечника, обладая мощным потенциалом воздействия на нервную, эндокринную, иммунную и другие системы детского организма, принимает непосредственное участие в их созревании, функционировании и, что особенно важно, в их взаимодействии в постнатальном периоде, прежде всего при реализации адаптивных реакций в ответ на различного рода стрессы, в том числе инфекцию [3,4].
При дисбиозе кишечника возникают нарушения в работе мукозальной иммунной системы и системы иммунитета в целом, что способствует развитию не только заболеваний кишечника инфекционной и аллергической природы, но и повторных инфекционных заболеваний дыхательных путей, ЛОР-органов и урогенитального тракта [5].
Следует отметить, что нарушения в составе кишечного микробиоценоза являются предвестниками изменений в физиологическом статусе организма, связанными с хронической интоксикацией, аллергизацией, развитием метаболических расстройств, тканевой гипоксии, иммунных и нейрогуморальных нарушений [6].
Учитывая анатомо-физиологические особенности организма ребенка первых лет жизни, прежде всего, состояние его нейроэндокринной, иммунной, пищеварительной систем, интенсивно протекающие обменные процессы, быстрые темпы роста и развития становится очевидным, что у него значительно меньше резервных возможностей противостоять разнонаправленному дезадаптирующему воздействию патобиоценоза кишечника. При этом следствием этого воздействия являются нарушения генетически детерминированной программы созревания указанных выше адаптационных систем быстрого реагирования и их интеграции, дестабилизация гомеостаза, извращение хода биохимических реакций и физиологических процессов, что отражается на физическом, нервно-психическом развитии ребенка, его резистентности и заболеваемости [7].
В связи с чем, возникает необходимость более углубленного изучения состояния микроэкологии кишечника у детей с разным уровнем и характером респираторной заболеваемости, прежде всего в период ее интенсивного становления, в раннем возрасте, что позволит своевременно проводить коррекцию дисбиотических нарушений и предупреждать их последствия, в том числе частые острые респираторные заболевания (ОРЗ) и их осложненное течение.
Целью настоящего исследования явилось изучение состояния микрофлоры толстого кишечника у часто и эпизодически болеющих респираторными заболеваниями детей раннего возраста для оценки патогенетической значимости дисбиоза кишечника в формировании этого контингента больных.
Материалы и методы. На базе школы респираторного здоровья, организованной совместно кафедрой пропедевтики детских болезней РостГМУ и детской городской больницей № 2 г. Ростова-на-Дону, проводилось наблюдение и обследование 96 детей раннего возраста из группы часто и длительно болеющих респираторными заболеваниями (ЧДБД). Среди них 39 детей (40,6%) были в возрасте от 1 до 2 лет и 57 (59,4%) в возрасте от 2 до 3 лет. Группу сравнения составили 28 детей второго-третьего года жизни, болевших респираторными заболеваниями в предшествующие годы эпизодически (1-3 раза в год). В соответствии с целью работы всем детям основной группы и группы сравнения было проведено исследование состава просветной микрофлоры толстого кишечника стандартным микробиологическим методом в период клинического благополучия, через 3 и более недель после последнего эпизода ОРЗ. Статистическую обработку полученных данных проводили с использованием пакета прикладных программ Statistica 6.0. Достоверность различий определяли с помощью параметрических (Стьюдента) и непараметрических (Манна-Уитни и Вилкоксона) критериев.
Результаты и обсуждение. При изучении анамнеза жизни установлено, что у матерей ЧДБД достоверно чаще по сравнению с матерями детей, болеющих эпизодически, отмечались хронические заболевания (79,2% и 42,9%, р<0,01), неблагоприятные исходы предыдущих беременностей (49% и 25%, р<0,05), осложненное течение настоящей беременности: гестоз I половины (57,3% и 35,7%,р<0,05), гестоз II половины (87,5% и 32,1%, р<0,001), ОРЗ (62,5% и 39,3%, р<0,05), угроза прерывания на различных сроках беременности (52,3% и 25%, р<0,01), анемия (43,8% и 17,9%, р<0,01). Необходимость в применении антибактериальных препаратов во время беременности так же более часто возникала у матерей детей основной группы, но различия с группой эпизодически болеющих детей (ЭБД) не достоверны (33,3% и 21,4%, р>0,05). Нарушения в составе микрофлоры влагалища в виде кольпита и вагинального кандидоза с более высокой частотой регистрировали у матерей ЧДБД (31,3% и 14,3%, р<0,05). Что касается течения родов, то частота оперативных родов была достоверно выше в основной группе (25% против 7,1%, р<0,05). В 51% случаев у матерей ЧДБД отмечалась слабость родовой деятельности с применением медикаментозной стимуляции, в 13,5% случаев - преждевременное излитие околоплодных вод. В группе ЭБД описанные акушерские осложнения не встречались. В отношении частоты встречаемости преждевременных, быстрых и стремительных родов в обеих группах исследования достоверных различий не обнаружено. Вместе с тем, дети из группы ЧДБД достоверно более часто рождались с обвитием пуповины (55,2% и 32,1%, р<0,05).
В настоящее время стали известны результаты научных исследований, доказывающих патогенетическую роль дисбиоза толстого кишечника и влагалища в развитии у женщин репродуктивного возраста патологии беременности, родов и послеродового периода [8]. На основании этих данных, высокую частоту встречаемости осложнений в течение перинатального периода у обследованных нами детей раннего возраста можно объяснить наличием у их матерей во время беременности дисбиотических нарушения в микроэкологической системе толстого кишечника и нижнего генитального тракта.
Обращает на себя внимание, что только 12,5% детей основной группы были приложены к груди сразу после рождения, что, по-видимому, связано с высокой частотой осложнений в течение беременности и родов. Для сравнения более половины детей из группы эпизодически болеющих были приложены к груди матери уже в родильном зале (57,1%, р<0,001). И именно в этой группе значительно чаще дети находились на естественном вскармливании до 1 года и более (42,9% против 14,6%, р<0,05). В то же время, 58,3% ЧДБД уже в первые 3 месяца жизни были переведены на искусственное вскармливание, а в группе ЭБД такой ранний перевод отмечался в 28,6% случаев.
Анализ заболеваемости детей обеих групп на первом году жизни показал, что кишечную инфекцию в грудном возрасте перенесли 37,5% детей из группы ЧДБД, что значительно чаще, чем в контрольной группе (17,9%, р<0,05). Нами не было выявлено различий в частоте развития у детей обеих групп клинических проявлений пищевой аллергии. И только в основной группе у детей на первом году жизни наблюдалось развитие железодефицитной анемии (19,8%) и рахита (7,3%).
Таким образом, у всех детей, вошедших в группу ЧДБД, и у существенной части ЭБД в анамнезе имеются указания на несоблюдение физиологических условий первичной микробной колонизации и формирования их микроэкологии во внутриутробном, интранатальном и постнатальном периодах. Следовательно, можно предполагать, что нарушения качественного и количественного состава микрофлоры кишечника предшествовали возникновению у детей повторных эпизодов респираторных инфекций.
При проведении объективного исследования полилимфоаденопатия, с преимущественным увеличением подчелюстных, передне- и заднешейных лимфатических узлов (до IVстепени), обнаружена у всех детей основной группы и в 57,1% случаев в группе сравнения. В группе ЧДБД в 37,5% случаев отмечалась гипертрофия небных миндалин I степени, в остальных случаях II степени. У 6% детей выявлены клинические признаки хронического тонзиллита (гиперемия и инфильтрация небных дужек, расширение лакун, казеозные пробки в лакунах). Гипертрофия небных миндалин у 19% ЧДБД сочеталась с клинически значимым увеличением носоглоточной миндалины. У всех ЭБД так же выявлена гипертрофия небных миндалин I степени. Клинические проявления кишечной дисфункции регистрировалась у 68,8% ЧДБД, что достоверно чаще, чем в группе ЭБД (46,4%, р<0,05). При этом у большей части ЧДБД отмечалась склонность к диарейному синдрому (63,6%) с появлением в каловых массах непереваренных комочков, слизи и зелени, резкого неприятного запаха. Реже родители предъявляли жалобы на запоры спастического характера (36,4%). В группе ЭБД кишечная дисфункция проявлялась склонностью к запорам.
Анализ респираторной заболеваемости детей основной группы показал, что склонность к повторному возникновению ОРЗ и длительному их течению у подавляющего большинства детей отмечалась уже на первом году жизни (81,3%). Обращает на себя внимание, что практически в половине случаев манифестации частой респираторной заболеваемости предшествовала перенесенная кишечная инфекция. Кратность эпизодов ОРЗ у детей основной группы составляла от 7 до 10 раз в год. При этом у 70% детей заболевания часто сопровождались развитием осложнений в виде простого или обструктивного бронхита, ангины, отита. Необходимо отметить, что респираторные инфекции у всех детей протекали достаточно длительно (до 10-14 дней), даже в случае отсутствия осложнений. При развитии осложнений продолжительность заболеваний увеличивалась до 3-4 недель. Соответственно необходимость в применении антибактериальных препаратов возникала от 2 до 4-5 раз в течение года.
На основании анализа клинико-анамнестических данных в основной группе нами были выделены 3 подгруппы пациентов в зависимости от характера клинического течения у них повторных респираторных заболеваний. В 1-ю подгруппу (n=29) вошли дети, у которых ОРЗ развивались часто, но протекали с поражением только верхних дыхательных путей (ВДП). 2-ю подгруппу (n=47) составили дети со склонностью к ОРЗ с развитием бронхита. 3-я подгруппа (n=20) представлена детьми со склонностью к ОРЗ с развитием тонзиллофарингита.
По результатам проведенного микробиологического исследования установлено, что дисбиотические изменения в составе просветной микрофлоры толстого кишечника имеют место у всех детей основной группы и группы сравнения, но степень выраженности дисбиоза у них различна. Так у детей часто и длительно болеющих респираторными заболеваниями в подавляющем большинстве случаев выявлен дисбиоз кишечника III степени (86,5%) и только в 13,5% случаев - II степени, преимущественно в 1-й подгруппе пациентов. В то же время, у большей части ЭБД отмечался дисбиоз кишечника I и II степени в 25% и 35,7% случаев соответственно, а дисбиоз III степени - у 39,3% детей.
Характер выявленных дисбиотических изменений в микробиоте толстого кишечника также имел отличия у ЧДБД в зависимости от их принадлежности к определенной клинической подгруппе и у ЭБД (табл. 1). У всех детей, склонных к повторным респираторным заболеваниям и длительному их течению, отмечались выраженные нарушения со стороны облигатной микрофлоры кишечника. Так у 85,4% обследованных ЧДБД выявлено снижение содержания бифидобактерий (<109КОЕ/г). При этом наиболее высокая частота обнаружения сниженного уровня бифидофлоры отмечалась у пациентов 2-й подгруппы (93,6%), и соответственно количество этих микроорганизмов было самым низким в кишечной микробиоте именно этой подгруппы больных (lg 6,34±1,3 КОЕ/г). У ЧДБД 1-й и 3-й подгрупп удельный вес бифидобактерий в микробиоценозе было так же ниже нормативных величин, но достоверно выше, чем у детей 2-ой подгруппы (p2-1<0,001, p2-3<0,01).
Лактобактерии обнаружены в составе кишечной микробиоты всех детей основной группы, но в 66,7% случаев наблюдалось снижение их количества (<106КОЕ/г). Наиболее низкий уровень лактофлоры отмечался у пациентов 3-й подгруппы (lg 3,2±0,6 КОЕ/г). При этом содержание лактобактерий было ниже нормы у 100% детей. Обращает на себя внимание, что у ЧДБД с неосложненным течением ОРЗ количество этих бактерий в большинстве случаев (79,4%) было в пределах нормы. При этом средний уровень их содержания в микроэкологической системе кишечника у детей этой подгруппы достоверно превышал таковой у ЧДБД других клинических подгрупп (p1-2,3<0,001). Типичная кишечная палочка отсутствовала в фекалиях обследованных детей раннего возраста, часто и длительно болеющих ОРЗ, в 51% случаев. Вместе с тем, статистически достоверных различий по этому показателю в подгруппах не было выявлено. В случаях обнаружения общее количество типичных эшерихий в составе микробиоты толстого кишечника у большей части детей было в пределах нормы. И только в 19,1% случаев, преимущественно в 3-й клинической подгруппе, отмечалось повышение уровня типичной кишечной палочки, но не более чем на 1 порядок. В то же время, у 67,7% детей основной группы были выделены лактозоотрицательные эшерихии или эшерихии со сниженными ферментативными свойствами в высоких титрах (107-1010 КОЕ/г). Частота обнаружения этих бактерий у ЧДБД 1-й и 2-й подгрупп была примерно одинаковой (75,9% и 72,3% соответственно), а у детей 3-й подгруппы достоверно меньше (45%, р<0,05). Однако эшерихии с гемолитической активностью, обнаруженные у 33,3% пациентов в значительном количестве (106-108 КОЕ/г), с наибольшей частотой (65%) встречались в составе кишечной микрофлоры именно ЧДБД 3-й подгруппы (р1-3<0,05, р2-3<0,01). Содержание энтерококков только у 21,3% детей 2-й подгруппы превышало нормальные величины (>108 КОЕ/г). В остальных случаях удельный вес этих бактерий соответствовал норме.
На фоне дефицита представителей облигатной микрофлоры, особенно бифидобактерий и лактобактерий, в микроэкологической системе кишечника ЧДБД отмечалась высокая частота обнаружения различных условно-патогенных микроорганизмов (УПМ) в значительном количестве. Наиболее часто (в 58,3% случаев) из представителей факультативной флоры у ЧДБД выделяли клебсиеллы. При этом самая высокая частота их обнаружения отмечалась у пациентов 2-й подгруппы (68,1%, р2-3<0,05). Количество клебсиелл в кишечной микробиоте всех детей основной группы значительно превышало норму, но именно при наличии у детей склонности к осложненному течению ОРЗ удельный вес этих микробов был наиболее высоким, достоверно выше, чем у ЧДБД с неосложненными формами респираторных инфекций (р<0,01). Вместе с тем, частота выделения клебсиелл у пациентов 1-й подгруппы так же была достаточно высокой (55,2%) и существенно превышала соответствующий показатель в 3-й подгруппе ЧДБД (40%).
Дрожжеподобные грибы рода Candida обнаружены у 35,4% детей из группы часто и длительно болеющих респираторными заболеваниями в небольших титрах (102-103 КОЕ/г) без существенных различий между группами в среднем уровне и частоте встречаемости. Но у 41,6% детей основной группы они колонизировали толстый кишечник в более высоких титрах (104-108 КОЕ/г). С наибольшей частотой грибы рода Candida в значительных количествах обнаруживали в кишечном микробиоценозе ЧДБД 3-й подгруппы (55%),что достоверно чаще по сравнению с 1-й подгруппой пациентов (24,1%, р1-2,3<0,05). Однако интенсивность колонизации биотопа этими микроорганизмами в обеих подгруппах больных была практически одинаковой. Вместе с тем, у детей 2-й подгруппы удельный вес дрожжеподобных грибов рода Candida был достоверно более высоким (р2-3<0,001).
В 53,1% случаев в кишечном микробиоценозе ЧДБД встречался золотистый стафилококк. Наиболее часто S. aureus выделяли у больных 1-й подгруппы (82,8%), что существенно превышало частоту его обнаружения у детей 2-й подгруппы (27,7%, р<0,001) и в меньшей степени - 3-й (65%, р>0,05). Однако удельный вес золотистого стафилококка в кишечной микрофлоре 1-й подгруппы ЧДБД при самой высокой частоте обнаружения был наименьшим (lg 3,63±0,7 КОЕ/г). А достоверно более высоким, чем в других клинических группах ЧДБД, количество S. aureus было в кишечнике пациентов 3-й подгруппы (р<0,05). Что касается коагулазоотрицательных стафилококков (КОС), то они обнаружены в составе микроэкологической системы толстого кишечника у 41,7% ЧДБД, в большинстве случаев в небольших титрах (до 104 КОЕ/г). И только у 8,5% пациентов 2-й подгруппы и 30% - 3-й подгруппы их количество было повышено. Причем необходимо отметить, что в 3-й подгруппе ЧДБД КОС встречались только в высоких титрах и соответственно в этой подгруппе больных их удельный вес достоверно превышал таковой у детей других клинических подгрупп.
Клостридии обнаружены в составе кишечной микрофлоры только ЧДБД со склонностью к осложненному течению ОРЗ в 34% и 60% соответственно, но только у 17% 2-й подгруппы пациентов их количество превышало 105 КОЕ/г. Энтеробактер встречался в микробиоте толстого кишечника у 20,7% ЧДБД из 1-й подгруппы (lg 7,3±0.75 КОЕ/г). Протей и синегнойную палочку выделяли только у пациентов 2-й подгруппы с практически одинаковой частотой в количестве lg 4,13±0,64 КОЕ/г и lg 3,71±0,49 КОЕ/г соответственно.
Таблица 1. Состояние микрофлоры кишечника у часто и длительно болеющих респираторными заболеваниями детей раннего возраста
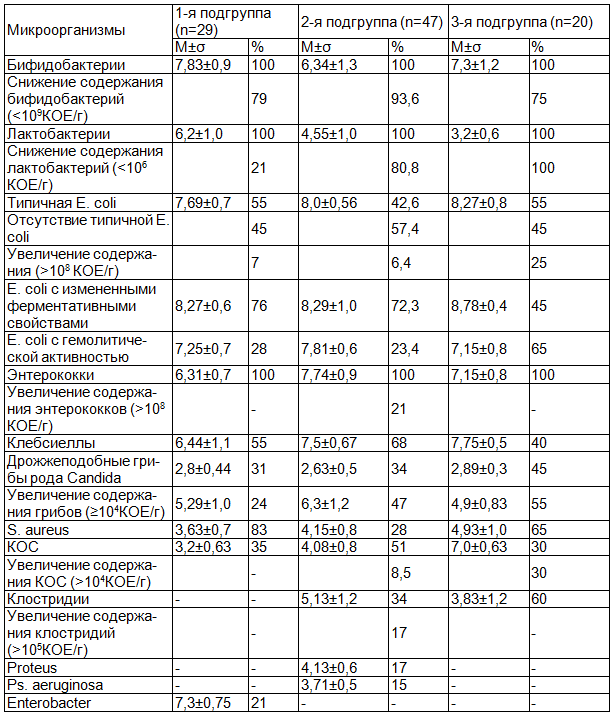
Таким образом, у большинства (65,5%) ЧДБД с ОРЗ с поражением ВДП был выявлен дисбиоз кишечника III степени, а в 34,5% случаев - дисбиоз кишечника II степени (p1-2,3<0,001). Вместе с тем, у детей 1-й подгруппы регистрировали наиболее высокий уровень основных представителей облигатной группы симбионтов биотопа (бифидобактерии и лактобактерии), а также более низкую частоту обнаружения и/или количество УПМ (клебсиеллы, грибы рода Candida, S. aureus).
Дисбиоз кишечника у детей 2-й подгруппы характеризовался выраженным дефицитом основных облигатных симбионтов биотопа в сочетании с увеличением частоты выделения и количественного уровня грамотрицательных (клебсиеллы, протей, синегнойная палочка, гемолитические и лактозонегативные штаммы эшерихий) и грамположительных (клостридии, S. aureus) УПМ с преобладанием в структуре микробных ассоциаций у большей части пациентов грамотрицательных бактерий. Вместе с тем, при дисбиозе кишечника, сопровождающегося увеличением пула грамотрицательных УПМ, иммунитет к их эндотоксину полностью утрачивается, что приводит к системной эндотоксинемии [9]. Эндотоксины, поступая в кровь, провоцируют развитие цитокинового каскада, функциональное перенапряжение медиаторных систем гомеостаза, блокаду тканевого дыхания, что способствует возникновению дисфункции иммунокомпетентных клеток и отклонениям в различных звеньях иммунного ответа [3]. Кроме того, у ЧДБД 2-й подгруппы с высокой частотой обнаруживали грибы рода Candida (преимущественно в значительных количествах) и все исследуемые вирусы (в высокой концентрации), которые также обладают выраженным иммуносупрессивным действием.
У ЧДБД 3-й подгруппы удельный вес бифидобактерий был снижен в меньшей степени, чем у детей 2-й подгруппы, а наиболее глубокие нарушения наблюдались со стороны лактобактерий, дефицит которых был значительно выражен в 100% случаев. Также отмечалась наиболее высокая частота обнаружения эшерихий с гемолитической активностью в значительных количествах. В составе факультативной микрофлоры кишечника ЧДБД 3-й подгруппы регистрировали преобладание грамположительных бактерий (S. aureus, КОС, клостридии). Экзотоксины, продуцируемые S. aureus и клостридиями, обладают фосфолипазной, гемолитической, коллагеназной, гиалуронидазной, ДНК-азной активностями. Это может приводить к повреждению мембран клеток организма, коллагена и гиалуроновой кислоты, являющихся основой различных тканей, а также нуклеиновых кислот [3]. Кроме того, у всех детей выделяли грибы рода Candida, усиливающие патогенный потенциал бактериальной флоры.
Достаточно выраженные нарушения в микрофлоре толстого кишечника обнаружены и в группе детей, болевших респираторными заболеваниями эпизодически (табл. 2).
Таблица 2. Состояние микрофлоры кишечника у эпизодически болеющих детей раннего возраста
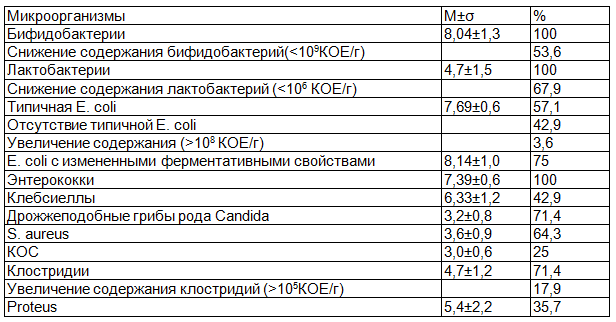
Частота обнаружения снижения количества бифидобактерий в составе кишечной микробиоты у них была значительно меньше (53,6%), чем у детей, склонных к частому возникновению ОРЗ. Но удельный вес бифидофлоры в группе сравнения так же, как и в основной группе, был ниже нормативных величин и достоверно превышал таковой только у ЧДБД 2-й подгруппы (lg 8,04±1,3 КОЕ/г, р<0,001). Кроме того, необходимо отметить высокую частоту обнаружения дефицита лактобактерий в составе микробиоты кишечника у ЭБД (67,9%). В связи с этим, средний уровень содержания лактофлоры у них был снижен и соответствовал таковому у пациентов 2-й подгруппы (lg 4,7±1,5 КОЕ/г). Более того, типичная кишечная палочка отсутствовала у ЭБД с частотой сравнимой с аналогичным показателем у ЧДБД 1-й и 3-й подгрупп (42,9%). На этом фоне в микроэкологической системе детей группы сравнения отмечалась высокая частота встречаемости (75%) E. coli с измененными ферментативными свойствами (107-1010 КОЕ/г), но гемолитические эшерихии у них не были обнаружены.
Из представителей факультативной микрофлоры кишечника у ЭБД с наибольшей частотой (71,4%) обнаруживали дрожжеподобные грибы рода Candida. Количество их в фекалиях детей группы сравнения не превышало 104 КОЕ/г (lg 3,2±0,8 КОЕ/г). Однако частота встречаемости грибов рода Candida в кишечной микробиоте ЭБД не отличалась от соответствующего показателя у ЧДБД. С такой же частотой (71,4%) в микроэкологической системе ЭБД регистрировали наличие клостридий, что достоверно чаще по сравнению с пациентами 2-й подгруппы (р<0,01). При этом в 17,9% случаев их уровень превышал 105 КОЕ/г. Золотистый стафилококк присутствовал в кишечнике ЭБД в 64,3% случаев, что практически совпадает с аналогичным показателем в 3-й подгруппе ЧДБД, но достоверно чаще, чем у пациентов 2-й подгруппы. Количество золотистого стафилококка в кишечной микрофлоре детей группы сравнения соответствовало таковому у ЧДБД 1-й подгруппы. Практически у половины ЭБД (42,9%) были выявлены клебсиеллы, что достоверно реже только по сравнению с 2-й подгруппой ЧДБД (р<0,05). При этом средний уровень содержания клебсиелл в кишечнике ЭБД, как и в случае с S. aureus, соответствовал удельному весу этих микроорганизмов в кишечной микробиоте пациентов 1-й подгруппы (lg 6,33±1,2 КОЕ/г). Обращает на себя внимание высокая частота обнаружения протея в фекалиях ЭБД (35,7%), что практически в 2 раза чаще, чем во 2-й подгруппе ЧДБД. Причем интенсивность колонизации этим микроорганизмом кишечника ЭБД также была более высокой (102-108 КОЕ/г).
Заключение. Полученные результаты свидетельствуют о том, что у ЧДБД раннего возраста нарушены физиологические условия формирования микроэкологической системы организма, что приводит к дисбиозу кишечника, а, следовательно, дезинтеграции адаптационных систем детского организма. Наибольший удельный вес факторов риска в биологическом анамнезе наблюдается у ЧДБД со склонностью к ОРЗ с развитием бронхита и тонзиллофарингита.
Обнаружена взаимосвязь особенностей клинического течения повторных ОРЗ у ЧДБД раннего возраста со степенью выраженности и характером микроэкологических нарушений в составе микробиоты кишечника. Следовательно, дисбиоз кишечника следует считать важным патогенетическим фактором снижения у детей раннего возраста антиинфекционной резистентности с формированием склонности к частому развитию респираторных инфекций и длительному, осложненному их течению. В связи с этим, рекомендуется проведение адекватной коррекции дисбиоза кишечника у ЧДБД раннего возраста с целью создания оптимальных условий для созревания у них иммунной системы и уменьшения частоты и продолжительности эпизодов ОРЗ.
В ходе проведенного исследования выявлено неблагополучие в состоянии микроэкологии толстого кишечника и в группе ЭБД, что позволяет сделать вывод об отсутствии у этих детей физиологических условий для созревания иммунной системы. В связи с чем, в дальнейшем высок риск перехода существенной части детей из группы эпизодически болеющих в категорию часто и длительно болеющих. Следовательно, дети этой группы также нуждаются в проведении мероприятий по коррекции выявленных микроэкологических нарушений с профилактической целью.
