Введение
Препараты растительного происхождения составляют около 25-30% лекарственных средств, представленных на мировом фармацевтическом рынке [3]. Фитотерапия по-прежнему сохраняет высокие позиции в лечении различных заболеваний благодаря оптимальному сочетанию результативности и безопасности применения многих препаратов растительного происхождения [4]. Наиболее часто фитопрепараты используют в качестве муколитических, противовоспалительных, антимикробных, мочегонных, седативных средств [3, 5]. Фармакологическая активность растений обусловлена наличием биологически активных веществ таких групп как полисахариды, флавоноиды, фенолкарбоновые кислоты, эфирные масла, органические кислоты, каротиноиды, витамины, дубильные вещества. В разной степени данные вещества оказывают противовоспалительное, антимикробное, отхаркивающее, иммуностимулирующее действие. Их лечебный эффект повышается, дополняя и корригируя друг друга [1, 10]. Преимуществом лекарственных растений является их малая токсичность и возможность длительного применения без существенных побочных явлений, широкий спектр действия, невысокая стоимость [2, 6].
Целью настоящего исследования явилась оценка острой и хронической токсичности лекарственного растительного сырья – тимьяна ползучего травы, солодки голой и алтея лекарственного корней, мать-и-мачехи и подорожника большого листьев.
Материалы и методы
Оценку острой и хронической токсичности лекарственного растительного сырья (солодки корней, тимьяна травы, алтея корней, подорожника листьев, фиалки трехцветной травы, мать-и-мачехи листьев) проводили в экспериментах на мышах массой 20±0,5 г обоего пола линии Balb/с (n=40).
Подопытных животных содержали в условиях вивария (с естественным режимом освещения; при температуре 22-24°С; относительной влажности воздуха 40-50%) с использованием стандартной диеты (ГОСТ Р 50258-92). Исследования проводили в соответствии с правилами качественной лабораторной практики (GLP) при проведении доклинических исследований в РФ, а также правилами и Международными рекомендациями Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях. Перед постановкой эксперимента животные проходили карантин в течение 10-14 дней [8,9].
Настои из лекарственного растительного сырья (солодки корней, тимьяна травы, алтея корней, подорожника листьев, фиалки трехцветной травы, мать-и-мачехи листьев) получали в соответствии с требованиями ГФ.
Острую токсичность водных извлечений из лекарственного растительного сырья оценивали при внутрижелудочном введении мышам по методу В.Б. Прозоровского и М.П. Прозоровской (1980). Эксперименты выполнены с использованием мышей линии Balb/с обоего пола массой 20±0,5 г (n=40). Препараты испытывали в дозах 2500 мг/кг (50 мг/мышь), 5000 мг/кг (100 мг/мышь), 10000 мг/кг (200 мг/мышь) и 20000 мг/кг (400 мг/мышь). Логарифмы значений этих доз отличались на 0,3. Перед введением сухой остаток настоев лекарственного растительного сырья суспензировали в 1% растворе желатина. Извлечения из лекарственного растительного сырья вводили подопытным животным однократно внутрижелудочно с помощью специального зонда. Животные контрольной группы получали изотонический раствор натрия хлорида.
Общая продолжительность наблюдения за животными при исследовании острой токсичности составила 14 дней, причем в первый день после введения животные находились под непрерывным наблюдением. Регулярно фиксировали общее состояние животных, состояние шерстного покрова. В каждой группе учитывали число смертельных исходов в течение всего срока наблюдения. По результатам эксперимента рассчитывали значение LD50.
При оценке хронической токсичности водные извлечения из растительного сырья вводили подопытным животным ежедневно внутрижелудочно (с помощью специального зонда) в течение месяца в дозе равной 1/20 LD50. Подопытные животные были разделены на 5 групп: первой группе вводили водные извлечения из листьев подорожника большого, второй группе – настой корней алтея лекарственного, животным третьей группы – настой листьев мать-и-мачехи, четвертой – настой травы тимьяна, пятой– настой корней солодки.
Животные контрольной группы получали изотонический раствор натрия хлорида.
На протяжении всего опыта животные находились под ежедневным наблюдением: отмечали общее состояние мышей, изменение массы тела, состояние шерстного покрова. На 31-й день животных под эфирным наркозом забивали и взвешивали следующие внутренние органы: сердце, печень, почки и селезенку.
Результаты исследования обработаны статистически с применением стандартного пакета программ Microsoft Office Excel 2003. Для ряда выборок вычисляли среднюю арифметическую и среднюю квадратическую ошибку. Определение нормальности распределения переменных проводили на основании гистограмм распределения, величины асимметрии и эксцессы. Для оценки достоверности различий выборок, имеющих нормальное распределение, применяли параметрический t-критерий Стьюдента. За достоверное принимали различие при уровне вероятности 95% и более (p<0,05).
Результаты и обсуждение
Анализ результатов экспериментального исследования показал, то при внутрижелудочном введении мышам водных извлечений из ЛРС LD50 составило в среднем 7100 мг/кг (доверительный интервал 2380 – 13944 мг/кг). Было отмечено, что при внутрижелудочном введении исследуемого настоя в дозах 2500 мг/кг и 5000 мг/кг все животные выжили, тогда как при введении экстракта в дозах 10000 мг/кг и 20000 мг/кг погибли все подопытные мыши (табл. 1). Значение LD50 было определено на основании данных последовательности реакций в эксперименте (0, 0, 2, 2 из 2-х) по таблице средних эффективных доз и их ошибок при разных последовательностях реакций [7].
Так как дозы расположены в логарифмической шкале и ошибки исчислены в логарифмах, то при переходе к числовым значениям ошибок они оказываются разноликими. Ошибка, откладываемая в сторону больших доз, превышает ошибку, откладываемую в сторону меньших доз. Обе ошибки приведены в таблице в значении средних. Для определения доверительных границ LD50 каждую из ошибок умножали на коэффициент Стьюдента t (при 8 наблюдениях и вероятности ошибки 0,05 этот коэффициент равен 2,36).
-m = 7100 – 2000x2,36 = 2380
+m =7100 – 2900х2,36= 13944
Таблица 1. Результаты исследования острой токсичности водных извлечений из ЛРС
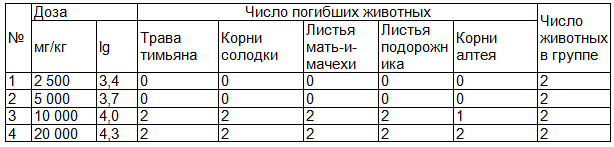
Таким образом, результаты исследования показали, что водные извлечения из тимьяна ползучего травы, солодки голой и алтея лекарственного корней, мать-и-мачехи и подорожника большого листьев можно отнести к веществам V класса – «Практически нетоксично».
При оценке хронической токсичности водные извлечения лекарственного сырья вводили подопытным животным в дозе 355 мг/кг в пересчете на сухое вещество, что составляет 1/20 LD50. Подопытные животные были разделены на 5 групп: в первой серии опытов подопытные мыши получали водные извлечения из листьев подорожника большого ежедневно три раза в день внутрижелудочно в течение месяца; во второй серии – настой корней алтея лекарственного по той же схеме, животные третьей серии – настой листьев мать-и-мачехи, четвертой – настой травы тимьяна, пятой серии опытов – настой корней солодки. Животные контрольной группы получали изотонический раствор натрия хлорида.
Было выявлено, что во всех сериях опытов в течение всего срока эксперимента состояние подопытных мышей было удовлетворительным, симптомов интоксикации и гибели животных не наблюдалось. Изменений внешнего вида животных, состояния шерстного покрова, потребления пищи отмечено не было. Изменения массы тела подопытных мышей достоверно не отличались от изменений массы тела у животных группы контроля (табл. 2).
Таблица 2. Динамика массы тела у мышей при введении терапевтических доз водных извлечений из ЛРС
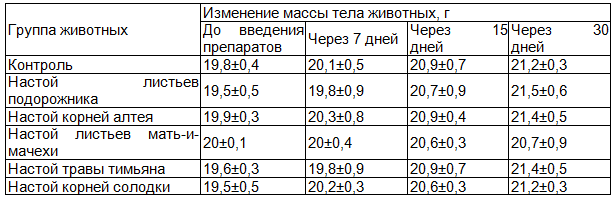
Следует отметить, что морфологических изменений внутренних органов (сердце, печень, почки, селезенка) обнаружено не было. Коэффициенты массы внутренних органов у подопытных мышей, получавших водные извлечения из ЛРС, достоверно не отличались от значений соответствующих показателей у животных группы контроля.
Таким образом, LD50 для водных извлечений из тимьяна ползучего травы, солодки голой и алтея лекарственного корней, мать-и-мачехи и подорожника большого листьев при внутрижелудочном введении мышам составила 7 100 мг/кг, доверительный интервал при этом находился в пределах 2380 – 13944 мг/кг. Согласно принятой классификации токсичности водные извлечения из ЛРС можно отнести к веществам V класса – «Практически нетоксично», что свидетельствуют о низкой токсичности лекарственных форм: настоев травы тимьяна ползучего, корней алтея лекарственного, корней солодки голой, листьев подорожника большого и листьев мать-и-мачехи при их курсовом применении.
Выводы
- Водные извлечения из тимьяна ползучего травы, солодки голой и алтея лекарственного корней, мать-и-мачехи и подорожника большого листьев можно отнести к веществам V класса – «Практически нетоксично», что свидетельствует о низкой токсичности этих лекарственных форм.
- При оценке хронической токсичности водные извлечения из растительного сырья согласно принятой классификации токсичности можно отнести к веществам V класса – «Практически нетоксично», что свидетельствуют о низкой токсичности данных лекарственных форм.
