Введение. Известно, что стрессы, неблагоприятная экологическая обстановка, неправильное питание оказывают негативное воздействие на желудочно-кишечный тракт (ЖКТ) человека, способствуя развитию ряда заболеваний [1]. Большая часть таких заболеваний сопровождается дисбактериозом кишечника [2]. В настоящее время одной из наиболее эффективных и безопасных технологий, применяемых при лечении и профилактике заболеваний желудочно-кишечного тракта, является применение пробиотических препаратов. Они используются также для нормализации микрофлоры после приема антибиотиков и иммуномодуляции [3-6]. Многочисленные исследования подтвердили эффективность использования пробиотиков в акушерстве, гинекологии, стоматологии, дерматологии, ревматологии, при заболеваниях опорно-двигательного аппарата, туберкулезе, сахарном диабете и т.д. [2]. Пробиотические и синбиотические препараты широко используются для профилактики и лечения аллергических заболеваний, обладают противовоспалительной активностью [7].
Столь широкий спектр терапевтической активности пробиотических препаратов можно объяснить содержанием в них веществ, способных противостоять окислительному стрессу – механизму, за счет которого реализуется множество патогенных эффектов на клеточном и организменном уровнях. Окислительный стресс развивается и при воспалении, сопровождающем заболевания ЖКТ.
Существуют данные о наличии у пробиотических препаратов (в частности, на основе лактобактерий, бифидобактерий и спорообразующих бацилл) антигенотоксической и антимутагенной активности. Показана способность пробиотических микроорганизмов снижать активность генотоксинов химической природы, таких, как N-метил-N-нитро-нитрозогуанидин, полиароматические углеводороды, афлатоксины и др. [8-10]. Известны данные и о способности данных препаратов снижать генотоксический эффект физических агентов [5]. Экспериментально показана способность пробиотических бактерий «перехватывать» активные формы кислорода (АФК) [11, 12]. Таким образом, представляется разумным строить стратегию лечения с помощью пробиотических препаратов, учитывая их антиоксидантные свойства.
В лаборатории ООО "Центр биомедтехнологий ЮФУ" был разработан пробиотический препарат Б-92 на основе штамма Bacillus subtilis В-1895.
Целью данной работы являлось исследование антиоксидантных свойств данного препарата при помощи биолюминесцентных биосенсоров.
Методика исследования. Bacillus subtilis В-1895 выращивали на поверхности соевых бобов в течение 2 суток при 420С (твердофазная ферментация). Затем бобы, покрытые биопленкой бактерий, измельчали и высушивали при комнатной температуре. Измельченный до порошкообразного состояния препарат, экстрагировали дистиллированной водой в течение 60 мин, затем аликвоты суспензии по 2 мл центрифугировали при 2000 об/с в течение 45 секунд. Надосадочную жидкость использовали для определения антиоксидантной активности.
В качестве индукторов окислительного стресса использовали перекись водорода («Ferrain»), метилвиологен (паракват) («Sigma») – внутриклеточный генератор супероксид-аниона и гидроксиметилхиноксалиндиоксид (диоксидин) («Sigma») – внутриклеточный генератор перекиси водорода и супероксид-аниона.
B качестве тест-объектов применяли биосенсоры на основе штаммов Eschеrichiа coli МGl655, содержащие плазмиды pKatG-lux и pSоxS-lux, несущие оперон Photorhabdus luminеsсens, отвечающий за люминесценцию и поставленный под контроль соответствующих промоторов katG и soxS [13].
Культуры выращивали в среде Луриа-Бертани (LB) [14] при 37⁰С. Ночную культуру разбавляли свежей средой до плотности 1 единица Мак-Фарланда (концентрация 3·108 клеток/мл), измерения проводились при помощи денситометра DEN-1B («Biosan»). Затем разбавляли суспензию еще в 10 раз и подращивали в течение 2 ч.
При исследовании антиоксидантных свойств водного экстракта препарата, аликвоты культуры по 160 мкл переносили в лунки планшета, часть из них служила контролем (в них добавляли 20 мкл деионизированной воды и 20 мкл водного экстракта сои; 20 мкл деионизированной воды и 20 мкл водного экстракта пробиотика). Часть лунок служило позитивным контролем (в них добавляли 20 мкл перекиси водорода (и диокисидина/параквата) и 20 мкл экстракта сои) в другие лунки вносили по 20 мкл экстракта препарата Б-92 и 20 мкл перекиси водорода (и диокисидина/параквата).
Измерение люминесценции проводилось на микропланшетном люминометре LM–01T (Immunotech, Чехия) согласно инструкции к прибору. Измерение проводилось в течение 2 часов с интервалом между измерениями 10 мин.
Определение антиоксидантной активности.
Фактор индукции SOS ответа (Is) вычисляли по формуле:
Is = Le/Lk ,
где Lk – интенсивность люминесценции контрольной пробы; Le– интенсивность люминесценции опытной пробы.
Показатель протекторной активности (А, %) вычисляли по формуле:
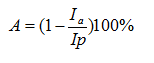
где Ia – фактор индукции биолюминесцентного ответа исследуемым воздействием в присутствии протектора; Ip– фактор индукции исследуемым воздействием.
Все эксперименты проводили в трех независимых повторностях.
Статистическую значимость отличия биолюминесценции в опыте от контрольных значений оценивали по t-критерию [15]. Статистическую обработку полученных результатов проводили по стандартным формулам.
Результаты и их обсуждение. Результаты исследований представлены на рис. 1 – 4 и в табл. 1.
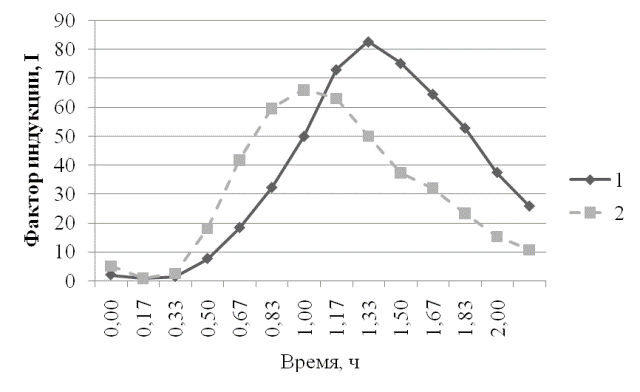
Рис. 1. Ответ штамма E.coli MG1655 (pKatG-lux) на действие перекиси водорода в концентрации 1∙10-3Мв присутствии экстракта пробиотика и экстракта сои: 1 - экстракт сои+H₂O₂ 10-3 М; 2 - экстракт препарата +H₂O₂ 10-3М.
Как видно из рис. 1, в присутствии экстракта пробиотика наблюдается снижение фактора индукции, вызванной перекисью водорода, по отношению к контролю (экстракт чистой сои).
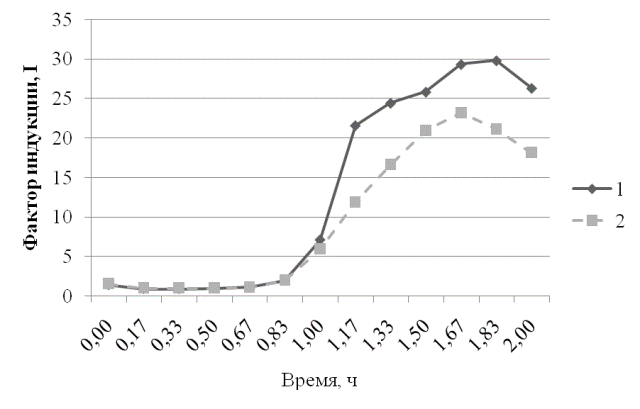
Рис. 2. Ответ штамма E.coli MG1655 (pKatG-lux) на действие диоксидина в концентрации 2,25∙10-5Мв присутствии экстракта пробиотика и экстракта сои: 1 - Экстракт сои+диоксидин 2,25∙10-5 М; 2 - Экстракт препарата+диоксидин 2,25∙10-5М.
Из графика, представленного на рис. 2, видно, что в присутствии экстракта пробиотика снижается уровень индукции, вызванной диоксидином.
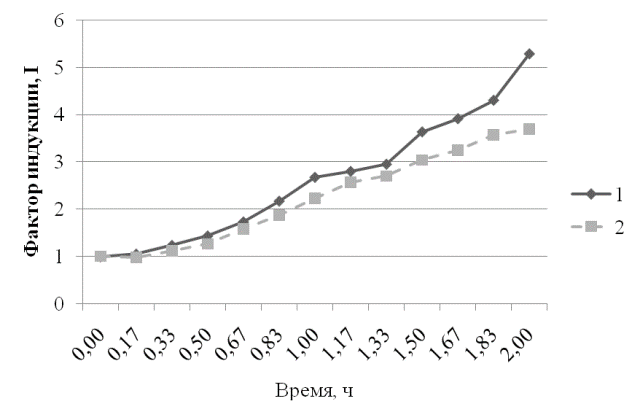
Рис. 3. Ответ штамма E.coli MG1655 (pSoxS-lux) на действие диоксидина в концентрации 2,25∙10-5Мв присутствии экстракта пробиотика и экстракта сои: 1 - Экстракт сои и диоксидин 2,25∙10-5 М; 2 - Экстракт пробиотика и диоксидин 2,25∙10-5М.
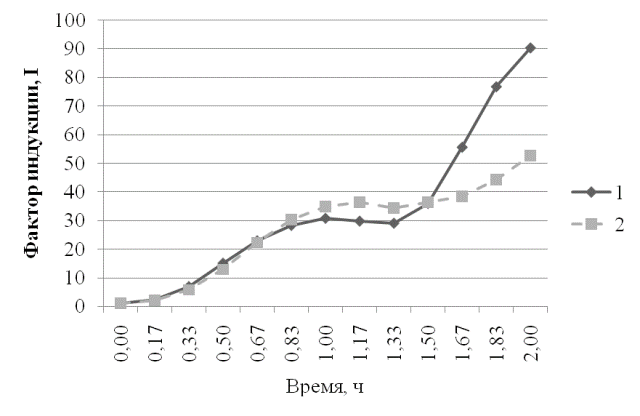
Рис. 4. Ответ штамма E.coli MG1655 (pSoxS-lux) на действие параквата дихлорида в концентрации 1∙10-3Мв присутствии экстракта пробиотика и экстракта сои: 1 - экстракт сои и паракват 1∙10-3 М; 2 - экстракт пробиотика и паракват 1∙10-3М.
Из графиков, представленных на рис. 3 и 4, видно, что в присутствии экстракта пробиотика снижается индукция, вызванная диоксидином и паракватом.
В табл. 1 представлены данные о максимальной антиоксидантной активности пробиотического препарата на основе бактерии Bacillus subtilis.
Таблица 1. Максимальная антиоксидантная активность пробиотического препарата
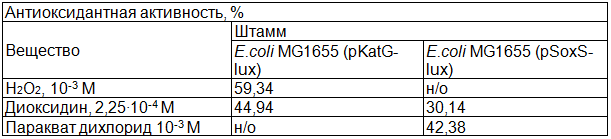
Примечание: н/о – не определялась.
Таким образом, нами показано, что водный экстракт пробиотического препарата обладает антиоксидантной активностью по отношению как к генератору супероксид-аниона параквату, перекиси водорода и диоксидину – способного стимулировать внутриклеточную генерацию как перекиси водорода, так и супероксид-аниона.
Антиоксиданты (АО) – природные или идентичные природным соединения, препятствующие окислению биомолекул. Введение в организм антиоксидантов снижает риск развития различных заболеваний, в том числе связанных с действием химических, физических, радиационных, бактериологических и других факторов окружающей среды.
По химической природе антиоксиданты представляют собой обширную и химически разнородную группу: к ним относят ферменты, фенолы и полифенолы, флавоноиды, стероидные гормоны и др. [16]. По принципу антиоксидантного действия выделяют АО косвенного и прямого действия [17]. Эффективность отдельных механизмов инактивации АФК не абсолютна, поэтому в ходе эволюции сформировался целый комплекс ферментативных и неферментативных механизмов для преодоления последствий окислительного стресса. Бактерии способны выделять сотни соединений, обладающих антиоксидантной активностью [18].
Из данных, полученных нами, можно видеть, что водный экстракт пробиотического препарата Б-92 обладает антиоксидантными свойствами.
Поскольку относительно высокая протекторная активность была обнаружена в опытах со штаммом – индикатором внутриклеточной генерации перекиси водорода, можно предположить, что значительную роль в реализации этих свойств играют низкомолекулярные антиоксиданты, взаимодействующие с эндогенными АФК.
Существуют данные, свидетельствующие о том, что смеси антиоксидантов могут проявлять более высокую УФ-протекторную активность, чем отдельные антиоксиданты, т.е. для таких смесей наблюдается синергетический эффект [19-21]. Данные об антиоксидантной активности пробиотиков позволяют предположить, что таковые свойства обеспечиваются комплексом как высокомолекулярных, так и низкомолекулярных антиоксидантов [22-26]. Идентификация этих соединений станет задачей наших дальнейших исследований.
Заключение. В результате проведенных исследований показано, что пробиотический препарат обладает антиоксидантными свойствами. Исследованный экстракт способен защитить клетку от прооксидантного действия параквата, снижая уровень генерации супероксид-анион радикала. Экстракт пробиотического препарата снижает уровень генерации супероксид– аниона при действии перекиси водорода и диоксидина.
Полученные результаты позволяют предположить, что пробиотический препарат проявит свой антиоксидантный эффект не только при взаимодействии с бактериальной культурой, но и в экспериментах с эукариотическими организмами.
Работа выполнена при финансовой поддержке Министерства науки и образования РФ (ФЦП «Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2007-2012 годы», Госконтракт № 16.512.11.2017).
