Актуальность. Термические поражения представляют собой серьёзную медицинскую, социальную и экономическую проблему, занимая третье место в структуре травматизма мирного времени [1,2]. При поверхностных ожогах восстановление кожного покрова проводится при помощи местного консервативного лечения, создающего благоприятные условия для их заживления. При пограничных ожогах IIIА степени мозаичность поражения кожи часто затрудняет самостоятельное заживление, особенно при обширных ожогах, когда за счет нарушений микроциркуляции и инфицирования эпидермальные производные находятся под угрозой гибели. В таких условиях раны могут «углубляться» [3,4].
При глубоких ожогах требуется проведение кожной пластики. Однако при обширных глубоких ожогах более 15-20 % поверхности тела возникает дефицит донорских ресурсов кожи, существенно затрудняющий возможность одномоментной пластики всех ожоговых ран. При этом образуется дополнительная кожная рана в месте забора лоскута [5].
Коррекция различных нарушений в организме пациента при обширных ожогах, как правило, невозможно без восстановления целостности кожного покрова. В связи с этим разработка альтернативных методов закрытия обширных ожоговых поверхностей в условиях дефицита донорских ресурсов остается одним из актуальных вопросов комбустиологии [6].
Новые подходы к решению проблемы дефицита донорских ресурсов, снижения травматичности хирургического лечения, сочетающегося с аутодермопластикой, для ускоренной реабилитации ожоговых больных при обширных термических поражениях наметились с развитием биотехнологии, когда появилась возможность получать жизнеспособные клетки и даже пласты этих клеток в лабораторных условиях [7].
В частности, для местного лечения ожоговых ран перспективным представляется применение клеточных культур фибробластов и продуцируемых ими билогически активных веществ [8]. Патогенетическая суть этой методики определяется стимулирующим влиянием трансплантированных на рану фибробластов на пролиферацию эпидермоцитов, сохранившихся в ране, и эпидермоцитов сетчатых лоскутов аутокожи. Такое влияние обусловливает ускорение процессов приживления аутодермотрансплантатов с большим коэффициентом перфорации за счет стимуляции процесса эпителизации ячеек [9].
При этом преимущественно использование аутоклеток: наблюдается длительный клинический эффект, исключен риск заражения пациента инфекционными агентами, а также риск развития аллергических реакций, не возникает трудностей с поиском подходящих доноров. Пересадку лучше производить в первые 3-е суток после ожоговой травмы, когда раневая поверхность хорошо защищена иммунными клетками от микробной инвазии [10].
Однако, механизмы, в результате действия которых формируются и восстанавливаются ткани, все еще недостаточно изучены, разработка методов лечения с использованием культивированных клеток кожи и ее эквивалентов требует совершенствования на всех этапах, начиная от формирования трансплантата и до его применения.
Цель работы: дать патогенетическое обоснование применения аутофибробластов, выращенных с применением обогащенной тромбоцитами плазмы и препарата корня солодки «Глицирам».
Материалы и методы исследования. Эксперименты проводились на лабораторных беспородных крысах обоего пола, массой 200-300 гр. Животные содержались в стандартных условиях при температуре 20-22ºС и обычном световом режиме. Доступ к воде и пище был свободный. Крысы получали сбалансированный по белкам и углеводам витаминизированный рацион.
В качестве модели термического поражения был использован предложенный Курамаевой У.К. [11] контактный способ нанесения ожога IIIA степени металлической насадкой к электропаяльнику 2х2 см, разогретой до 232оС, экспозиция 4 сек. Ожог наносился на межлопаточную область, после предварительного выбривания шерсти безопасной бритвой под кетаминовым наркозом.
После нанесения ожога у этой же крысы с наружной поверхности бедра брали биопсию 2х3х4 мм толщиной 0,2-0,3 мм (эпидермис и сосочковый слой дермы). Отсеченный кусочек погружается в заранее приготовленный флакон со средой. В качестве среды применялась DMEM + 10% FBS (Фетальная бычья сыворотка) + 20% обогащенная тромбоцитами плазма (ОТП) + «Глицирам».
После воздействия термического агента ожоговая рана была представлена коагуляционным струпом, который удалялся в пределах жизнеспособных тканей острым путем на третьи сутки (первичная дермальная тангенциальная некрэктомия). Гистологическая картина послойного кожно-мышечного лоскута соответствовала ожогу IIIА степени.
Пересадка культивированных аутофибробластов производилась непосредственно на рану после тангенциальной некрэктомии под кетаминовым наркозом на третьи сутки, сверху асептическая повязка, прочно фиксированная лейкопластырем. Для сравнения параллельно проводилось лечение ожоговых ран препаратом «Левомеколь» также после проведения тангенциальной некрэктомии на третьи сутки.
Распределение на группы проводилось следующим образом: 1-я группа – с ожогом IIIА степени после проведения тангенциальной некрэктомии, леченные мазью «Левомеколь»; 2-я группа – с ожогом IIIА степени после проведения тангенциальной некрэктомии с пересадкой на 3-и сутки культуры аутофибробластов, выращенных в среде с применением ОТП и «Глицирама».
Оценка состояния ожоговой раны проводилась на 1, 3, 7, 10, 15, 25, 40 сутки после нанесения ожоговой травмы и проведения курса лечебных мероприятий.
Для морфологического исследования кожи, производили иссечение ожоговой раны у крыс под кетаминовым наркозом. После чего края раны ушивали узловыми швами, так как хорошо мобилизированная кожа крыс позволяла выполнение такого варианта ликвидации ожоговой раны.
Полученный фактический материал подвергали компьютерной обработке с помощью пакета прикладных программ Microsoft Excel с учетом критерия Стьюдента.
Результаты и обсуждение. В процессе послеожогового восстановления эпидермальный слой в первой группе отсутствовал в 1-10 сутки, а затем превышал толщину эпидермиса интактной кожи, кроме того, отличался от нее формой клеток количеством и толщиной слоев.
Окончательная эпителизация зоны термического повреждения происходила лишь к 40 суткам, однако вновь сформированный эпителий был утолщен по сравнению с интактной кожей на 73%. Следует отметить, что происходила в основном краевая эпителизация.
Во второй же группе наблюдалась несколько иная картина. Активация пролиферативных процессов при лечении дермальными аутофибробластами приводит к нарастанию 1-2 рядного эпителия на 7-е сутки. Этому способствует прорастание многослойного плоского эпителия с краев раны и из кожных дериватов. Вновь сформированный эпидермис несколько утолщен (на 57%) по сравнению с интактной кожей, но наблюдалась дальнейшая нормализация как цифровых данных, так и структуры. И уже, начиная с 10 суток, наблюдалось формирование многослойного плоского эпителия и к моменту окончания лечения (приблизительно на 20 сутки) в этой группе ожоговая рана покрыта многослойным плоским эпителием с типичными слоями стратификации, ничем не отличающимся от окружающей интактной кожи.
Проведенное исследование выявило последовательные фазные изменения толщины слоев дермы в динамике термического ожога. На 3-и сутки после ожога толщина дермы превышала толщину интактной кожи на 15%. Затем в первой группе наибольшего утолщения дерма достигла к 7 суткам с последующим снижением воспалительной реакции и отека к 25 суток. Однако к 40 суткам наблюдалась иная картина, дерма была утолщена на 14% по сравнению с интактной кожей.
Во второй же группе отмечался максимум воспалительной реакции с отеком дермы также на 7 сутки, однако в дальнейшем отмечалась тенденция к снижению толщины дермы и к 15 суткам наблюдения толщина дермы приблизилась к толщине дермы интактной кожи с полным восстановлением этого показателя к 25 и к 40 суткам.
Характерны изменения и структурных составляющих дермы. На 3 сутки после ожога отмечается выраженная воспалительная реакция и отек. На 7-е сутки в группе с трансплантацией культивированных аутофибробластов отмечается тенденция к снижению воспалительной реакции и к 25 суткам наблюдения структура дермы восстановлена в большей степени, чем в группе, леченной мазью «Левомеколь», где даже к 40 суткам исследования дифференцировка дермы была еще не четкой, сосочки выражены слабо.
Одним из признаков начала дегенеративно-воспалительной стадии течения раневого процесса являлось начало формирования деморкационного вала, который начал формироваться еще на третьи сутки и к 7 суткам уже сформировался. В первой группе под деморкационным валом в сетчатом слое дезорганизованные, набухшие, разрыхленные коллагеновые волокна. Во второй же группе сохранялась отечность сетчатого слоя с выраженной фибробластической реакцией и участками коллагенообразования.
Изменение количественного и качественного состава клеточных элементов происходило с 1-х суток после получения термической травмы. К 3-м суткам в общей массе преобладали нейтрофильные лейкоциты и лимфоциты. К 7-м суткам в обеих группах сохраняется аналогичная картина, однако общее количество клеточных элементов во второй группе было больше, это связано со значительным ростом числа фибробластов и фиброцитов.
К 10 суткам в первой группе преобладающими клеточными элементами оставались нейтрофильные лейкоциты и лимфоциты, во второй же группе - это фибробласты и фиброциты, причем преобладали фиброциты, результатом чего являлась меньшая, чем в первой группе толщина новообразованной рубцовой ткани.
Очень важным прогностическим признаком, свидетельствующем о прогрессировании процессов репарации, является начало пролиферации фибробластических элементов, сначала периваскулярно, а затем и на границе с трансплантированной культурой фибробластов, обнаруживаемое уже на 10 стуки исследования.
В первой группе стихание деструктивных процессов происходило лишь к 25 суткам, когда фибробласты и фиброциты становятся преобладающими клеточными элементами. Во второй же группе к 25 суткам наблюдалась тенденция к нормализации клеточного состава дермы с минимальной клеточной реакцией.
К 40 суткам в первой группе сохранялась клеточная реакция в виде увеличения общего числа клеточных элементов на 68% со значительным количеством фибробластов и фиброцитов, что является признаком формирования грубого послеожогового рубца. Во второй же группе клеточный состав не отличался от клеточного состава интактной кожи.
В дерме наблюдалось выраженное расширение просвета сосудов микроциркуляции с увеличением их плотности в 1 и 3 сутки исследования. В первые несколько суток сохранялись микроциркуляторные расстройства, такие как периваскулярный отек, эритростаз, лейкостаз. Затем во второй группе наблюдалась тенденция к стиханию гиперемических проявлений и к 25 суткам достоверного отличия от интактной кожи не имела.
В первой же группе в начальные сроки наблюдалось значительное расширение сосудов микроциркуляции, эта тенденция продолжалась до 25 суток исследования. К концу исследования (на 40 сутки) сохраняющиеся процессы перестройки кровеносного русла привели к снижению диаметра и плотности сосудов микроциркуляции.
Во второй группе наблюдалось с 7-х суток появление тонкостенных новообразованных сосудов в более глубоких слоях дермы, из которых происходит их прорастание в более поверхностные слои, в первой же группе подобное явление происходило с 10-15 суток исследования, на 7 же сутки полностью отсутствовали новообразованные сосуды, более того, существующие сосуды были тромбированы.
Характерно на 10 сутки в группе лечения мазью «Левомеколь» появление сосудов регенерации синусоидного типа, количество и диаметр которых достиг максимума к 15 суткам, а затем наблюдалось их постепенное снижение с полным исчезновением только к 40 суткам.
Во второй же группе наличие сосудов регенерации синусоидного типа было отмечено еще на 7 сутки, когда наблюдалась максимальная их плотность и диаметр, с последующим снижением и практически полным исчезновением на 25 сутки исследования.
Наблюдались изменения прилегающего эпидермиса на 3 сутки, в обеих группах он раздражен. Это проявилось в виде баллонизирующей дистрофии, акантоза, что наблюдалось и на 7 сутки исследования, когда в прилегающем к зоне повреждения эпителии в обеих группах наблюдался акантоз, баллонизирующая дистрофия.
На 10 и 15 сутки в первой группе сохранялись изменения прилегающего к струпу эпителия в виде акантоза, баллонирующей дистрофии с образованием пузырей, паракератоза, спонгиоза. Во второй же группе вне зоны поражения не наблюдалось видимых признаков дезорганизации эпителия. К 25 суткам в группе леченной традиционным способом наблюдался паракератоз прилегающего к струпу эпителия. В группе же с пересадкой культивированных аутофибробластов не наблюдалось признаков дезорганизации эпителия.
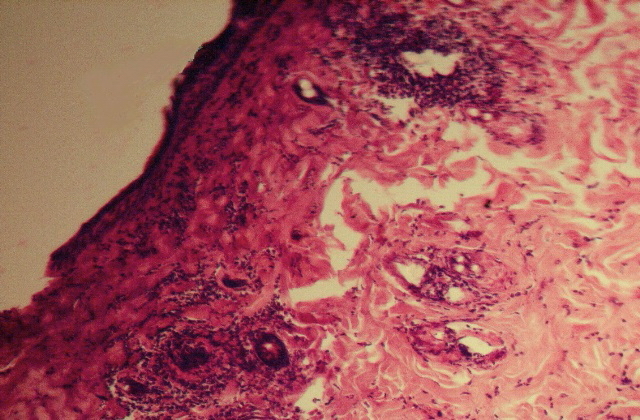
Рис. 1. Микрофото. Состояние ожоговой раны на 7-е сутки наблюдения. Лечение мазью «Левомеколь». Хорошо виден некротизированный эпителий, прилегающий эпителий раздражен, вокруг сосудов инфильтраты в виде муфт.
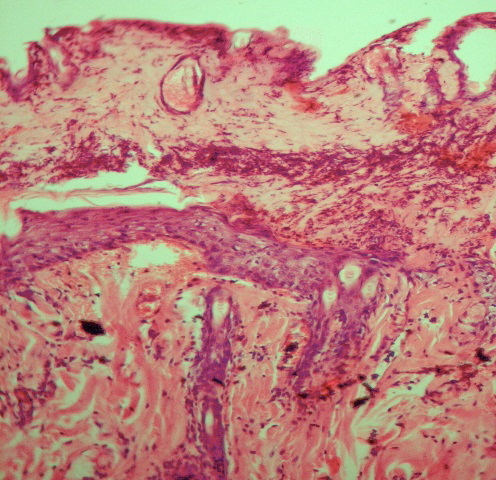
Рис. 2. Микрофото. Состояние ожоговой раны на 7-е сутки наблюдения. Лечение пересадкой дермальными аутофибробластами. Виден вновь образованный эпителий, большое количество сосудов регенерации синусоидного типа.
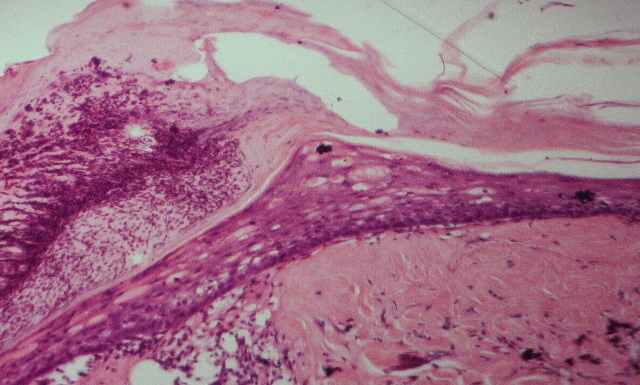
Рис. 3. Микрофото. Состояние ожоговой раны на 15-е сутки наблюдения. Лечение мазью «Левомеколь». Видна зона некроза, раздраженный эпителий, единичные сосуды регенерации синусоидного типа.
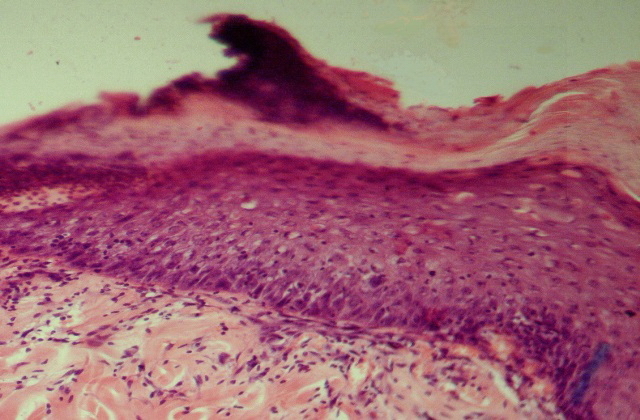
Рис. 4. Микрофото. Состояние ожоговой раны на 15-е сутки наблюдения. Лечение пересадкой дермальными аутофибробластами. Хорошо виден «молодой» подрастающий эпителий, сосуды регенерации синусоидного типа.
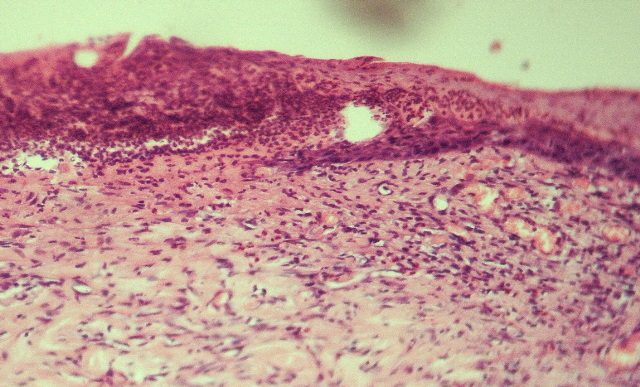
Рис. 5. Микрофото. Состояние ожоговой раны на 25-е сутки наблюдения. Лечение мазью «Левомеколь». Виден «молодой» эпителий, сосуды регенерации синусоидного типа.
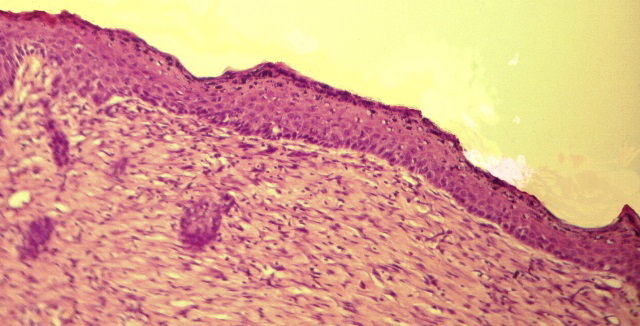
Рис. 6. Микрофото. Состояние ожоговой раны на 25-е сутки наблюдения. Лечение пересадкой дермальными аутофибробластами. Эпителий и дерма обычного строения.
Вывод. Таким образом, анализ количественных и качественных показателей, характеризующих течение регенераторных процессов, показал, что лечение ожоговых ран мазью «Левомеколь» не приводило к полноценному восстановлению структурно-функциональных свойств кожи, хотя и оказывало благоприятное влияние на регенераторные способности. Иная картина наблюдалась после применения культуры аутофибробластов, выращенных с применением ОТП и «Глицирама», где темп стихания воспалительного и начала репаративно-резорбтивных процессов в ожоговых ранах был несколько выше. И следствием этого является значительное ускорение процесса репарации. Это выражалось в ускорении смены фаз регенераторного процесса: сокращались сроки периода клеточной инфильтрации и ускорялся темп разрастания сосудистой сети и образования грануляционной ткани и быстрый переход раневого процесса в продуктивную фазу. Регенераторный процесс в ожоговых ранах без клеточной терапии также имеет место, но темп его был резко замедлен и протекал по типу подострого течения раневого процесса.
