Одним из новых перспективных направлений стало исследование окислительной модификации белков (ОМБ) при различных формах патологии. Окисление протеинов считается надежным маркером интенсивности протекания окислительного стресса in vivo, поскольку белки присутствуют во всех организмах [7, 9].
Особый интерес представляет окисление аминокислотных остатков с образованием карбонилов: альдегидных или кетонных производных основного и нейтрального характера [17]. На обнаружении образовавшихся дополнительных карбонильных групп основан самый распространенный метод определения продуктов окисления белков, в котором карбонильные производные реагируют с динитрофенилгидразином. Гидразоны, получаемые в ходе реакции, определяются фотометрически [9]. Согласно литературным данным, деградированные протеины могут находиться в клетке часами и даже в некоторых случаях днями, что позволяет рассматривать окисленные белки в качестве стабильных показателей окислительного стресса [7].
В настоящее время доказан факт участия оксида азота (NO) как в реакциях окислительного стресса, так и в механизмах антиоксидантной защиты. Разрушение окисленных протеинов рассматривается учеными как проявление вторичной антиоксидантной защиты в тканях [7].
Ввиду существования уже доказанной причинно-следственной связи между оксидативным и карбониловым стрессом [5] представляется интересным исследование ОМБ под действием модуляторов синтеза оксида азота.
Работа выполнена на 36 конвенциональных половозрелых крысах-самцах линии Wistar массой 280-320 граммов, разделенных на 3 экспериментальных и 3 контрольных группы. Животные содержались по 3-4 особи одного пола в металлических клетках площадью 24 дм2 при естественном освещении, получали воду и полноценный сухой комбикорм для лабораторных животных «Чара» (производство ЗАО «Ассортимент - Агро», Московская область, Сергиев-Посадский район, д. Тураково). Приготовление кормов для животных, расчет рациона осуществлялся сотрудниками вивария в соответствии с установленными нормами. Содержание животных в виварии соответствовало «Санитарным правилам по устройству, оборудованию и содержанию экспериментально-биологических клиник» от 06.04.1993. Содержание и выведение животных из эксперимента выполняли в соответствии с правилами, изложенными Международным Советом Медицинских Научных Обществ (CIOMS) в «Международных рекомендациях по проведению медико- биологических исследований с использованием животных» (1985 г.) и приказе МЗ РФ №267 от 19.06.2003 г. «Об утверждении правил лабораторной практики».
Экспериментальная группа № 1: осуществляли внутрижелудочное введение раствора L-аргинина («Sigma», США) на 0,9 % растворе NaCl в дозе 500 мг/кг [13] через стеклянный градуированный шприц с внутрижелудочным зондом. Объем вводимого раствора зависел от массы, и не превышал 1 мл. Препарат вводили 1 раз в сутки до утреннего кормления ежедневно в течение 10 дней. Выведение из эксперимента осуществляли на 11-е сутки.
Экспериментальная группа № 2: осуществляли внутрибрюшинное введение неселективного ингибитора NO-синтазы N-нитро-L-аргининметилового эфира (L-NAME, «Sigma», США) в дозе 25мг/кг [13] в виде водного раствора через переднюю брюшную стенку одноразовым пластиковым шприцем с тонкой короткой иглой. Объем вводимого препарата зависел от массы животного: 0,5 мл на 200 граммов животной массы. Препарат вводился 1 раз в сутки в утренние часы ежедневно в течение 7 дней. Выведение из эксперимента осуществлялся на 8-е сутки.
Экспериментальная группа № 3: осуществляли внутрибрюшинное введение L-NAME в указанных дозах с 3-и по 10-е сутки на фоне перорального введения L-аргинина. Животных выводили из эксперимента на 11-е сутки.
Контрольные группы формировались для каждой серии эксперимента из животных, сопоставимых по возрасту, полу, массе и условиям содержания с экспериментальными особями. Животным контрольной группы осуществляли введение физиологического раствора, при этом вариант введения, объемы раствора и продолжительность воздействия совпадают с таковыми для экспериментальной группы.
Для стандартизации условий опытов животных лишали пищи за 12 часов до забоя. Эвтаназия животных осуществлялась методом обескровливания под эфирным рауш-наркозом при сохраненном дыхании и сердцебиении. Немедленно после обескровливания осуществляли извлечение грудной аорты с помещением в охлажденный 0,25 М раствор сахарозы. Далее следовала очистка от соединительной, жировой ткани и сгустков крови; взвешивание ткани грудной аорты на электронных весах (AJH-220 CE, Япония) и гомогенизация с помощью аппарата «Potter S» (Sartorius, Германия) в охлаждённом 0,25 М растворе сахарозы в соотношении 1/10 в течение 60 секунд при скорости вращения тефлонового пестика 1500 об/мин и зазоре в пределах 0,16-0,24 мм. Описанные процедуры проводили при температуре не выше 4ºС.
Гомогенаты центрифугировались в течение 10 мин при 800 g (центрифуга CM-6M ELMI, Латвия) для осаждения не полностью разрушенных клеток и ядер. Надосадочную жидкость отбирали и центрифугировали 15 мин при 14000 g для удаления митохондрий, а затем полученный супернатант - дополнительно при 20000 g в течение 30 мин (центрифуга рефрижераторная К 24 Д, ГДР) для получения чистой цитоплазматической (неседиментируемой) фракции. Осадок, представляющий собой грубую фракцию лизосом (седиментируемая фракция), ресуспендировали в 0,25 М сахарозе с добавлением Тритона Х-100 в конечной концентрации 0,1%.
Окислительную модификацию белков оценивали по методу R.L. Levine в модификации [6], после осаждения нуклеиновых кислот 10 %-м раствором стрептомицина сульфата.
По полученным значениям экстинкций строили спектр окислительной модификации белков и подсчитывали площадь под кривой [12], выраженной в условных единицах на грамм белка (у.е./г белка).
Статистический анализ результатов исследования проведен согласно руководствам по медицинской статистике, с использованием программы «Microsoft Office Excel 2010» и «Statistica 10.0». Проверку нормальности распределения данных осуществляли с помощью критерия Шапиро-Уилка (W-критерий). Поскольку отмечалось отсутствие согласия большинства данных с нормальным распределением, вычисляли характеристики: медиану, минимальное и максимальное значение, результаты представляли в формате Ме [min; max], для оценки статистической значимости различий независимых выборок использовали ранговый критерий Манна-Уитни (U-тест).
Результаты и обсуждение. Карбонильные производные белков - это стабильные продукты, которые образуются при участии аминокислотных остатков пролина, аргинина, лизина, треонина с образованием аддуктов Михаэля. Также карбонильные производные белков могут образовываться при участии аминокислотных остатков лизина, цистеина и гистидина с продуктами ПОЛ. Причем карбонилирование аргинина и лизина сопровождается потерей одного или более атомов азота. Кроме этого, они могут образовываться в процессе гликирования/гликооксидации аминогрупп лизина [6].
В контрольных группах отмечается смешение площадей спектра в сторону производных нейтрального характера, с преобладанием АДНФГ (табл. 1).
Таблица 1. Площадь под кривой спонтанной окислительной модификации белков (у.е./г белка). Ме[min; max]
![Таблица 1. Площадь под кривой спонтанной окислительной модификации белков (у.е./г белка). Ме[min; max]](/images/articles/2016/2.1/t1.png)
Примечания: здесь и далее * - статистически значимые отличия от группы контроля (р<0,05); ▲ - статистически значимые отличия от группы аргинина (р<0,05); ● - статистически значимые отличия от группы L-NAME (р<0,05).
Под влиянием аргинина отмечалось некоторое увеличение содержания карбонильных производных в стенке грудной аорты, при этом статистически значимое нарастание обнаружено только для КДНФГuv. Это позволяет сделать предположение, об окислительном повреждении аминокислотных остатков как нейтрального так и основного характера (рис. 1).
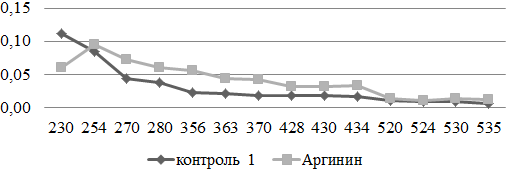
Рис. 1. Сравнительный анализ спектра поглощения продуктов спонтанной окислительной модификации белков и их компонентов в аорте экспериментальных и контрольных животных (у.е./г белка).
Изменения, протекающие в экспериментальной модели неселективного ингибирования NO-синтазы, могут быть охарактеризованы как выраженное подавление окислительной модификации белков ткани грудной аорты, с явным смещением спектра поглощения в сторону альдегидных и кетонных группировок аминокислотных остатков нейтрального характера (рис. 2).
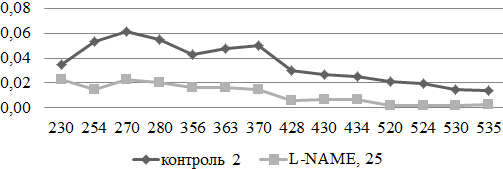
Рис. 2. Сравнительный анализ спектра поглощения продуктов спонтанной окислительной модификации белков и их компонентов в аорте экспериментальных и контрольных животных (у.е./г белка).
При введении L-NAME на фоне аргинина максимальное смещение графика обнаружено в областях с большей долей аминокислотных остатков основного характера (рис. 3).
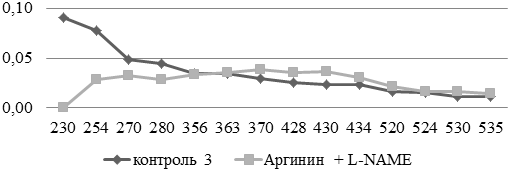
Рис. 3. Сравнительный анализ спектра поглощения продуктов спонтанной окислительной модификации белков и их компонентов в аорте экспериментальных и контрольных животных (у.е./г белка).
Содержание карбонильных групп в белках сыворотки крови - показатель, характеризующий выраженность «окислительного стресса» и глубину окислительного повреждения белков [15]. По последним данным, альдегидные производные принято считать ранними маркерами ОМБ, а кетонные - поздними маркерами [4], характеризующими степень окислительной деструкции белковой молекулы [14].
Таблица 2. Суммарное содержание первичных и вторичных маркеров окислительного стресса экспериментальных и контрольных животных (у.е./г белка). Ме[min; max]
![Таблица 2. Суммарное содержание первичных и вторичных маркеров окислительного стресса экспериментальных и контрольных животных (у.е./г белка). Ме[min; max]](/images/articles/2016/2.1/t2.png)
При анализе данных S АДНФГuv + S АДНФГvs и S КДНФГuv + S КДНФГvs можно сделать следующее заключение, что полученные результаты располагаются с увеличением значений в следующей последовательности: L-NAME; аргинин + L-NAME; аргинин (таблица 2). Из полученных данных в ходе эксперимента можно сделать предположение о том, что при стимуляции синтеза NО происходит активный рост как первичных, так и вторичных маркеров окислительного стресса. Статистически значимые отличия от групп контроля выявлены у группы под действием аргинина и у S КДНФГuv + S КДНФГvs группы L-NAME. Оба показателя экспериментальной группы с введением L-NAME имеют статистически значимые отличия от группы животных, получавших аргинин.
При введении L-NAME на фоне аргинина значение S АДНФГuv + S АДНФГvs статистически значимо отличается от такового при изолированном введении аргинина, а S КДНФГuv + S КДНФГvs статистически значимо отличается от показателей экспериментальной группы 2.
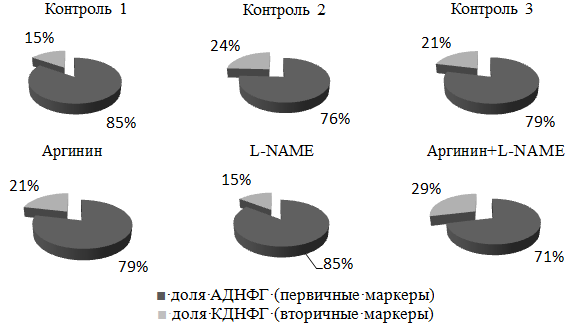
Рис. 4. Доля первичных и вторичных маркеров относительно общего содержания карбонильных производных белков.
Степень нарастания доли АДНФГ над КДНФГ в экспериментальных моделях № 1 и № 3 относительно контролей 1 и 3 свидетельствует о преобладании роста первичных маркеров окислительного стресса, а так же о запуске процесса фрагментации белковой молекулы и нарушение нативной конформации белков с образованием крупных белковых агрегатов (рис. 4). Опасность формирования белковых фрагментов и агрегатов заключается в том, что они способны ингибировать протеолитическую систему [10]. Накопление белковых агрегатов обнаруживается при старении [16] и ряде заболеваний [20], а также в условиях пониженной активности протеиназ [8].
Степень нарастания доли КДНФГ над АДНФГ в экспериментальной модели № 2 выше, чем в контрольной группе, что может быть связано с активным переходом первичных маркеров во вторичные (прямой механизм окислительного стресса). Карбонильные производные протеинов способны направляться в протеолитическую систему, что будет способствовать обновлению белков и утилизации поврежденных. В настоящее время карбонилирование рассматривается как один из способов контроля качества белков [9].
Диагностическое значение имеет не только определение спонтанной ОМБ, указывающей на количество модифицированных аминокислот, но и металлиндуцированная деструкция белковых молекул. Выступая донорами электронов ионы железа относительно легко окисляются и восстанавливаются, а также их высокое содержание в клетке, может инициировать окислительное повреждение белков [9]. Металлкатализируемое окисление представляет собой местный специфический процесс, протекающий в нормально функционирующем организме, и его уровень является важным прогностическим показателем. Индуцированная ОМБ выявляет изменения аминокислот, входящих с состав полипептидной цепи, и модификации, связанные с конформацией молекулы и состоянием белкового окружения [3]. Необходимость изучения как спонтанной, так и индуцируемой ионами металлов ОМБ, обусловлена тем, что это дает возможность произвести косвенную оценку антиоксидантных способностей белков с помощью резервно-адаптационного потенциала (РАП) [18].
Оценка резервно-адаптационного потенциала производилась путем подсчета отношения общей площади под кривой карбонильных производных белков при спонтанном окислении протеинов к индуцированному по реакции Фентона, принимая общее количество динитрофенилгидразонов за 100 % [11].
В группе с введением аргинина не отмечено статистически значимых показателей (рис.5).
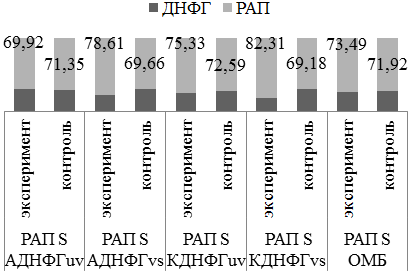
Рис. 5. Оценка резервно-адаптационного потенциала аргинин/контроль 1; *- статистически значимые отличия от группы контроля (р<0,05).
Под действием ингибитора синтеза оксида азота in vitro отмечается истощение резервно-адаптационного потенциала стенки аорты преимущественно за счет АДНФГ основного и КДНФГ нейтрального характера (рис.6). В условиях дефицита синтеза оксида азота значение РАП снижается относительно показателей контроля. Полученная тенденция истощения резервно-адаптационного потенциала может свидетельствовать о недостаточной активности антиоксидантных систем и накоплении поврежденных со слабой функциональной активностью белков. Подобная динамика была выявлена ранее в спленоцитах крыс [1, 2, 19].
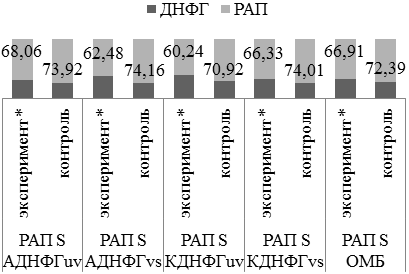
Рис. 6. Оценка резервно-адаптационного потенциала L-NAME/контроль 2.
РАП при введении L-NAME на фоне аргинина (рис.7) повторяет в большей степени динамику изменений РАП в экспериментальной группе, получавшей L-NAME.
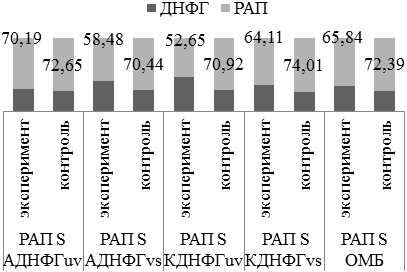
Рис. 7. Оценка резервно-адаптационного потенциала аргинин+L-NAME/контроль 3.
Таким образом, применение неселективного ингибитора NO-синтазы приводит к снижению окислительной модификации белков стенки грудной аорты со снижением доли вторичных маркеров оксидативного стресса; однако, резервно-адаптационный потенциал при этом истощается. Выявленные изменения статистически значимы относительно как группы контроля, так и группы животных, получавших субстрат NO-синтазы - аргинин; при этом изолированное применение аргинина не вызвало статистически значимых изменений изучаемых показателей от контрольной группы.
