Введение
Фотодинамическое воздействие на живые клетки с применением фотосенсибилизаторов и лазерного излучения находит все большее и большее применение в экологии и медицине. Появляются новые фотосенсибилизаторы, которые проходят испытание, однако, и те фотосенсибилизаторы, которые уже применяются на практике, еще далеко не изучены, особенно в отношении их влияния на генетический аппарат клетки.
В данной работе проведено исследование по выявлению наличия генотоксичности у двух фотосенсибилизаторов, метиленового синего и профлавина, относящихся к красителям азинового ряда, которые при фотодинамических реакциях способны подавлять жизнедеятельность вирусов, бактерий, цианобактерий, паразитических грибов и атипичных клеток у человека и животных [1-4]. Ранее такие исследования были проведены на крысах, где давалась оценка цитогенетической активности метиленового синего, а также продуктов его фоторедукции в полиорганном микроядерном тесте (МЯТ) при дозах красителя -0,25, 0,05, 0,01 мг/кг и продуктов его фотодеструкции - 0,05, 0,01 мг/кг. Образование микроядер изучалось в костном мозге, эпителиальных клетках мочевого пузыря и толстой кишки. Установлено, что сам метиленовый синий не обладает цитогенетической активностью в исследованных дозах, но продукты фотодеструкции способствуют развитию мутагенных эффектов; цитотоксическое действие в эпителиоцитах толстой кишки и мочевого пузыря проявляется в дозах 0,01 мг/кг и выше [5,6]. Таким образом, мутагенность этих веществ проявляется только при их фотодеструкции.
Согласно литературным данным положительно заряженные молекулы акридинов, имеющих сходные с основаниями кольцевые структуры, но лишенные сахарофосфата, вставляются между «стопками» пар оснований в ДНК. Акридин и профлавин внедряются между соседними основаниями цепи ДНК, вдвое увеличивая расстояние между ними. Это пространственное изменение при репликации может привести, как к утрате нуклеотида, так и включению дополнительной нуклеотидной пары, что приводит к сдвигу рамки считывания тРНК.
Установлено, что профлавина ацетат и продукты его фотодеструкции вызывают мутации при снижении концентрации до 0,05 мг/л. Поэтому пороговая доза цитотоксического действия необлученного профлавина ацетата - 0,05 мг/кг. После фотодеструкции сенсибилизатор не вызывал цитотоксических эффектов [6].
Анализ проведенных ранее работ с фототоксикантами азинового ряда по определению генетического и цитотоксического действия показывает, что в качестве тест-объектов в основном использовались млекопитающие (крысы). Действительность же такова, что азиновые красители применяются как бактерициды при обеззараживании воды, в стоматологии и гинекологии; для подавления вирусов папилломы человека и патогенных грибов, поэтому необходимы исследования генотоксичности метиленового синего и профлавина общепринятыми методами - с помощью теста Эймса и по аберрациям политенных хромосом у хирономид [7].
Цель данного исследования - установление генотоксичности и цитотоксичности фотосенсибилизаторов, относящихся к азиновым красителям, метиленового синего и профлавина, на бактериях и политенных хромосомах личинок хирономид, на которые более объективно можно выявить мутагенность указанных веществ.
Материал и методы исследования
Опыты по выявлению генотоксичности метиленового синего и профлавина, относящихся к фотосенсибилизаторам азинового ряда, проводили в водных растворах.
Структурная формула указанных красителей представлена на рис. 1.
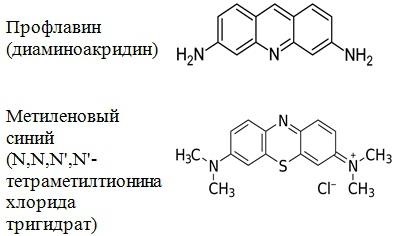
Рис. 1. Структурная формула исследуемых красителей.
Учет генных мутаций в растворах фототоксикантов (тест Эймса)
Опыты проводили в люминостате при постоянном освещении лампами дневного света с освещенностью 3 тыс. лк. Исследование проводилось согласно методическим указаниям по установлению ПДК в воде рыбохозяйственных водоемов [8].
Наиболее удобным, быстрым и экономичным способам выявления мутагенной активности является тест Эймса с использованием штаммов бактерий Sаlmопеllа tурhimurium ТА-98 и ТА-100.
Под влиянием мутагенных веществ у микроорганизмов - ревертантов происходят обратные мутации, и они приобретают способность жить на среде, лишенной гистидина или другой аминокислоты, по которой отобран тот или другой штамм.
Для выявления промутагенов производили микросомальную активацию, для того чтобы выявить, не проявляются ли мутагенные свойства после активации вещества ферментами, содержащимися в микросомах печени. Приготовление минимальной среды (МС), лишенной гистидина, и микросомальных ферментов из гепатопанкреаса карпа, а также сам тест Эймса, проводили согласно стандартным методическим указаниям [9].
Степень мутагенного эффекта определяли по кратности превышения числа колоний бактерий-ревертантов при данной дозе над таковым в контроле (табл. 1).
Таблица 1. Шкала градаций мутагенной активности веществ

Исследование генотоксичности красителей-фотосенсибилизаторов на политенных хромосомах хирономид
Исследования проводили на политенных хромосомах слюнных желез предкуколки хирономид Chironomus plumosus В результате опытов выявляли действие фототоксикантов и продуктов их фотодеструкции на структуру политенных хромосом. Поскольку исследовалось фотодинамическое воздействие токсикантов и возможное проявление ими мутагенного свойства, личинок хирономид не помещали в ил, они находились в чашках Петри в отстойной водопроводной воде двое суток при постоянном освещении в люминостате. Выживаемость личинок была хорошей, гибель составляла не более 12%. В чашки Петри с токсикантами помещали по 10 личинок в фазе 4-го роста (повторность опыта трехкратная). Кариотип клеток слюнных желез в контроле представлен на рис. 2.
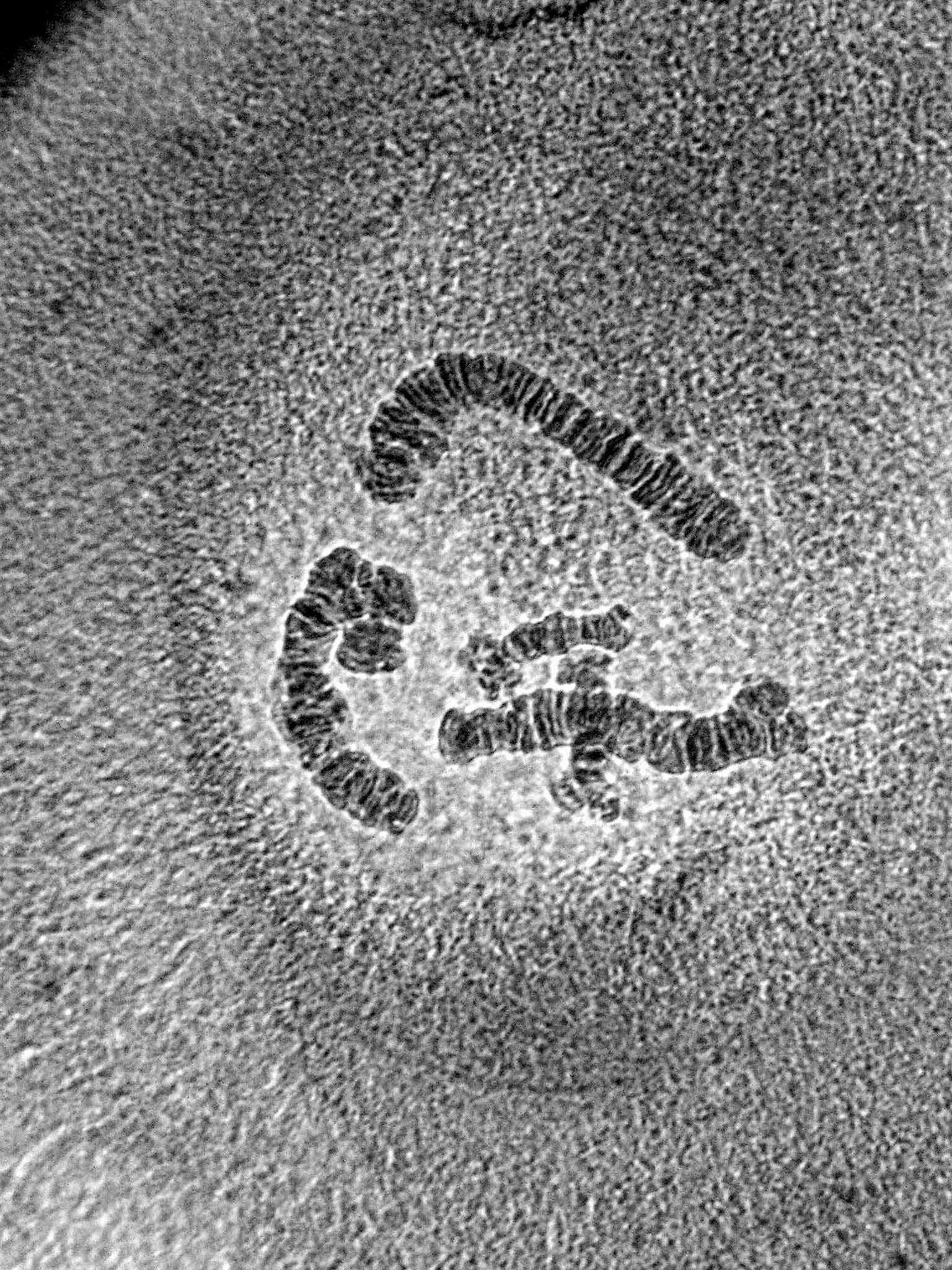
Рис. 2. Кариотип из слюнных желез Chironomus plumosus. 1 (сверху) и 2-я (слева внизу) хромосомы метацентрические; 3-я (справа внизу) субметацентрическая, 4-я телоцентрическая (частично расположена на 3-ей хромосоме).
Результаты исследований анализировались на наличие генотоксичности с использованием ряда общепринятых методик [10,11]. Метаморфоз проходит в 6-й, 7-й, 8-й и 9-й фазах развития [12].
Препараты политенных хромосом из слюнных желез получали по стандартной методике [13]. Извлеченные слюнные железы окрашивали в течение 20 мин ацеторсеином и заключали под покровное стекло. Генотоксичность вещества оценивали по нарушению структуры политенных хромосом (разрывы, распад концов, перетяжки и образование асинапсов).
Результаты исследования и обсуждение
Определение мутагенной активности метиленового синего в тесте Эймса (выявление мутаций на генном уровне)
Исходя из предварительных результатов опыта на сапрофитных бактериях и литературных данных, приведенных выше, для определения мутагенной активности соединения были выбраны концентрации 1.0; 0,5; 0,1; 0,05 и 0,01 мг/л.
Данные о численности колоний указанных штаммов бактерий, в различных концентрациях метиленового синего приведены в табл. 2.
Таблица 2. Мутагенный эффект метиленового синего в тесте Эймса (приведено среднее количество колоний от 3-х повторностей)
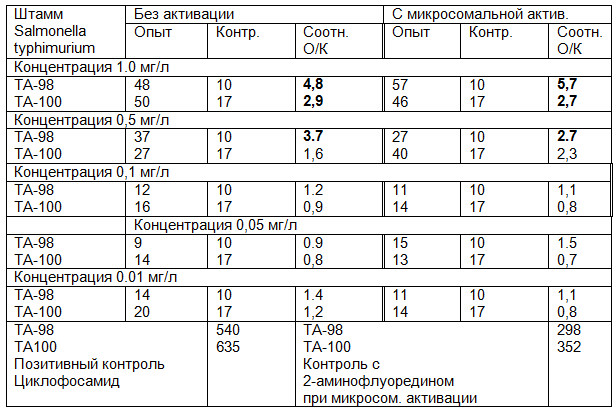
Примечание: жирным шрифтом выделены соотношения между опытом и контролем, указывающие на генотоксичность метиленового синего (показатель О/К>2,5).
Таким образом, генотоксичность исследуемого фототоксиканта проявляется при концентрациях 1,0 и 0.5 мг/л. Концентрацию 0,1 мг/л следует считать максимально допустимой.
Метаболитическая активация не отразилась на генотоксичности метиленового синего и показатели оказались близкими к тем, которые получены без использования микросом печени.
Определение генотоксичности метиленового синего на политенных хромосомах хирономид (выявление мутаций на хромосомном уровне)
Для исследования были выбраны концентрации 1,0; 0,5; 0,1; 0,05 и 0,01 мг/л.
Пуфинг во время метаморфоза на 6 - 9 фазах развития (4 роста): не был нарушен при действии всех исследованных концентраций метиленового синего.
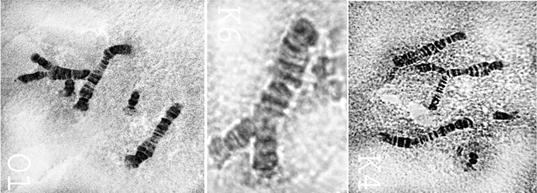
Рис. 3. Изменение структуры политенных хромосом в слюнных железах Chironomus plumosus при действии метиленового синего в концентрации 1,0 мг/л (рисунка увеличенная хромосома с асинапсом).
На рис. 3 представлены кариотипы и отдельные хромосомы слюнных желез личинки Chironomus plumosus после проведенных экспериментов по воздействию метиленового синего в концентрации 1,0 мг/л. На 3-ей хромосоме отмечается образование асинапсов, а на 4-ой телоцентрической хромосоме разрыв в области ломкого сайта. Указанные изменения говорят об активном действии концентрации 1,0 мг/л на цитогенетические показатели политенных хромосом хирономид и проявлении генотоксичности на хромосомном уровне.
Таким образом, допустимыми концентрациями для метиленового синего и продуктов его фотодеструкции по такому показателю как генотоксичность следует считать:
генные мутации в тесте Эймса, полученные на штаммах сальмонеллы ТА-98 и ТА-100 - 0,1 мг/л;
цитогенетические изменения в политенных хромосомах слюнных желез личинок Chironomus plumosus - 0,5 мг/л.
Оценка генотоксичности профлавина
Определение мутагенной активности растворов профлавина в тесте Эймса (выявление мутаций на генном уровне)
Исходя из результатов опытов по действию профлавина на динамику роста численности сапрофитных бактерий, для исследования генотоксичности указанного красителя были выбраны концентрации 1.0; 0,5; 0,1; 0,05 и 0,01 мг/л. Растворы до концентрации 0,05 мг/л включительно в столбе жидкости 40 см имеют светло желтую окраску. При концентрации 0,01 мг/л раствор бесцветный.
Данные о росте колоний нижеприведенных штаммов сальмонеллы, в различных концентрациях профлавина представлены в табл. 3.
Таблица 3. Мутагенный эффект профлавина в тесте Эймса (приведено среднее количество колоний на чашку Петри). Выделенные соотношения О/К указывают на концентрацию профлавина, обладающую генотоксичностью
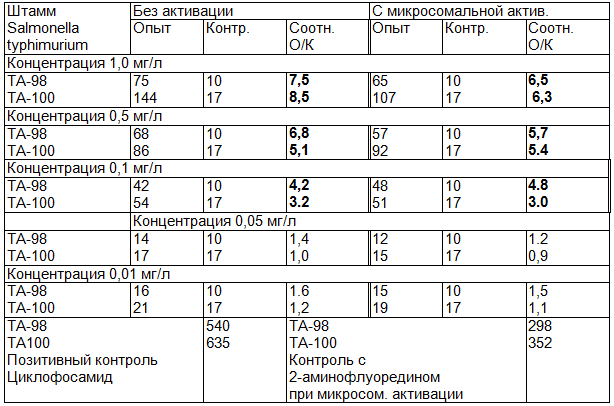
В данных опытах О/К превышает показатель 2.5 при концентрациях профлавина 1,0; 0,5 и 0,1 мг/л, что свидетельствует о наличии генотоксичности профлавина при указанных концентрациях. Максимально допустимая концентрация (МДК), при которой не отмечается проявление мутагенности профлавина и продуктов его фотодеструкции, в проведенном нами опыте составила 0.05 мг/л.
Метаболитическая активация профлавина не увеличивает его мутагенных свойств.
Определение генотоксичности профлавина на политенных хромосомах хирономид
Для исследования генотоксичности профлавина на политенных хромосомах хирономид и установления МДК для него были взяты те же концентрации, что и при проведении теста Эймса. Примерно такие же уровни содержания красителя по литературным данным брались для исследования на крысах в микроядерном тесте.
Пуфинг метаморфоза на 6-9 фазах развития (4 роста) в опыте при всех исследованных концентрациях не нарушался по сравнению с контролем.
На рис. 4 представлены основные нарушения политенных хромосом при действии растворов профлавина в концентрациях 1,0 и 0,5 мг/л.
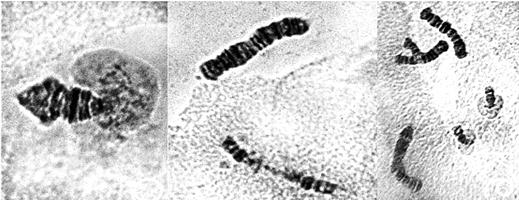
Рис. 4. Аберрации в политенных хромосомах слюнных желез хирономид под действием растворов профлавина в концентрациях 1.0 мг/л (верхний ряд снимков) и 0,5 мг/л (нижний ряд снимков). Слева фрагмент разошедшейся 4-й телоцентрической хромосомы под влиянием профлавина с увеличением колец Бальбиани.
При действии профлавина в концентрации 1,0 мг/л (верхний ряд) наблюдается разрыв 4-й телоцентрической хромосомы на два фрагмента. В этом же секторе видна хромосома с асинапсом в виде «вилки». Подобные хромосомы отмечаются на многих препаратах после воздействия профлавина в концентрации 1,0 мг/л. В этом же ряду можно отметить деструкцию хромосом в области центромеры (внизу в середине снимка).
При действии профлавина в концентрации 0,5 мг/л отмечено значительно меньше морфологических аберраций политенных хромосом (нижний ряд). Основное отклонение заключалось в разрыве 4-й телоцентрической хромосомы. Однако и этот показатель можно считать существенным, а концентрацию профлавина 0,5 мг/л приходится отнести к генотоксичной по цитогенетическим показателям.
За допустимую концентрацию профлавина по аберрациям в политенных хромосомах слюнных желез личинок хирономид следует считать - 0,1 мг/л.
Заключение о генотоксичности и максимально допустимой концентрации профлавина
Таким образом, профлавин при концентрациях выше 0,05 мг/л может вызывать мутации как на генном, так и на хромосомном уровне. При исследовании этого фототоксиканта в тесте Эймса на штаммах сальмонеллы ТА-98 и ТА-100 удалось показать, что обратные мутации на минимальной среде происходят при действии растворов с концентрацией 1.0; 0,5 и 0,1 мг/л. При этом метаболитическая активация не увеличивает мутагенности растворов.
Исследования генотоксичности растворов профлавина на политенных хромосомах личинок хирономид в стадии предкуколки, когда с началом метаморфоза наблюдается активный пуффинг, показало, что хромосомные аберрации отмечены при действии растворов с концентрацией 1,0 и 0,5 мг/л.
Процесс пуфинга под воздействием профлавина не нарушен, зато показана высокая активность образования асинапсов во второй и третьей хромосоме. Это свидете6льствует о том, что профлавин образует вставки в определенных участках ДНК и возможна мутация сдвиг рамки считывания.
Таким образом, как метиленовый синий, так и профлавин, при освещении действуют как фотогенотоксиканты, и после фотодеструкции не проявляют мутагенных свойств.
Заключение
Представленные результаты свидетельствуют о том, что метиленовый синий и профлавин при фотодинамических реакциях обладают мутагенной активностью. Наглядно эффект фотоксикантов проявляется при концентрациях, превышающих данные, указанные в табл. 4.
Таблица 4. Сравнительная генотоксичность метиленового синего и профлавина по пороговым показателям

В итоге следует заключить, что профлавин относится к генотоксичному соединению, у которого мутагенные свойства проявляются при меньших концентрациях, чем у метиленового синего. Максимально допустимые концентрации для него и продуктов его фотодеструкции следующие:
-по образованию генных мутаций, выявляемых в тесте Эймса - 0.05 мг/л;
- по возникновению аберраций в политенных хромосомах слюнных желез личинок хирономид - 0,1 мг/л.
В результате проведения работы можно утверждать, что у метиленового синего и профлавина выявлена слабая мутагенная активность.
Генотоксичность исследованных веществ может явиться важным обстоятельством на пути их практического использования.
