Введение. Язвенная болезнь – хроническое рецидивирующее заболевание, склонное к прогрессированию, с полициклическим течением, характерными особенностями которого являются сезонные обострения, сопровождающиеся возникновением язвенного дефекта желудка или двенадцатиперстной кишки, и развитие осложнений, угрожающих жизни больного [1]. Язвенная болезнь желудка и двенадцатиперстной кишки развивается при нарушении баланса между защитными факторами (защитный слой слизи, бикарбонаты, простагландины, поддержание целостности эпителиального слоя) и агрессивными факторами, воздействующими на слизистую оболочку желудка (гастротоксические лекарственные препараты, кислотно-пептический фактор, инфекция Helicobacter pylori) [3,4]. В настоящее время существует большое количество противоязвенных препаратов, действие которых направленно на активацию защитных факторов слизистой желудка или на ослабление действия повреждающих факторов [2,5]. Большинство из имеющихся препаратов обладают рядом побочных действий, поэтому поиск и разработка новых противоязвенных средств является актуальной задачей.
Цель работы – изучить противоязвенное действие биотехнологически модифицированной альгиновой кислоты на этаноловой модели язвы желудка.
Материалы и методы. Исследование выполнено на 50 белых беспородных крысах-самцах, массой 150 ± 30 грамм. За сутки до создания этаноловой модели язвы желудка животных отстраняли от пищи, за 20 минут до введения этилового спирта – лишали воды. Крысы были разделены на 5 групп (таблица 1).
Таблица 1. Группы лабораторных животных

Животных подвергали эвтаназии путем передозировки эфирного наркоза, извлекали желудки, вскрывали по большой кривизне, оценивали состояние слизистой оболочки, измеряли длину видимых повреждений. Изготовление гистологических препаратов осуществляли по стандартной схеме, окрашивали гематоксилином и эозином. Морфометрический анализ проводили при нескольких увеличениях (40, 100, 1000) с использованием микроскопа «МИКМЕД-6» (Россия): оценивали состояние оболочек желудка, измеряли их толщину; подсчитывали количество нейтрофилов и фибробластов в собственной пластинке слизистой оболочки. Нормальность распределения проверяли с помощью критерия Шапиро-Уилка. Во всех группах распределение данных подчинялось закону нормального распределения, они описаны с помощью средней арифметической и стандартного отклонения (M (SD)). Достоверность статистических различий средних арифметических величин оценивали с использованием однофакторного дисперсионного анализа, апостериорные сравнения проводили с помощью критерия Бонферрони. Статистически значимыми считали различия с p<0,05.
Результаты и их обсуждение. В группе интактных животных, которым перорально вводили физиологический раствор (первая группа) при макроскопическом изучении желудков видимых деструктивных изменений слизистой оболочки и кровоизлияний не выявлено. Слизистая оболочка розового цвета, покрыта небольшим слоем слизи. При микроскопическом исследовании препаратов желудков также не обнаружено деструктивных изменений слизистой. Дистрофические изменения покровного и железистого эпителия отсутствовали. Слизистая оболочка состояла из поверхностного эпителия, собственной и мышечной пластинок (рисунок 1). Хорошо выражены складки слизистой оболочки желудка, толщина ее составила 1216,1 мкм (SD = 43,3 мкм). Выявлены полиморфно-ядерные лейкоциты в собственной пластинке слизистой оболочки – 5 нейтрофилов (SD = 1 нейтрофил) в поле зрения, что находится в рамках физиологической нормы и сопряжено с секреторной деятельностью желудка. Количество фибробластов составило 3 клетки (SD = 1 клетка) в поле зрения. Толщина подслизистой основы – 415,8 мкм (SD = 69,8 мкм), отек отсутствовал.
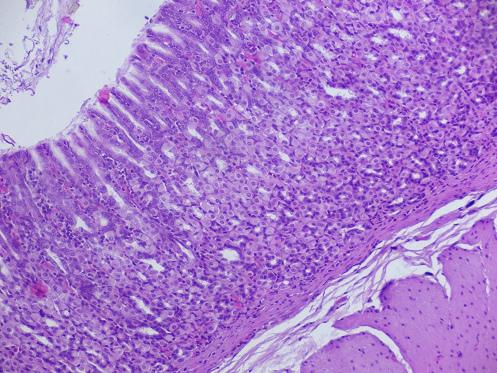
Рисунок 1. Желудок интактного животного. Окраска гематоксилин – эозин. Увеличение ×200.
В группе контрольных животных, которым перорально вводили 96% этиловый спирт (вторая группа) отмечалась гиперемия слизистой оболочки желудка. При макроскопическом исследовании выявлено множество повреждений, которые представлены полосами коричневого цвета и дефектами овальной формы. Суммарная длина повреждений составила 13,9 мм (SD = 4,5 мм). При гистологическом исследовании препаратов желудков выявлено, что повреждения представлены эрозиями и язвенными дефектами стенки желудка. Наблюдалось уменьшение толщины слизистой оболочки на 766 мкм по сравнению с животными интактной группы. Подслизистая оболочка была отечной, толщина ее составила 652,3 мкм (SD = 64,1 мкм). Выявлено полнокровие сосудов подслизистой оболочки (рисунок 2). Степень инфильтрации нейтрофилами собственной пластинки слизистой оболочки – 17 клеток (SD = 3 клетки) в поле зрения, что в 3,4 раза больше, чем у животных первой группы. Данные изменения говорят о наличии воспаления, возникшего из-за повреждения стенки желудка.
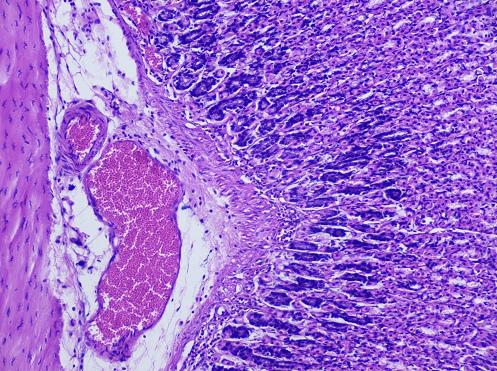
Рисунок 2. Полнокровные сосуды подслизистой оболочки желудка. Окраска гематоксилин – эозин. Увеличение ×200.
В группе животных, которым биотехнологически модифицированную альгиновую кислоту вводили перорально после этанола (третья группа) у всех крыс слизистая оболочка желудка гиперемирована. Выявлены полосовидные повреждения, локализованные на вершинах складок слизистой оболочки в теле желудка и в области малой кривизны. Их суммарная длина составила 7,1 мм (SD = 2,3 мм), что в 2 раза меньше по сравнению с животными контрольной группы (рисунок 3). При микроскопическом исследовании препаратов желудков установлено, что повреждения представлены эрозиями. Местами отмечалась десквамация покровно-ямочного эпителия. Увеличение толщины слизистой оболочки на 271 мкм по сравнению с крысами второй группы. Инфильтрация нейтрофилами собственной пластинки слизистой оболочки в 2,1 раза меньше, чем у животных контрольной группы. Эти данные свидетельствуют о меньшей выраженности воспаления, по сравнению с крысами второй группы, которым вводили только этиловый спирт. Наблюдалось увеличение количества фибробластов до 10 клеток (SD = 2 клетки) в поле зрения. Фибробласты принимают участие в восстановлении поврежденной слизистой оболочки желудка путем синтеза компонентов межклеточного вещества, входящих в состав рыхлой волокнистой соединительной ткани собственной пластинки слизистой оболочки.
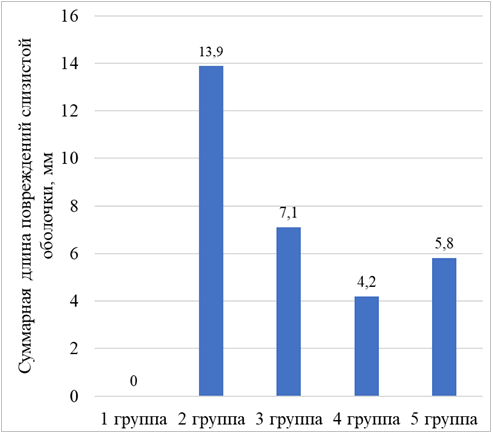
Рисунок 3. Суммарная длина повреждений слизистой оболочки желудка у животных в каждой из экспериментальных групп при создании этаноловой модели язвы желудка.
В группе животных, на которых оценивалось профилактическое действие биотехнологически модифицированной альгиновой кислоты (четвертая группа) отмечалась гиперемия слизистой оболочки желудка, сверху ее покрывал обильный слой слизи. На поверхности слизистой оболочки выявлены полосовидные повреждения, суммарная длина которых составила 4,2 мм (SD = 1,3 мм), что в 3 раза меньше, чем у крыс второй группы. При изучении гистологических препаратов желудков установлено, что имеющиеся повреждения представлены полосовидными и поверхностными точечными эрозиями. Толщина слизистой оболочки была на 340,1 мкм больше, чем у животных контрольной группы и составила 790,5 мкм (SD = 100,1 мкм). Инфильтрация собственной пластинки слизистой оболочки желудка нейтрофилами в 2,5 раза меньше, чем у крыс второй группы, которым не вводили раствор на основе биотехнологически модифицированной альгиновой кислоты. (рисунок 4). Это говорит о том, что при профилактическом введении биотехнологически модифицированной альгиновой кислоты снижается активность воспалительного процесса. Количество фибробластов, приходящееся на поле зрения, было увеличено по сравнению с контрольной группой животных.
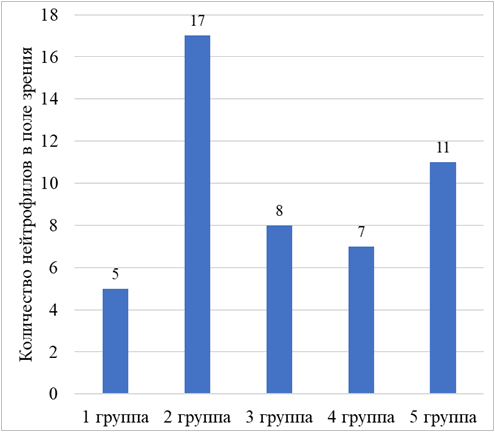
Рисунок 4. Инфильтрация нейтрофилами собственной пластинки слизистой оболочки желудка у животных в каждой из экспериментальных групп при создании этаноловой модели язвы желудка.
В группе животных, которым перорально вводили препарат сравнения «Гевискон» (пятая группа) на поверхности слизистой оболочки выявлены повреждения в виде полос, суммарная длина которых – 5,8 мм (SD = 1,8 мм), что в 2,4 раза меньше, чем у крыс контрольной группы. Отмечалась гиперемия слизистой. Имеющиеся деструктивные изменения представлены эрозиями – это установлено в ходе микроскопии гистологических препаратов. Толщина слизистой оболочки на 320,7 мкм больше, чем у крыс второй группы (рисунок 5). Инфильтрации собственной пластинки слизистой оболочки нейтрофилами в 1,5 раза меньше, чем у контрольных животных. Толщина подслизистой оболочки увеличена за счет отека.
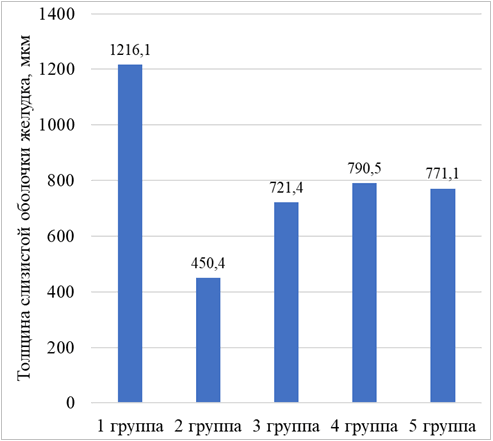
Рисунок 5. Толщина слизистой оболочки у животных в каждой из экспериментальных групп при создании этаноловой модели язвы желудка.
Морфометрические показатели слизистой и подслизистой оболочек желудка у животных в каждой из экспериментальных групп при создании этаноловой модели язвы желудка представлены в таблице 2.
Таблица 2. Морфометрические показатели слизистой и подслизистой оболочек желудка у крыс при создании этаноловой модели язвы желудка (M (SD))
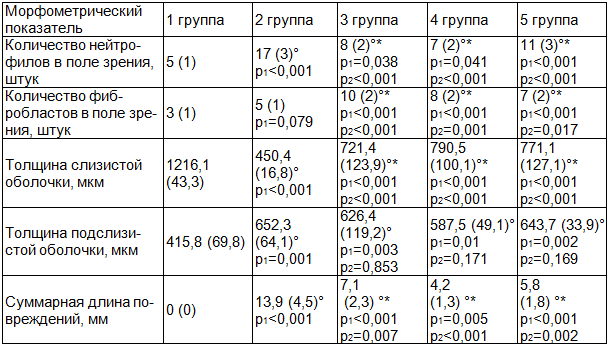
Примечания: ° – различия достоверны относительно 1 группы (группа интактных животных); * – различия достоверны относительно 2 группы (группа контрольных животных); p1 – достигнутый уровень значимости при сравнении с первой группой; p2 – достигнутый уровень значимости при сравнении со второй группой.
Заключение. Для изучения противоязвенной активности биотехнологически модифицированной альгиновой кислоты была создана этаноловая модель язвы желудка. Этанол вызывает некроз эпителиальных клеток слизистой оболочки желудка и нарушает равновесие между защитными факторами слизистой оболочки и агрессивными воздействиями на нее [6]. У животных контрольной группы были обнаружены эрозивно-язвенные поражения желудка, при изучении гистологических препаратов отмечалось уменьшение толщины слизистой оболочки и увеличение количества нейтрофилов по сравнению с интактными животными. По сравнению с крысами контрольной группы у животных, которым вводили раствор на основе биотехнологически модифицированной альгиновой кислоты, выявлено уменьшение суммарной длины повреждений слизистой оболочки и количества нейтрофилов, кроме этого, у них наблюдалось увеличение толщины слизистой оболочки. Эти данные позволяют сделать следующий вывод – биотехнологически модифицированная альгиновая кислота обладает противоязвенной активностью.
