Туберкулез органов дыхания – одна из самых актуальных проблем здравоохранения в мире [5,9]. В последние годы заболеваемость населения РФ туберкулезом возросла на 150%; смертность от туберкулеза за тот же период – выросла почти в 3 раза [7]. У пациентов с туберкулезом легких выделяется незначительное количество мокроты или наблюдается непродуктивный кашель, который встречается у больных с «малыми» формами туберкулезного процесса. Врачи сталкиваются с нетипично малым выделением мокроты и при «больших» формах специфического процесса, когда в легких имеются участки деструкции [7]. При микробиологическом исследовании мокроты обнаруживается незначительное содержание кислотоустойчивых микобактерий (КУМ). При посеве олигобациллярной мокроты на питательной среде вырастает культура с единичным ростом колоний, которая не идет на постановку теста определения лекарственной чувствительности по приказу [5, 6]. При этом не учитывается, что даже в единичном количестве микробная культура сохраняет свои биологические свойства, в том числе вирулентность. Это дает основание считать больных со скудным бактериовыделением эпидемиологически опасными для окружающих [1, 8]. В тоже время определить лекарственную чувствительность микобактерий часто не представляется возможным, что, несомненно, снижает эффективность лечения больных [9]. Это приводит к назначению препаратов эмпирическим путем, руководствуясь данными стандартов лечения. По приказу № 109 «О совершенствовании противотуберкулезных мероприятий в Российской Федерации» от 21.03.03г. при скудном бактериовыделении и единичном росте культуры (от 1 до 20 колоний) лекарственную чувствительность не определяют, культуру “сбрасывают”, и лечение назначают без учета лекарственной чувствительности, руководствуясь стандартными режимами химиотерапии туберкулеза, [6].
В связи с вышеизложенным требуется совершенствование микробиологической диагностики туберкулёза легких у больных с олигобациллярной мокротой. Особую значимость приобретает тест определения лекарственной чувствительности микобактерий туберкулеза (МБТ) у больных со скудным бактериовыделением, что определяет актуальность и значимость данного исследования для микробиологии и практического здравоохранения в современных условиях роста заболеваемости туберкулезом.
Цель работы − изучить лекарственную чувствительность МБТ у больных с олигобациллярной мокротой.
Материалы и методы. С целью изучения возможности постановки теста определения лекарственной чувствительности МБТ у больных туберкулезом легких с олигобациллярной мокротой мы наблюдали 146 пациентов с туберкулезом легких. Среди обследованных большую часть составили мужчины – 106 человек (73,1%) в возрасте 45,4 ± 1,5. Женщины – 40 человек (26,9%) в возрасте 43,2 ± 1,7 лет, находившихся на лечении в легочном и хирургическом отделениях Областного противотуберкулезного диспансере г. Иваново.
Наблюдение проводилось нами в течение трех лет. Пациенты были разделены на две группы: в 1-ю группу вошли 70 больных с олигобациллярной мокротой и единичным ростом культуры МБТ, с которой производили рассев; во 2-ю группу [3] – 76 больных с массивным бактериовыделением и ростом микробных колоний более 20 м\о. В 1 группе преобладали безработные лица (37,1%), пенсионеры (18,6%) и инвалиды (17,1%). Работающими были – 27,1% больных. Во 2 группе процент безработных – 21,1%, пенсионеров – 27,6% и инвалидов – 18,4%. Работающими были 50% обследованных лиц [3]. До выявления туберкулеза курили большинство обследованных как в 1, так и во 2 группе (98,2%). Однако с начала противотуберкулезной терапии многие пациенты отказались от курения (98,4%). Злоупотребляли алкоголем до начала лечения 43,5% больных, в процессе химиотерапии большая часть отказалась от употребления алкоголя. В исследуемых группах, в прошлом находились в местах лишения свободы 15,8% человек.
С целью изучения лекарственной чувствительности микобактерий туберкулеза по приказу «О совершенствовании противотуберкулезных мероприятий в Российской Федерации» от 21.03.03г. №109 всем больным при поступлении, через 2 - 3 мес. от начала химиотерапии, в начале 5 мес. химиотерапии, а так же по окончании курса химиотерапии исследовали мокроту на МБТ. В те же сроки проводили посев на плотную питательную среду Финна II с определением чувствительности выделенных культур МБТ к противотуберкулезным препаратам методом абсолютных концентраций. У всех больных определяли скорость роста МБТ на плотной питательной среде.
Нами применялся метод рассева, который позволил ставить тест определения лекарственной чувствительности, используя более скудный рост культуры МБТ. Указанный метод использовался в работе ГУЗ «Областного противотуберкулезного диспансера». При строгом соблюдении общепринятых в бактериологической практике технических приемов, исключающих возможность соприкосновения с заразным материалом, в специально оборудованном помещении с наличием вентиляции и обязательным использованием индивидуальных средств защиты манипуляция рассева полностью безопасна, при контрольном обследовании лаборантов признаков поражения органов дыхания не выявлено.
Методика исследования включала метод рассева для накопления микробной массы и постановки теста определения лекарственной чувствительности, используя более скудный рост культуры микобактерий туберкулеза. По приказу «О совершенствовании противотуберкулезных мероприятий в Российской Федерации» от 21.03.03г. №109 при скудном бактериовыделении и единичном росте культуры (от 1 до 20 колоний) лекарственную чувствительность не определяют, культуру “сбрасывают”, и лечение назначают без учета лекарственной чувствительности, руководствуясь стандартными режимами химиотерапии туберкулеза [6].
Накопление микробной массы получали путем повторных рассевов с основной культуры с единичным ростом колоний на плотную питательную среду Финна II. После рассева материал помещали в термостат и периодически производили наблюдение за ростом культуры каждые 7-10 дней. На 21 день появлялся рост с достаточным количеством микроорганизмов, что позволяло ставить тест определения лекарственной чувствительности выделенной культуры методом абсолютных концентраций к таким препаратам как: изониазид1, стрептомицин10, рифампицин40, этионамид30, этамбутол2, канамицин30.
Микроорганизмы снимали бактериологической петлей и помещали в стерильную толстостенную пробирку. Тщательно растирали стеклянной палочкой, постепенно добавляя по каплям стерильный физиологический раствор. Полученную суспензию отбирали пастеровской пипеткой и переносили в стерильную пробирку, диаметр которой соответствовал диаметру пробирки с оптическим стандартом мутности. Для осаждения клеточных конгломератов ее отстаивали в течение 15 минут и переносили в новую. После этого материал стандартизировали по оптическому стандарту мутности № 5 (500 млн. микробных тел в 1 мл) и разводили в 10 раз стерильным физиологическим раствором. Посев на среды с лекарственными препаратами производили из него:
– полученную бактериальную суспензию набирали в мерную пипетку объемом 2,0 мл;
– вносили по 0,2 мл суспензии в верхнюю 1/3 скошенной питательной среды с противотуберкулезными препаратами во все пробирки, приготовленные в соответствующих концентрациях: изониазид1, стрептомицин10, рифампицин40, этионамид30, этамбутол2, канамицин30 и одну контрольную пробирку со средой без лекарственных препаратов;
– по окончании процедуры пробирки закрывали ватно-марлевыми пробками и ставили в вертикальный штатив с тем, чтобы суспензия равномерно распределилась по поверхности среды к дну пробирки;
– по завершении процедуры посева, пробирки перемещали в горизонтальные штативы – “диваны” и ставили в термостат при t 37ºС, при этом поверхность скошенной питательной среды находилась в горизонтальной плоскости, а наклон штатива исключал смачивание пробки материалом засева;
– по истечении 2-3 суток инкубации ватно-марлевые пробки меняли на резиновые, а пробирки переводили в вертикальное положение;
– инкубирование проводили в течение 3-4 недель при обязательном еженедельном просмотре.
Пробирки вынимали из термостата через 3 недели и регистрировали полученные результаты. При скудном росте в контроле пробирки ставили еще на неделю в термостат на “доращивание” до получения выраженного роста в контроле, после чего выдавали окончательный ответ.
Оценивали уровень резистентности по количеству колоний, выросших на среде с лекарственным препаратом. Культуру считали чувствительной, если в пробирке со средой, содержащей препарат, выросло менее 20 колоний при обильном росте в контроле. При наличии более 20 колоний культуру расценивали как устойчивую к той концентрации препарата, которая содержится в среде [6].
Для контроля достоверности результатов использовали лабораторный, чувствительный штамм Н37Rv. Контрольную культуру засевали так же, как испытуемую.
Для определения статистической значимости полученных результатов лабораторного и клинического исследования использовали методы математической статистики.
Статистическую обработку и анализ данных проводили с применением методов вариационной статистики, рекомендованных для медико-биологических исследований, на персональной IBM Pentium IV со стандартными программами статистической обработки [2]. Результаты обработаны при помощи пакета программ Microsoft Excel для Windows XP 2003. Показатели представлены в виде средней арифметической вариационного ряда и ее стандартной ошибки (М±m). Достоверность различий средних величин оценивалась с использованием t-критерия Стьюдента.
Результаты и обсуждение. У больных туберкулезом легких с олигобациллярной мокротой накопление микробной массы методом рассева микобактерий на плотные питательные среды позволяет определить спектр лекарственной чувствительности микроорганизмов ранее 1 месяца исследования (21-26 день) у 24,3% больных, на 1-2 месяц исследования (41-54 день) у 31,4% больных, на 2-3 месяц исследования (62-85 день) у 44,3% пациентов.
Исследование, проведенное у больных 1 группы, проживающих в Ивановской области и выделяющих олигобациллярную мокроту показало устойчивость к основному препарату стрептомицину у 51,4% обследованных, рифампицину у 47,1% пациентов, к изониазиду у 38,6% больных, к этамбутолу у 32,9% обследованных; реже к препаратам второго ряда – этионамиду Еа – 11 (15,7%) и к канамицину К – 9 (12,9%) (рис. 1).
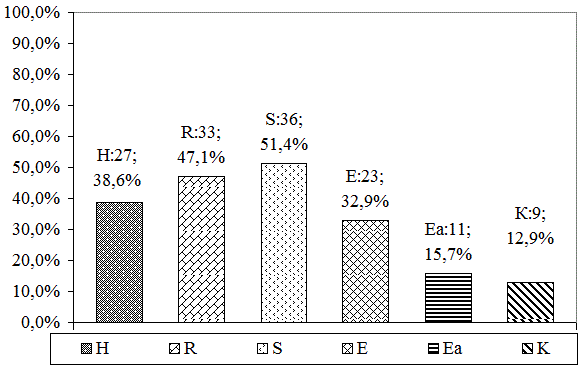
Рис. 1. Спектр лекарственной устойчивости выделенных штаммов МБТ у больных 1 группы.
У пациентов 2 группы с массивным бактериовыделением и ростом микробных колоний более 20 м\о также часто встречались штаммы, устойчивые к основному препарату стрептомицину у 72,4% обследованных, рифампицину у 55,3% пациентов, к изониазиду у 27,6% больных, к этамбутолу у 31,6% обследованных (рис. 2). Устойчивость к препаратам 2 ряда распределилась следующим образом: этионамиду Еa – 15 (19,7%) и к канамицину К – 11 (14,5%) [3], (рис. 2).
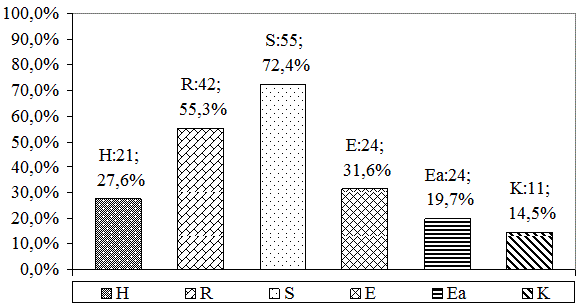
Рис. 2. Спектр лекарственной устойчивости выделенных штаммов МБТ у больных 2 группы.
У пациентов, имеющих олигобациллярную мокроту, имеется высокий уровень полирезистентности к двум и более противотуберкулезным препаратам, кроме сочетания изониазида и рифампицина (54,3%), её множественной лекарственной устойчивости (37,1%) (рис. 3).
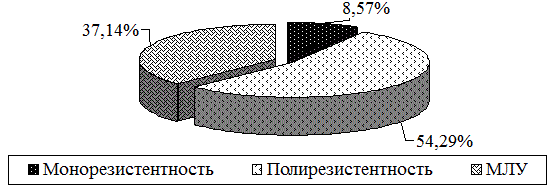
Рис. 3. Распределение больных в зависимости от характера лекарственной устойчивости МБТ (1 группа).
У больных 2 группы также имеется высокий уровень полирезистентности к двум и более противотуберкулезным препаратам, кроме сочетания изониазида и рифампицина (47,4%), её множественной лекарственной устойчивости (17,1%),(p<0,01), соответственно (рис.4).
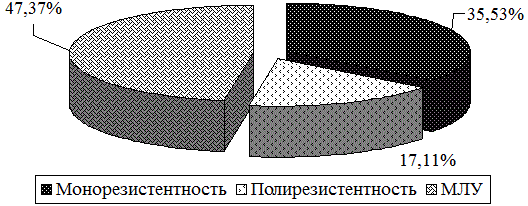
Рис. 4. Распределение больных в зависимости от характера лекарственной устойчивости МБТ (2 группа).
В ходе исследования появилась необходимость в определении сроков, в течение которых возможно определение спектра лекарственной устойчивости для раннего начала этиологического лечения больных туберкулезом. У больных со скудным бактериовыделением и единичным ростом микробных колоний лекарственная устойчивость распределилась следующим образом: к одному-трем препаратам (в течение одного-трех месяцев от начала специфического лечения) – у 8,6% пациентов; к комбинации изониазид и рифампицин (примерно через 3-4 месяца) – у 37,1%; к шести препаратам (примерно через 7-9 месяцев) – у 54,3%. У больных с массивным бактериовыделением и ростом микробных колоний более 20 м\о, к одному-трем препаратам – у 35,5% больных; к комбинации изониазид и рифампицин (примерно через 3-4 месяца) – у 17,1%; к шести препаратам (примерно через 7-9 месяцев) – у 47,4%, [3].
Нами получены данные, что в условиях соблюдения техники безопасности манипуляция рассева имеет высокую диагностическую ценность, так как способствует эффективному и наиболее оптимальному подбору этиологической терапии в условиях единичного роста культуры, а также дает возможность определить спектр лекарственной чувствительности микроорганизмов ранее 1 месяца исследования (21-26 день) у 24,3% больных, что позволяет сократить длительность обследования 1\4 пациентов туберкулезом и начать раннее этиологическое лечение.
