Актуальность проблемы. Экзогенно-токсические гепатиты представляют собой поражение печени, вызванное токсическими агентами: алкоголем и его суррогатами, лекарственными препаратами, продуктами бытовой химии, пестицидами, профессиональными вредностями. В последние годы как в России, так и за рубежом наблюдается рост распространенности токсических гепатитов [1]. Используемые в настоящее время гепатопротекторы часто недостаточно эффективны, могут способствовать нарастанию холестаза и ферментативной гиперактивности клеток печени [2,3].
Учитывая, что, на решающих этапах патогенеза повреждения печени возникают неспецифические изменения, обусловленные общностью механизмов развития клеточных повреждений [4,5], можно предположить, что применение антиоксидантов в качестве гепатопротективных средств окажется достаточно эффективным и безопасным. Одним из антиоксидантов является таурин (2-аминоэтансульфоновая кислота) [6]. В последнее время установлено, что таурин способствует улучшению энергетических и обменных процессов, нормализации функции клеточных мембран, стимулирует репаративные процессы при различных заболеваниях [7-10].
При изучении побочных эффектов противотуберкулезной терапии указывается на снижение уровня таурина в организме больных [11].
Таким образом, есть основания считать, что достаточное потребление таурина и устранение его дефицита позволят эффективнее бороться с нарушением обменных процессов у больных туберкулезом.
Цель исследования. Оценить экономическую эффективность применения оригинального отечественного препарата таурина – Дибикорадля лечения и профилактики лекарственно-индуцированного поражения печени как осложнения противотуберкулезной химиотерапии.
Материалы и методы. В сравнительном проспективном открытом рандомизированном исследовании в параллельных группах участвовали 80 больных с впервые выявленным туберкулезом и 80 больных туберкулезом с лекарственно-индуцированным поражением печени. Все больные получали противотуберкулезные препараты по 1-му стандартному режиму химиотерапии (в соответствии с приказом МЗ РФ №109): изониазид – 0,6 г/сут; рифампицин – 0,45 г/сут; этамбутол – 1,2 г/сут и пиразинамид – 1,5 г/сут. Пациенты были рандомизированы на группы по 20 человек, получавшие в течение 3-х месяцев таурин (Дибикор) 1000 мг/сут, урсодеоксихолевую кислоту (УДХК) (Урсосан) 500 мг/сут, или их комбинацию, а также экстракт плодов расторопши (Карсил) в до 420 мг/сут.
Диагноз туберкулеза легких устанавливался на основании данных ретгенографии органов грудной клетки, клинической картины заболевания, бактериологического и микроскопического анализа мокроты.
Диагноз лекарственного поражения печени устанавливали в соответствии с критериями Guidelines in the Recognition and Prevention of Hepatotoxicity in Clinical Practic, 2001, при повышении сывороточной АлАТ в два раза выше нормы в условиях отсутствия альтернативных клинических диагнозов. Для оценки вероятности связи поражения печени с приемом противотуберкулезных препаратов использовали критерий Roussel Uclaf Causality Assessment Method (RUCAM).
Контрольную группу исследования составили 20 пациентов гастроэнтерологического отделения Городской клинической больницы скорой медицинской помощи №25 г. Волгограда с синдромом раздраженной кишки. Среди них 8 (40,0%) женщины и 12 (60,0%) мужчин в возрасте от 18 до 59 лет, средний возраст которых составил 37,19±16,46 лет (M±s). Обследованные соматически были практически здоровы, не включались в исследование пациенты с заболеваниями почек и печени, сахарным диабетом, злокачественными новообразованиями, инфекционными заболеваниями и алкоголизмом.
Исследование проводили в соответствии с принципами Хельсинкской декларации Международной медицинской ассоциации, принятой в 1996 г., и рекомендациями по этике биомедицинских исследований. Соблюдение требований биоэтики подтверждено результатами экспертизы Регионального этического комитета. Результаты клинического обследования заносились в разработанную индивидуальную регистрационную карту пациента. Все протоколы исследования проходили экспертизу и были утверждены в этическом комитете.
Статистическую обработку результатов производили с использованием MS Excel – 2007 и SPSS 10.0, «Biostat, Version 4.03 by Stanton A. Glantz», «Statistica 6.0 для Windows» [12].
Результаты. На первом этапе исследования обследовано 80 больных с впервые выявленным туберкулезом пациентов Волгоградского областного клинического противотуберкулезного диспансера. Среди них было 52 мужчины (65,0%) и 28 женщин (35,0%) в возрасте от 18 до 62 лет. Средний возраст больных (M±s) составил 38,7±20,3 лет и был сопоставим с группой сравнения (t=0,14, p>0,05).
В ходе исследования выявлена достоверная взаимосвязь развития лекарственного поражения печени как осложнения противотуберкулезной терапии с эффективностью лечения туберкулеза, которую оценивали по степени абациллирования и закрытию полостей распада. Данные представлены в табл.. 1.
Таблица 1. Эффективность лечения туберкулеза легких в зависимости от наличия поражения печени
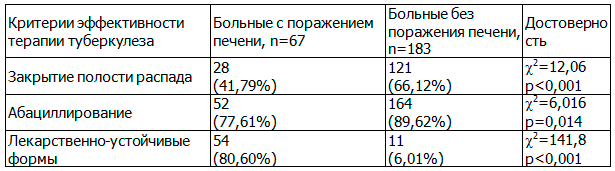
Проведенное исследование показало, что развитие ЛИПП весьма неблагоприятно для больных туберкулезом. Эффективность лечения туберкулеза статистически значимо ниже при развитии лекарственно-индуцированного поражения печени. Из-за выраженных клинико-лабораторных проявлений поражения печени была изменена схема лечения, что привело к замедленной рентгенологической динамике туберкулёзных изменений и повышению частоты развития лекарственно-устойчивых форм микобактерий. Кроме того, необходимо отметить, что у пациентов, которым потребовалась коррекция схемы противотуберкулезной терапии, отмечалось статистически значимое увеличение сроков пребывания в стационаре почти на два месяца по сравнению с больными туберкулезом без ЛИПП (261,7±19,8 дней и 203,1±17,3, соответственно (t=2,23, р<0,05)).
Проведение адекватной терапии лекарственно-индуцированного поражения печени способствовало уменьшению клинических проявлений поражения печени и снижению активности ферментов у большинства больных в течение 8–14 дней у 57 пациентов (85,07%) (c2=88,54, р<0,0001). Однако повторное назначение противотуберкулезных препаратов без гепатопротекции у 63 пациентов (94,03%) привело к повторному развитию гепатотоксических реакций (c2=79,303, р<0,0001).
На втором этапе исследования обследовано 80 больных туберкулезом с лекарственно-индуцированным поражением печени пациентов Волгоградского областного клинического противотуберкулезного диспансера. Среди них 48 мужчин (60,0%) и 32 женщины (40,0%) в возрасте от 18 до 68 лет. Средний возраст больных (M±s) составил 42,7±23,9 лет и был сопоставим с группой сравнения (t=0,83, p>0,05).
Среди пациентов второго этапа исследования лекарственно-индуцированное поражение печени наблюдалось как у больных с впервые выявленным туберкулезом легких, ранее не получавших противотуберкулезные препараты (72 - 90,0%), так и у повторно поступивших (8 пациентов - 10,0%). До начала лечения группы не имели статистически значимых отличий по возрастно-половому составу и характеристике туберкулезного процесса в легких. Кроме того, не было и существенных различий в клинической картине лекарственного поражения печени и уровне цитолиза (p>0,05). Таким образом, анализируемые параметры и группы в целом были сопоставимы.
Наиболее эффективной оказалась комбинация Дибикора и УДХК: у 75% пациентов IIб группы к концу третьего месяца полости деструкции перестали определяться, в то время как в IVб группе сравнения лишь у 45%, соответственно (c2=3,75, р=0,05). Кроме того, на фоне комплексной терапии с использованием Дибикора и УДХК наблюдалась более ранняя негативация мокроты. К концу первого месяца – у 20% и 25% пациентов I и II групп, второго – у 35% и 45%, к концу третьего месяца - у 70,0% и 80,0% больных перестали определяться микобактерии; в группе сравнения – у 15%, 25% и 55%, соответственно (c2=3,956, р=0,0467). Итак, назначение Дибикора и УДХК позволяло достоверно снизить частоту отмены противотуберкулезной терапии (р<0,05) и в минимальные сроки возобновить ее интенсивность, что сокращало сроки и увеличивало частоту закрытия полостей распада и абациллирования.
Лечение уже развившегося цитолитического синдрома было менее эффективно, чем его профилактика. В IVб группе на фоне приема экстракта плодов расторопши пятнистой негативное влияние противотуберкулезной терапии на клетки печени сохранялось, что проявлялось статистически не значимым снижением уровня ферментов (р>0,05) и приводило к вынужденной отмене противотуберкулезных препаратов у 75% пациентов этой группы (c2=24,0, р=0,0001). В то же время во IIб группе, получающей одновременно со специфической терапией комбинацию Дибикора и УДХК, удалось добиться нормализации состояния печени и достоверного снижения уровня трансаминаз до нормальных значений (р<0,001), терапия была сохранена у 95% больных этой группы (c2=1,026, р=0,311). В Iб группе на фоне терапии Дибикором наблюдалось достоверное снижение уровня трансаминаз (р<0,01), но показатели оставались выше нормы и вынужденная отмена противотуберкулезных препаратов была у 15% больных (c2=3,243, р=0,0717). В IIIб группе применение УДХК достоверно снизило уровень трансаминаз (р<0,01), но показатели оставались выше нормы у 16 пациентов (80%), у 4 больных (20%) наблюдалось их дальнейшее повышение, что привело к вынужденной отмене противотуберкулезных препаратов (c2=3,75, р=0,05).
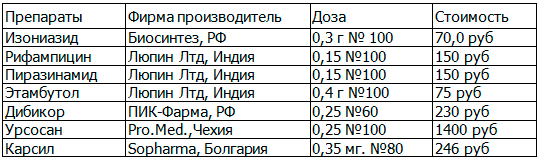
В нашем исследовании был проведен фармакоэкономический анализ «затраты-эффективность» с учитом стоимости курсовой терапии и койко/дня стационарного лечения больных туберкулезом, рассчитанными в рублях по официальным тарифам и ценам на лекарственные препараты по г. Волгограду на декабрь 2010 г. Данные представлены в табл. 2.
Таблица 2. Применявшиеся лекарственные средства
В качестве критерия эффективности использовали процент больных, у которых противотуберкулезная терапии не отменялась и сохранялась ее интенсивность, с учетом длительности стационарного лечения. Более приемлемой с экономической точки зрения считалась схема терапии, которая характеризовалась меньшими затратами на единицу эффективности. Стоимость койко/дня стационарного лечения больных туберкулезом легких составляла 532,86 руб/сут, противотуберкулезной терапии - 12,65 руб/сут. Длительность терапии у больных без поражения печени без гепатопротекции составляла 203,1±17,3 суток, при развитии поражения печени 261,7±19,8 суток. Данные представлены в табл. 3.
Таблица 3. Фармакоэкономический анализ стоимости терапии туберкулеза легких без поражения печени и с лекарственно-индуцированным поражением печени
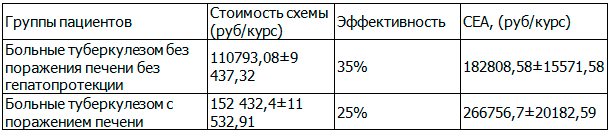
Результаты анализа, представленные в таблице, показывают, что проведение длительных курсов терапии потенциально гепатотоксичными препаратами без гепатопротекции, часто приводит к развитию поражения печени. В результате чего противотуберкулезная терапия вынужденно прерывается у 65-75% пациентов, что значительно удлиняет сроки стационарного лечения больных туберкулезом, снижает эффективность терапии, повышает стоимость курсовой терапии и затраты, приходящиеся на единицу эффективности.
Был проведен фармакоэкономический анализ схем профилактики и для лечения ЛИПП. Данные представлены в табл. 4 и 5.
Таблица 4. Анализ эффективности профилактики лекарственно-индуцированного поражения печени у больных туберкулезом
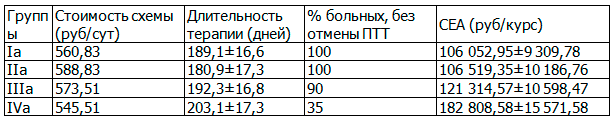
Результаты расчетов показали, что любой из изученных гепатопротективных методов повышает эффективность терапии и позволяет сохранить ее интенсивность не менее чем у 80% больных и экономически более оправдан, чем отсутствие профилактических гепатопротективных мероприятий. Максимальный процент эффективности терапии наблюдался на фоне приема Дибикора и его комбинации с УДХК (от 85% при лечении лекарственно-индуцированного поражения печени, до 100% при профилактическом назначении в качестве постоянного сопровождения противотуберкулезной терапии (ПТТ)). Лучшими показателями по критерию «затраты-эффективность» также обладала терапия Дибикором и его комбинацией с УДХК.
Таблица 5. Анализ эффективности схем терапии лекарственно-индуцированного поражения печени у больных туберкулезом
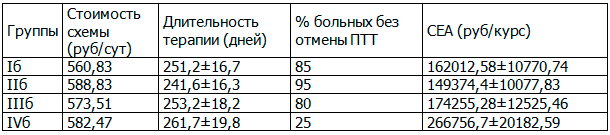
Таким образом, фармакоэкономический анализ доказывает, что применение антиоксиданта для профилактики и лечения лекарственно-индуцированного поражения печени у больных туберкулезом обеспечивает снижение расходов и позволяет значительно сократить частоту развития поражения печени. Назначение Дибикора и его комбинации с УДХК обеспечивает уменьшение затрат при профилактике на 160703 руб/курс (60%), при лечении лекарственно-индуцированного поражения печени на 117382 руб/курс (44%).
