Согласно оценкам ВОЗ, число заболевших туберкулезом (ТБ) в 2013 г. составило 9,0 млн. человек, включая более полумиллиона случаев с множественной лекарственной устойчивостью (МЛУ), и 1,5 миллиона человек умирают от этого заболевания [1]. Казахстан относится к 18 странам Европейского региона ВОЗ с высоким уровнем распространения туберкулеза с множественной лекарственной устойчивостью (МЛУ ТБ). Доля новых случаев МЛУ ТБ в 2013 г. составила 3,5% [1]. По итогам 2013 г. уровень первичного МЛУ ТБ по республике составил 25,2%, а приобретенный - 48,6% (в 2012 г. соответственно - 20,8% и 53,3%) [2]. Заболеваемость МЛУ ТБ выросла на 9,3% и составила 11,8 на 100000 населения, против 10,7 за 2012 г. [2]. Из общего числа умерших больных от туберкулеза - 63,5% МЛУ ТБ с БК+ и 23,1% - МЛУ ТБ с БК- [2].
По данным ВОЗ в 2013 г. показатель успешного лечения сохранялся на высоком уровне 86% среди всех новых случаев ТБ, а эффективность терапии противотуберкулезными препаратами второго ряда (далее - ПВР) оставалась относительно низкой, сохраняясь на уровне 48% [1]. К сожалению, в Казахстане излечиваемость новых случаев легочного ТБ с бактериовыделением в 2013 г. была значительно ниже и составила 58,0%, МЛУ ТБ - 74,3% [2].
Для лечения ТБ в Научном центре противоинфекционных препаратов (г. Алматы, Казахстан) синтезирован лекарственный препарат - ФС-1, который представляет собой ионный наноструктурированный комплекс из карбогидратов, белков и полипептидов, иода и галогенидов щелочных и щелочноземельных элементов [3, 4]. В настоящее время проведены основные доклинические и клинические испытания [5-16], в том числе изучалась in vivo терапевтическая эффективность ФС-1 в различных дозах при МЛУ ТБ и in vitro в различных концентрациях по отношению, как к чувствительному музейному штамму Mycobacterium tuberculosis Н37Rv, так и к резистентным клиническим изолятам. В этих работах была доказана бактерицидная активность ФС-1 по отношению к чувствительному музейному штамму Mycobacterium tuberculosis Н37Rv и к резистентным клиническим изолятам [5]. В экспериментах in vivo доказана терапевтическая эффективность ФС-1 в дозах 2,5 и 4,0 мг/кг в комплексном применении с противотуберкулезными препаратами второго ряда (далее - ПВР), когда наблюдалось 100% абациллирование морских свинок, зараженных МЛУ ТБ, после 60 дней терапии [6, 8]. При комплексном применении препарата ФС-1 с изониазидом у морских свинок, зараженных МЛУ ТБ, был отмечен синергетический эффект, который отразился на повышении противовоспалительного эффекта, на таких клинических проявлениях как восстановление легочной ткани, ее воздушности, на гистологическом восстановлении структуры печени, селезенки [5, 6].
В экспериментах in vitro показана противотуберкулезная активность лекарственного средства ФС-1 в концентрациях 14,6 - 29,1 мкг/мл, что сравнимо с активностью широко используемых препаратов для лечения туберкулеза таких, как амикацин, канамицин, капреомицин, стрептомицин, офлоксацин, рифампицин, изониазид. Установлено, что активность казахстанского препарата выше активности этионамида, циклосерина, пиразинамида [7].
Рентгенологическое исследование имеет большое значение для определения клинического излечения туберкулеза легких, в том числе с меножественной лекарственной устойчивостью. На основании данных рентгенологического исследования можно судить об основных этапах инволюции легочного процесса, характере остаточных противотуберкулезных изменений и дальнейших репаративных преобразований в них. При определении клинического излечения туберкулеза легких основная роль отводится динамическому R-исследованию. У больных инфильтративным туберкулезом легких при клиническом излечении наблюдалось рассасывание, уплотнение и фиброзирование очагов, закрытие полости распада (рубцом, фиброзным очагом). В некоторых случаях в период завершения обратного развития хронического туберкулеза легких образуются тонкостенные санированные полости, которые сохраняются длительное время и закрываются с образованием рубца или ячеистого фиброза. В некоторых случаях наблюдается неполное заживление полости распада, то есть образование инкапсулированной заполненной полости по типу туберкулемы. Об отсутствии активности процесса в остаточных изменениях при излечении туберкулеза судили на основании выявления плотных и обызвествленных очагов, фиброза в виде линейных теней, мелко- и среднеячеистых просветлений без очагов и ячеистоcти очаговоподобных теней.
Цель исследования: изучить влияние ФС-1 в комплексной противотуберкулезной терапии на динамику рентгенологической картины при МЛУ ТБ.
Материалы и методы.
Дизайн исследования: рандомизированное, плацебоконтролируемое, многоцентровое исследование.
Субъекты исследования: пациенты с МЛУ ТБ, подтвержденные культурально, ТЛЧ, и/или бактериоскопически (БК+), всего приняло участие 220 больных с МЛУ ТБ.
Объект исследования: лекарственное средство ФС-1, разработанное «Научным центром противоинфекционных препаратов» (Казахстан).
Схема исследования:
Для изучения терапевтической эффективности ФС-1 в комплексной противотуберкулезной терапии при МЛУ ТБ были исследованы следующие дозы: 2,0 - 2,5 - 3,0 - 4,0 - 5,0 мг/кг.
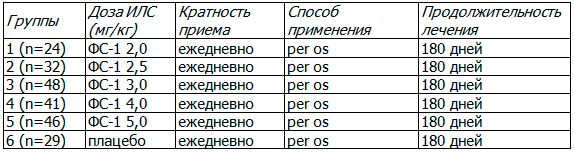
Для сравнения терапевтической эффективности ФС-1 добровольцы были рандомизированы на 5 основных и 1 контрольную группы. В основных группах добровольцы получали ПВР + ФС-1; в контрольной группе: ПВР + плацебо. Для подбора наиболее эффективной и переносимой дозы ФС-1 основные группы были рандомизированы по исследуемым дозам ФС-1: 1 группа - ПВР + ФС-1 2,0 (мг/кг); 2 группа - ПВР+ ФС-1 2,5 (мг/кг); 3 группа - ПВР + ФС-1 3,0 (мг/кг); 4 группа - ПВР + ФС-1 4,0 (мг/кг) и 5 группа - ПВР + ФС-1 5,0 (мг/кг). Продолжительность лечения - 6 месяцев. Исследуемый препарат и плацебо принимали 1 раз в сутки, утром, натощак. Схема терапии представлена в табл. 1.
Таблица 1. Схема применения ФС-1 или плацебо в комплексе с ПВР
Методы исследования
- Обзорная рентгенограмма органов грудной клетки в двух проекциях и при необходимости томограммы проводилась пациентам до начала исследования и лечения, затем каждые последующих 2 месяца в течение всего периода лечения, то есть 6 месяцев терапии.
- Для проверки достоверности результатов исследования по анализу динамики рентгенологической картины по обзорной рентгенограмме органов грудной клетки применен метод математической статистики - χ2, где Р - уровень значимости, указывающий на статистически достоверные различия между показателями динамики рентгенологической основных групп и плацебо. Динамика рентгенологической картины будет оцениваться по следующим критериям туберкулезного процесса: динамика инфильтрации, динамика очагов, динамика полостей, наличие или отсутствие полостей. Показатели будут представлены в виде качественных показателей по признакам «уменьшение», «увеличение», «без динамики». Пропущенные исследования также будут учитываться как «нет данных». Также непараметрический метод использован для оценки однородности групп по половому признаку, клиническим формам и локализации патологического туберкулезного процесса.
Результаты исследования
В клиническое исследование были включены больные, в возрасте от 18 до 65 лет, получающие противотуберкулезную терапию по IV категории, то есть лица с множественной лекарственной устойчивостью, выделяющие устойчивые штаммы МБТ к ПТП первого ряда. Из 220 включенных пациентов до конца исследования приняли участие 118. Характеристика субъектов исследования по половому признаку представлена в табл. 2.
Таблица 2. Распределение субъектов исследования по полу, абс.
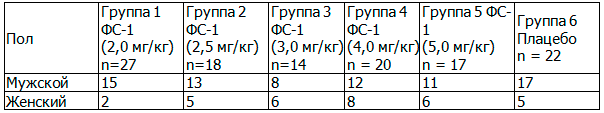
Из табл. 2 видно, что по половому признаку субъекты исследования распределены примерно одинаково, достоверных различий не выявлено, то есть по указанным признакам группы являются однородными и возможно их сравнение между собой.
В табл. 3 представлена характеристика субъектов исследования по клиническим формам. При сравнении показателей основных групп с контрольной методом непараметрической статистики - χ2, достоверных различий не обнаружено, за исключением 1 группы, где фиброзно-кавернозный туберкулез был только у 1 пациента и составил 5,3%.
Таблица 3. Распределение субъектов исследования по клиническим формам туберкулеза легких, абс.
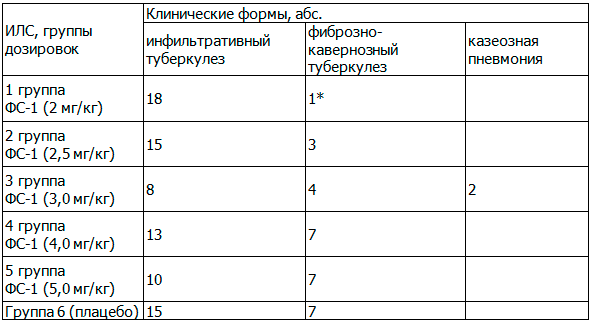
Примечание: * - статистически значимые различия между 1-й группой и группой плацебо, где Р<0,05.
Учитывая, что для оценки туберкулезного процесса и тяжести заболевания, важное значение, имеет локализация, пациенты были рандомизированы по фактору: односторонний и двусторонний. В табл. 4 представлена характеристика субъектов исследования по локализации процесса.
Таблица 4. Распределение субъектов исследования по локализации туберкулезного процесса в легких, абс. (%)
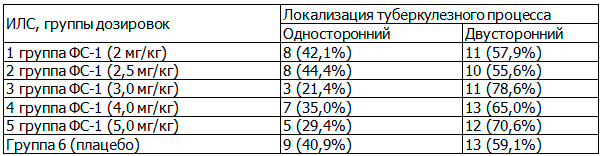
Из табл. 4 видно, что по локализации и распространенности туберкулезного процесса в легких группы почти одинаковые, достоверных различий по критерию χ2 также не обнаружено, что свидетельствует о том, что по данным факторам группы однородные и возможно сравнение показателей динамики рентгенологической картины по результатам исследования.
Одним из важных показателей оценки терапевтической эффективности в комплексной противотуберкулезной терапии являются динамика рентгенологической картины. Один из основных рентгенологических признаков активного туберкулеза легких - инфильтрация. Динамику инфильтрации оценивали по данным обзорной рентгенограммы органов грудной клетки по качественным признакам: «уменьшение», «увеличение», «без динамики». В признак «уменьшение» инфильтрации были включены случаи с уменьшением инфильтрации, частичным и/или полным рассасыванием инфильтрации, фиброзированием, уплотнением; в признак «без динамики» - включали все случаи, когда рентген-картина оставалась стабильной и ухудшения или обострения процесса не наблюдалось. Результаты исследования представлены в табл. 5. Из табл. 5 видно, что на исходной точке, то есть до начала исследования, почти во всех группах распределение по качественным признакам инфильтративного процесса в легких было однородным, исключая 4 группу, где число пациентов с увеличением инфильтрации было больше, чем в остальных группах, и в сравнении с группой плацебо были обнаружены достоверные различия по критерию χ2 (P<0,05), табл. 5.
Таблица 5. Сравнительная динамика инфильтрации в ткани легких в течение всего периода лечения, абс.
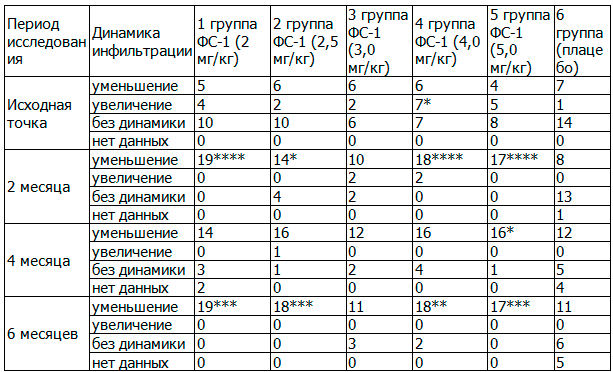
Примечание: Статистически значимые различия по критерию χ2 обозначены следующим образом: * - P<0,05; ** - P<0,025; *** - P<0,01;**** - Р<0,0001.
Результаты исследования свидетельствуют о том, что через 2 месяца терапии с применением ФС-1 в комплексе с противотуберкулезными препаратами второго ряда (далее - ПВР) в основных группах уменьшение инфильтрации наступило у большинства пациентов: у 100,0% - в 1-й и 5-й группах, у 90,0% - в 4-й группе, и у 77,8 и 71,4 (%) во 2-й и 3-й группах, соответственно, тогда как в контрольной группе - у 36,4%, что имело достоверные различия по критерию χ2 между основными группами и плацебо, (P<0,05; Р<0,0001, табл. 5), исключая 3-у группу.
Через 4 месяца терапии у большинства пациентов основных группах наблюдалось уменьшение инфильтрации (73,7%, 88,9%, 85,7 5%, 80,0% и 94,1%, соответственно), тогда как в группе плацебо - лишь в 54,5%. Как видно из таблицы наибольший удельный вес уменьшения инфильтрации в ткани легких наблюдался в 5-й группе, который имел достоверные различия по критерию χ2, в сравнении с группой плацебо (P<0,05).
Через 6 месяцев терапии уменьшение инфильтрации наступило у 100,0% субъектов исследования в 1-й, 2-й, 5-й группах, у 90,0% - в 4-й группе, у 78,6% - в 3-й группе, тогда как в контрольной группе - лишь у 50,0%. Сравнительный анализ, рассчитанный по критерию Хи-квадрат по признакам динамике инфильтрации выявил достоверные различия в 1-й, 2-й, 4-й и 5-й группах, в сравнении с контрольной группой плацебо, (P<0,025; P<0,01, табл. 5) .
По данным вышеизложенного анализа признаков динамики инфильтрации, следует, что применение ФС-1 в комплексной противотуберкулезной терапии положительно влияло на репаративные процессы в ткани легких как рассасывание инфильтрации, фиброзирования и уплотнения у больных с МЛУ ТБ.
Образование очагов засева также является одним из основных рентгенологических признаков активного туберкулеза легких, мы изучили динамику очагов засева, и оценивали по качественным признакам: «уменьшение», «увеличение», «без динамики». В признак «уменьшение» очагов засева были включены случаи с уменьшением, исчезновением, уплотнением и /или обызвествлением очагов; в признак «без динамики» - включали все случаи, когда рентген-картина оставалась стабильной. Статистическая обработка данных оценивалась по критерию χ2. Результаты исследования представлены в табл. 6.
Таблица 6. Сравнительная динамика очагов засева микобактериями туберкулеза в ткани легких в течение всего периода лечения, абс.
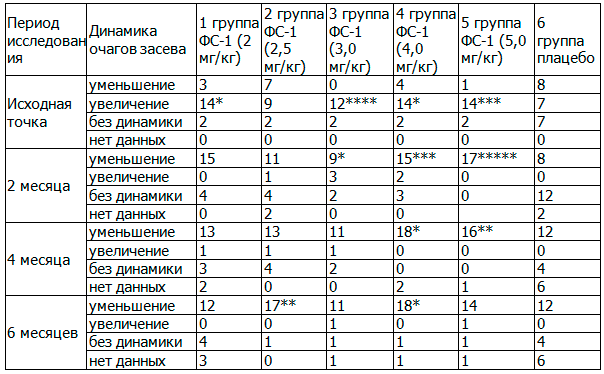
Примечание: здесь и далее статистически значимые различия по критерию χ2 обозначены следующим образом: * - P<0,05; ** - P<0,025; *** - P<0,01;**** - Р<0,005; ***** - Р<0,0001.
Как видно из табл. 6, до начала терапии удельный вес пациентов с увеличением очагов засева был намного больше, чем в контрольной группе. Так, увеличение очагов засева было обнаружено в более, чем 80% случаев в 3-й и 5-й группах; в пределах 70,0 и 73,7% - в 4-й и 1-й группах и в 50,0% - во 2-й группе, тогда как в контрольной группе был наименьший удельный вес - 31,8%. Таким образом, до начала комплексной терапии с применением ФС-1 и / или плацебо активность туберкулезного процесса с образованием полостей распада была значительно больше в основных группах, что имело достоверные различия по критерию χ2, в сравнении с контрольной группы (P<0,05; P<0,01; Р<0,005; табл. 6).
Через два месяца комплексной терапии уменьшение и уплотнение очагов засева наступило в 100,0% случаев у пациентов 5-й группы, в 78,9% - 1-й группы, в 75,0% - 4 группы и более чем в 60, 0% - во 2-й и 3-й группах, тогда как в группе контроля - в 36,4%. Достоверные различия по данному признаку в сравнении с таковыми контрольной группы обнаружены в 3-й, 4-й и 5-й группах, где P<0,05; P<0,01; Р<0,0001, соответственно. Из таблицы 6 видно, что на фоне лечения увеличение очагов засева наблюдалось у единичных пациентов основных групп. Через 4 месяца терапии увеличился удельный вес случаев уменьшения и уплотнения очагов засева во 2-й, 3-й, 4-й основных группах и составил 72,2; 78,6 и 90,0%, соответственно, тогда как в группе контроля - 54,5%. Достоверные различия по данному признаку в сравнении с группой контроля были обнаружены в 4-й и 5-й группах. Через 6 месяцев терапии наибольший удельный вес уменьшения и уплотнения очагов наблюдался в основных 1-й, 2-й, 3-й, 4-й и 5-й группах - 68,2; 94,4; 78,6; 90,0 и 82,4%, соответственно, тогда как в группе контроля - динамики не наблюдалось, и удельный вес сохранялся на уровне 4-го месяца, то есть 54,5%. Достоверные различия по данному признаку в сравнении с группой контроля были обнаружены во 2-й и 4-й группах (P<0,025; P<0,05; соответственно).
Таким образом, результаты исследования по признаку динамики очагов засева свидетельствуют о том, что применение ФС-1 в комплексе с противотуберкулезными препаратами второго ряда положительно влияло на динамику обратного развития очагов засева в легких.
Учитывая, что одним из рентгенологических признаков активного туберкулеза легких является образование полостей распада, мы изучили динамику развития полостей распада по трем качественным показателям: «уменьшение», «увеличение», «без динамики». В показатель «уменьшение» полости были включены случаи с уменьшением размера и количества полостей, бесследным исчезновением полостей, образованием рубцов и/или фиброза, и/или образованием тонкостенных полостей; в признак «без динамики» - включали все случаи, когда динамики развития полостей не наблюдалось. Сравнительная динамика полостей распада представлена в табл. 7.
Таблица 7. Сравнительная динамика полостей распада в течение всего периода лечения, абс.
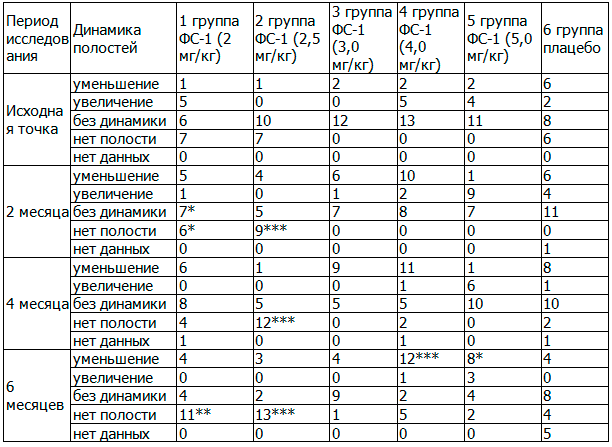
Из табл. 7 видно, что до начала терапии все группы были однородными и возможно их последующее сравнение в течение всего периода исследования. Через два месяца терапии на обзорной рентгенограмме обнаружено, что в 1-й группе увеличение полостей распада сократилось с 26,3% до 5,3%, в 4-й группе - с 25,0% до 10,0% в 5-й - с 23,5% до 0%, тогда как в группе плацебо, наоборот, наблюдалось увеличение данного показателя с 9,1% до 18,2%, то есть в два раза. Кроме того, из табл. 7 видно, что возрос удельный вес «уменьшения полостей» во всех основных группах почти в 3-5 раз от исходного значения, тогда как в группе плацебо - данный показатель не изменился. За счет вышеуказанных изменений в основных группах уменьшился удельный вес случаев «без динамики» до 5 - 35,7%, тогда как в группе плацебо, наоборот, увеличился на 13,6%. Достоверные различия по динамике развития полостей распада были обнаружены между группами плацебо и 1-й, 2-й основными группами, где P<0,05; P<0,01, соответственно.
Через 4 месяца терапии удельный вес «увеличения полостей» вырос только в 5-й группе на 11,8%, и в группе плацебо сохранялся на уровне 4,5%. Динамика по признаку «уменьшение полости распада» выросла в 1-й группе на 26,3%, в 3-й - на 50,0%, в 4-й - на 45,0%, в 5-й - на 23,5%, в контрольной - на 19,8% (таб. 7). По признаку «без динамики» наблюдалось уменьшение удельного веса почти во всех основных группах: во 2 -й - на 27,8%, в 3-й - на 50,0%, в 4-й - на 40,0%, в 5-й - на 5,9%, в контрольной и 1-й группах - повышение на 9,1 и 10,5%, соответственно. В итоге в основных группах увеличился удельный вес по признаку «нет полости» во 2-й группе - на 27,8%, в 4-й группе - на 20,0%; в 1-й группе - в 21,1% случаев наблюдалось отсутствие полости, тогда как в группе контроля - лишь в 9,1% (таб. 7). При сравнении результатов исследования по данному признаку между основными группами и плацебо, достоверные различия были обнаружены только со 2-й группой, где P<0,01 (табл. 7).
Через 6 месяцев терапии у большинства пациентов основных групп наступило исчезновение полостей распада: так в 1-й группе - у 57,9%, во 2-й - у 72,2%, в 3-й - у 7,1%, в 4-й - у 25,0%, в 5-й - у 11,8%, в группе контроля - в 18,2%. Несмотря на то что, исчезновение полостей наблюдалось и в группе контроля, необходимо отметить, что в основных группах отмечалась положительная динамика в сторону уменьшения и исчезновения полостей распада, тогда как в контрольной группе, наоборот - увеличения (таб. 7). При сравнении динамики развития полостей распада между контрольной и основными группами, достоверные различия по критерию χ2 были обнаружены между 1-й, 2-й основными и контрольной группами (табл. 7). Рис. 1 наглядно иллюстрирует динамику исчезновения полостей распада во всех исследованных группах. Как видно из рисунка, через 6 месяцев терапии наибольший удельный вес исчезновения полостей распада наблюдался в 1-й и во 2-й основных группах - 57,9 и 72,2%, соответственно, где также были обнаружены достоверные различия по критерию χ2 в сравненнии с группой плацебо (P<0,025 и P<0,01, соответственно).
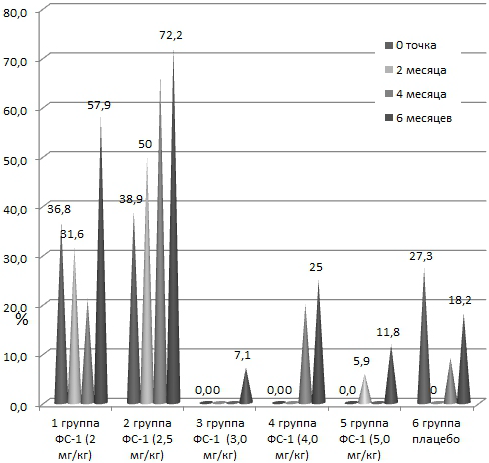
Рис. 1. Динамика разрешения полостей распада у больных с МЛУ ТБ легких, %.
Таким образом, результатами исследования и анализа динамики обзорной рентгенологической картины при МЛУ ТБ доказано, что применение нового казахстанского лекарственного средства ФС-1 в комплексе с противотуберкулезными препаратами второго ряда эффективнее влияло на завершение инволюции легочного туберкулезного процесса, выражающаяся в рассасывании участков туберкулезного воспаления в легких, завершении процессов фиброзирования, уплотнения и обызвествления очагов и фокусов, в закрытии полостей распада. Следовательно, новое казахстанское лекарственное средство ФС-1 обладает репаративными, регенераторными фармакологическими свойствами. Учитывая, что исследованные признаки являются рентгенологическими критериями клинического излечения туберкулеза легких, следовательно, лекарственное средство ФС-1 в комплексной противотуберкулезной терапии при МЛУ ТБ способствует клиническому излечению и является наиболее эффективным, в сравнении с стандартной терапией противотуберкулезными препаратами второго ряда.
