Одним из перспективных направлений фармакологии является разработка препаратов, содержащих йод. Несмотря на уникальные и полезные свойства, их использование ограничивалось, так как йод относится к сильным окислителям и обладает выраженной реакционной способностью. В медицине радиоактивный йод применяется при диагностике и терапии рака. Препараты йода также используются, как рентгеноконтрастные вещества при исследованиях сосудов и сердца, матки и фаллопиевых труб, печени и желчного пузыря. Йод используется в лекарственных препаратах, применяемых при заболеваниях щитовидной железы.
В организме человека йод является одним из важных элементов, участвующих в различных физиологических процессах [1-3]. Универсальность йода заключается в его роли в регуляции процессов роста и развития, как отдельных органов и тканей, так и целого организма [4].
При поступлении в организм йодиды окисляются ферментативным путем до молекулярного йода. Молекулярный йод вытесняет водород в бензольном кольце аминокислоты тирозина, образуя моно- и дийодтирозины. В последующем формируются биологически активные соединения: тетрайодтиронин и трийодтиронин, которые оказывают свое специфическое действие на обменные процессы в клетках тиреочувствительных тканей. В результате метаболизма тиреоидных гормонов происходит освобождение йодидов, которые попадают в кровь, и начинается новый цикл кругооборота йода в организме [5].
Активной субстанцией и основным метаболитом йодсодержащих препаратов является йодид-ион [3]. Максимальная суточная доза йодид-ионов, не оказывающих никакого воздействия на физиолого-биохимические показатели, составляет от 200 до 1000 мкг [4]. В токсических дозах йодиды действуют на кожу, кардиоваскулярную, легочную, пищеварительную, мочевыделительную, кроветворную, нервную, костно-суставную и репродуктивную системы. Но основной мишенью является щитовидная железа и регуляция уровня тиреоидных гормонов [5]. В целом, действие йодидов на тиреоидную систему подразделяется на три типа: гипотиреодизм, гипертиреодизм и тиреодиты. Поглощение йода и его накопление в количествах, превышающих концентрацию в плазме крови, имеет место в слюнных железах, слизистой желудка, плаценте, стекловидном теле глаза, паутинном сплетении, молочных железах. Однако накопление йода в этих тканях не стимулирует синтез ТТГ [6, 7]. Избыток поступления йода в организм приводит к развитию йодизма (насморк, крапивница, слюнотечение, слезотечение, сыпь). Наблюдаются различные многосистемные сдвиги, куда относятся нервозность, повышенная раздражительность, бессонница, слабость, потливость. Также происходит увеличение щитовидной железы, пучеглазие, тахикардия, частые головные боли, снижение умственной и физической работоспособности, головокружение, резкое повышение основного обмена и температуры тела, увеличение потребления пищи и, вместе с тем, потерей веса [6]. Иногда пероральный прием йодсодержащих препаратов может вызвать аллергическую реакцию (крапивница, лихорадка). Могут наблюдаться ангйодема, васкулиты, перитонит и пневмониты, а также активация комплемента. Исследования на животных не показывали какие-либо тератогенные эффекты [8].
Токсическая доза йода составляет 2-5 мг/сутки, летальная доза - 35-350 мг. Острые отравления йодом наблюдались при приеме внутрь настойки йода. Смерть наступала при употреблении 17-120 мг/кг йода в растворе йодида калия в течение 48 часов. Симптомами токсического воздействия йода являются диарея, повреждение слизистой желудочно-кишечного тракта, отек лица и шеи, пневмония, гемолитическая анемия, метаболический ацидоз, жировая дистрофия печени и повреждение почечных канальцев [9]. В клинической практике описаны случаи, когда 5-и месячному ребенку сделали клизму 100 мл раствора повидона без серьезных последствий. Анализ литературных данных показывает, что иногда однократное введение 10 г и более йодидов не вызывает острого отравления, хотя летальными являются 3-5 г [10, 11].
Для лечения туберкулеза с множественной лекарственной устойчивостью в Казахстане разработано новое лекарственное средство ФС-1, который представляет собой ионный наноструктурированный комплекс из карбогидратов, белков и полипептидов, йода и галогенидов щелочных и щелочноземельных элементов [12, 13].
Учитывая, что для йода и его метаболитов основной мишенью является щитовидная железа и регуляция уровня тиреоидных гормонов, мы изучили влияние терапевтических доз ФС-1 на динамику тиреоидных гормонов у больных туберкулезом легких с множественной лекарственной устойчивостью.
Цель исследования: изучить влияние терапевтических доз ФС-1: 2,0 - 2,5 - 3,0 - 4,0 - 5,0 мг/кг массы тела в комплексе с противотуберкулезными препаратами второго ряда на динамику тиреоидных гормонов, путем исследования динамики тиреотропного гормона (ТТГ), трийодтиронина свободного (FT3), трийодтиронина общего (Т3), тироксина свободного (FT4), тироксина общего (Т4).
Материалы и методы.
Дизайн исследования: рандомизированное, плацебоконтролируемое, многоцентровое исследование.
Субъекты исследования: пациенты с МЛУ ТБ, подтвержденные культурально, тестом лекарственной чувствительности и / или бактериоскопически (БК+). Всего приняло участие 220 больных с МЛУ ТБ.
Объект исследования: новое лекарственное средство ФС-1, разработанное «Научным центром противоинфекционных препаратов» (Казахстан), который представляет собой ионный наноструктурированный комплекс из карбогидратов, белков и полипептидов, йода и галогенидов щелочных и щелочноземельных элементов [12, 13].
Методы исследования: определение гормонов щитовидной железы проводилось на иммунохимических анализаторах «Elecsys 2010» (Рош, Германия) и «Olympus AU3000i» (Япония).
Статистический анализ: для проверки достоверности результатов исследования применен метод непараметрической статистики - χ2, Р - уровень значимости, указывающий на статистически достоверные различия между показателями динамики тиреоидных гормонов [14]. Для статистического расчета каждого показателя тиреоидных гормонов использовались следующие качественные признаки: «норма», «выше нормы», «ниже нормы». Пропущенные исследования также были учтены как «нет данных». Также непараметрический метод использован для оценки однородности групп по половому признаку, клиническим формам и локализации патологического туберкулезного процесса.
Схема исследования. Для изучения терапевтической эффективности ФС-1 в комплексной противотуберкулезной терапии при МЛУ ТБ были исследованы следующие дозы: 2,0 - 2,5 - 3,0 - 4,0 - 5,0 мг/кг.
Для сравнения терапевтической эффективности ФС-1 добровольцы были рандомизированы на 5 основных и 1 контрольную группы. В основных группах добровольцы получали ПВР + ФС-1; в контрольной группе: ПВР + плацебо. Для подбора наиболее эффективной и переносимой дозы ФС-1 основные группы были рандомизированы по исследуемым дозам ФС-1: 1 группа - ПВР + ФС-1 2,0 (мг/кг); 2 группа - ПВР+ ФС-1 2,5 (мг/кг); 3 группа - ПВР + ФС-1 3,0 (мг/кг); 4 группа - ПВР + ФС-1 4,0 (мг/кг) и 5 группа - ПВР + ФС-1 5,0 (мг/кг). Продолжительность комплексной терапии составила 6 месяцев. Исследуемое лекарственное средство и / или плацебо принимали 1 раз в сутки, утром, натощак.
Схема обследования тиреоидных гормонов: до начала терапии, через 3, 6, 7, 9, 12, 18 месяцев. Исследование тиреоидных гормонов при дозах ФС-1 3,0, 4,0, 5,0 мг/кг массы тела через 3 месяца не проводились.
Результаты исследования
В клиническое исследование были включены больные в возрасте от 18 до 65 лет, получающие противотуберкулезную терапию по IV категории, то есть лица с множественной лекарственной устойчивостью, выделяющие устойчивые штаммы МБТ к ПТП первого ряда. Из 220 включенных пациентов до конца исследования приняли участие 118. Характеристика субъектов исследования по половому признаку представлена в табл. 1.
Таблица 1. Распределение субъектов исследования по полу, абс.
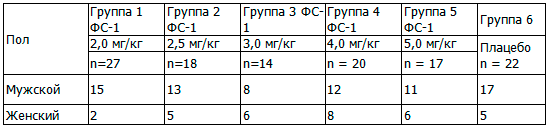
Из табл. 1 видно, что по половому признаку субъекты исследования распределены примерно одинаково, достоверных различий не выявлено, то есть по указанным признакам группы являются однородными и возможно их сравнение между собой.
В табл. 2 представлена характеристика субъектов исследования по клиническим формам.
Таблица 2. Распределение субъектов исследования по клиническим формам туберкулеза легких, абс.
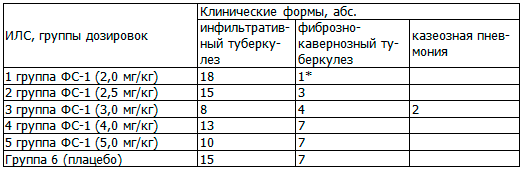
Примечание: * - статистически значимые различия по критерию χ2 между 1-й группой и группой плацебо, где Р<0,05.
При сравнении показателей между основными и контрольной группами достоверных различий не обнаружено, за исключением 1 группы, где фиброзно-кавернозный туберкулез был только у 1 пациента и составил 5,3%.
Учитывая, что для оценки туберкулезного процесса и тяжести заболевания, имеет значение локализация туберкулезного процесса, пациенты были рандомизированы по фактору: односторонний и двусторонний. В табл. 3 представлена характеристика субъектов исследования по локализации процесса.
Таблица 3. Распределение субъектов исследования по локализации туберкулезного процесса в легких, абс. (%)
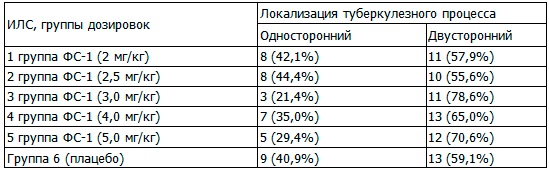
Из табл. 3 видно, что по локализации туберкулезного процесса в легких группы почти одинаковые, достоверных различий по критерию Хи-квадрат также не обнаружено.
Учитывая, что йодсодержащие препараты вызывают субклинический гипотиреоз, основным критерием которого является уровень ТТГ в крови, нами проведен анализ этого показателя у больных туберкулезом с множественной лекарственной устойчивостью. Однако, мы должны помнить, что многие противотуберкулезные препараты (изониазид, ПАСК, пиразинамид, протионамид и др.) способствуют развитию гипотиреоза [15-18]. Так по данным Лепшиной С.М. и др. частота возникновения гипотиреоза при применении противотуберкулезных препаратов составляет от 3,5 до 23%, по данным Ливчане Э. - до 25% [15, 16].
В табл. 4 представлена динамика ТТГ у больных туберкулезом с МЛУ до начала исследования, динамика в период получения терапии и на этапе наблюдения до 18 месяцев.
Таблица 4. Сравнительная динамика ТТГ у больных туберкулезом с МЛУ, абс.
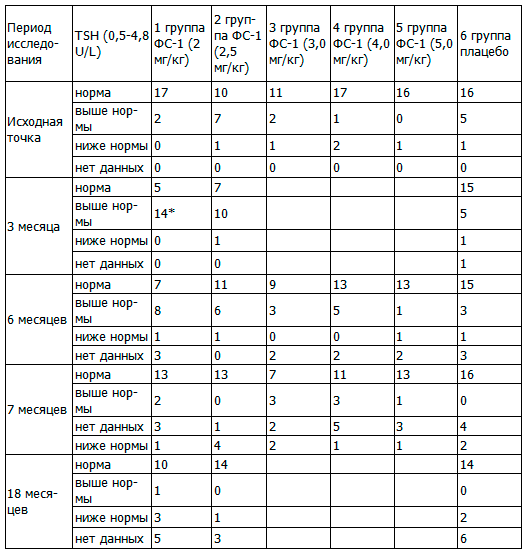
Примечание: статистически значимые различия по качественным признакам тиреотропного гормона между основными и контрольной группами, где * - Р<0,025.
Из табл. 4 видно, что до начала исследований повышение ТТГ в основных группах наблюдалось в пределах от 0 до 38,9%, в контрольной - 22,7%. Однако, достоверных различий не обнаружено. Через 3 месяца терапии в 1-й и во 2-й основных группах наблюдалось повышение ТТГ у большинства субъектов исследования (73,7 и 55,6%, соответственно), тогда как в контрольной - лишь у менее, чем четверти (22,7%), что имело достоверные различия между 1-й и контрольной группами, где Р<0,025. К концу терапии, несмотря на то, что у некоторых субъектов исследования ТТГ сохранялся повышенным (от 5,9 до 42,1%), достоверных различий между группами не обнаружено. Через 1 месяц после прекращения приема исследуемого препарата или плацебо повышение ТТГ в основных группах наблюдалось в пределах от 0 до 21,4%, в контрольной - 0%. Отдаленные результаты наблюдений, которые были зарегистрированы через 12 месяцев после прекращения приема исследуемого препарата или плацебо, свидетельствовали о том, что повышение ТТГ наблюдалось в 1-й группе до 5,3%, тогда как во 2-й и в контрольной ни у кого повышения ТТГ не наблюдалось, достоверных различий по данному показателю между группами не обнаружено (табл. 4).
До начала комплексной терапии субъекты исследования имели измененный статус по уровню FТ4, так в 4-й группе - в 50,0% случаев, где FТ4 выше нормы в 35,0% случаев, ниже нормы - в 15,0%; в 5-й группе - в 47,0%, где в половине случаев - выше нормы, в половине - ниже нормы; во 2-й группе - в 27,8%, где 22,2% - выше нормы, 5,6% - ниже нормы; в 1-й группе - выше нормы в 10,5%, ниже нормы - 5,3%; в контрольной группе в 27,3% случаев - выше нормы. Однако, достоверных различий по критерию χ2 между показателями FТ4 основных и контрольной групп не обнаружено. Через 3 месяца терапии у большинства субъектов (68,4 - 77,3%) FТ4 был в пределах нормы. Снижение показателя FТ4 наблюдалось в пределах 9,1 - 16,7%, в том числе в контрольной группе.
Через 6 месяцев терапии у большинства субъектов (от 55,0 до 77,8%) FТ4 сохранялся в пределах нормы. Снижение FТ4 наблюдалось в 35,0% случаев в 4-й группе, в 23,5% - в 5-й группе, в 21,1% - в 1-й группе, в 11,1% - во 2-й группе, в 9,1% - в контрольной группе, в 3-й группе - снижения FТ4 не наблюдалось.
Через 1 месяц после отмены терапии с применением ФС-1 и / или плацебо наблюдалось повышение FТ4 в 26,3% случаев в 1-й группе, в 38,9% - во 2-й группе и в 9,1% - в контрольной группе, снижение FТ4 наблюдалось в 40,0% случаев в 4-й группе (где Р < 0,05, в сравнении с контрольной группой), в 23,5% - в 5-й группе, в 10,5% - в 1-й группе, в 9,1% - в контрольной группе, в 5,6% - во 2-й группе. Не отмечалось ни повышения, ни снижения FТ4 в 3-й группе. Через год после отмены терапии с применением ФС-1 и / или плацебо у всех обследованных во 2-й группе FТ4 был в пределах нормы (Р<0,01, в сравнении с контрольной группой), в 1-й группе - был повышен у 26,3%, в контрольной - в 23,8%.
В табл. 5 представлена динамика тироксина общего у больных туберкулезом с МЛУ до начала исследования, в период получения терапии и на этапе наблюдения до 18 месяцев.
Таблица 5. Сравнительная динамика тироксина общего у больных туберкулезом с МЛУ, абс.
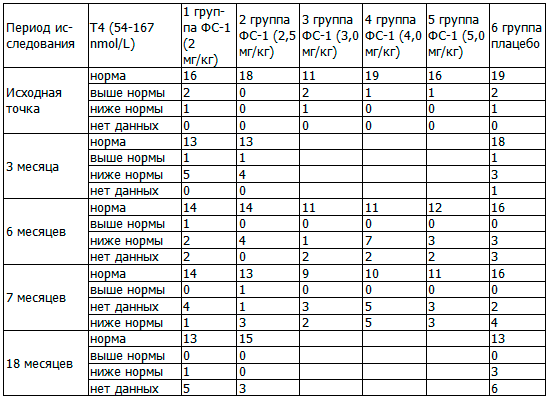
Примечание: статистически значимые различия по качественным признакам тироксина общего между основными и контрольной группами, где * - Р<0,05.
Из таблицы 5 видно, что самая благополучная группа по данному показателю оказалась 2-я группа, то есть у всех субъектов исследования Т4 был в пределах нормы. В 4-й и 5-й группах в 95,0% и 94,1% случаев, соответственно, также Т4 был в пределах нормы. В 1-й и контрольной группах в 84,2% и 86,4% случаев Т4 был в пределах нормы. Хуже всего было положение в 3-й группе, где нормальный показатель Т4 были в 78,6%. Однако, достоверных различий по критерию χ2 по данному показателю между основными и контрольной группами не обнаружено.
Через 3 месяца терапии более чем у 20% исследуемых субъектов в 1-й и во 2-й группах наблюдалось снижение Т4, тогда как в контрольной группе ни у кого снижения Т4 не наблюдалось.
Через 6 месяцев терапии у 35,0% исследуемых субъектов в 4-й группе, у 22,2% во 2-й группе, у 17,6% в 5-й группе, у 10,5% в 1-й группе и у 7,1% в 3-й группе наблюдалось снижение Т4, тогда как в контрольной группе - ни у кого снижения Т4 не наблюдалось.
Через 1 месяц после отмены исследуемого препарата и / или плацебо удельный вес больных со сниженным Т4 уменьшился во всех группах: до 5,3% в 1-й группе, до 16,7% - во 2-й группе, до 14,3 - в 3-й группе, до 25,0% - в 4-й группе, до 17,6% - в 5-й группе, до 18,2% - в контрольной.
Через год после отмены исследуемого препарата и / или плацебо снижение Т4 наблюдалось в 5,3% и 13,6% случаев в 1-й и контрольной группах, соответственно, тогда как во 2-й группе - ни у кого не наблюдалось ни повышения, ни понижения Т4.
Учитывая, что во 2-й группе до исследования в 100,0% случаев уровень тироксина общего был в пределах нормы, на примере 2-й группы можно сделать вывод, что прием ФС-1 способствовал снижению тироксина общего в 22,2% случаев, после отмены ФС-1 уровень тироксина общего нормализовался у всех субъектов исследования.
Необходимо отметить, что во 2-ой основной группе корреляционная связь между показателями ТТГ и Т4 в период применения комплексной терапии с ФС-1 составляла 99%, хотя до начала и после окончания терапии - не наблюдалась. В контрольной группе, наоборот, в период применения комплексной терапии с плацебо - корреляционной связи не наблюдалось, тогда как до начала терапии и после окончания терапии наблюдалась корреляционная связь между показателями ТТГ и Т4 в пределах 95 - 99%.
До начала комплексной терапии свободная фракция трийодтиронина была в пределах нормы в 54,5 -78,9% случаев. Повышение данного показателя наблюдалось в пределах 21,1 - 42,9%, снижение -от 0 до 16,7%. Достоверных различий по данному показателю между основными и контрольной группами не обнаружено. Через 3 месяца терапии удельный вес исследуемых субъектов с повышением FТ3 уменьшился в 1-й группе с 21,1 до 15,8%, в контрольной - с 36,4 до 18,2%, во 2-й группе, наоборот, - увеличился с 22,2 до 27,8%; удельный вес исследуемых субъектов со снижением FТ3 также уменьшился во 2-й группе с 16,7 до 5,6%, в контрольной - с 9,1 до 0%. Через шесть месяцев терапии удельный вес исследуемых субъектов с повышением FТ3 уменьшился в 1-й группе с 21,1 до 10,5%, в 3-й группе - с 42,9 до 28,6%, в 4-й -с 30,0 до 15,0%, в 5-й - с 41,2 до 5,9%, в контрольной - с 36,4 до 22,7%, во 2-й группе - увеличился с 22,2 до 44,4%; удельный вес исследуемых субъектов со снижением FТ3 также уменьшился во 2-й группе с 16,7 до 5,6%, в 4-й группе - с 10,0 до 0%, в контрольной - с 9,1 до 0%, в 5-й - наоборот, увеличился с 0 до 23,5%. Определенной динамики FТ3, связанной с применением ФС-1, не наблюдалось. Достоверных различий по данному показателю между основными и контрольной группами не обнаружено.
Через 1 месяц после отмены исследуемого препарата и / или плацебо увеличился удельный вес исследуемых субъектов с повышением FТ3 в 1-й группе с 21,1 до 52,6%, во 2-й - с 22,2 до 44,4%, в контрольной - с 36,4 до 45,5%, тогда как в других основных группах наблюдалось уменьшение удельного веса исследуемых субъектов с повышением FТ3: в 3-й - с 42,9 до 35,7%, в 4-й - с 30,0 до 10,0% (Р<0,05, в сравнении с контрольной группой), в 5-й - с 41,2 до 5,9% (Р<0,05, в сравнении с контрольной группой). В 5-й группе увеличился удельный вес субъектов со сниженным уровнем FТ3 с 0 до 25,0%. Как видим, данные разноречивые.
Через год после отмены исследуемого препарата и/или плацебо наблюдалось уменьшение удельного веса исследуемых субъектов с повышением FТ3 в 1-й группе с 52,6 до 47,4%, во 2-й - с 61,1 до 38,9%, в контрольной - с 54,5 до 31,8%. Достоверных различий по критерию χ2 по данному показателю между основными и контрольной группами не обнаружено.
До начала комплексной терапии группы по уровню трийодтиронина общего однородные, исключая 4-ю группу, где удельный вес исследуемых субъектов с повышением Т3 в 5-7 раз выше, чем в других основных группах и почти в 2,5 раза больше, чем в контрольной. Однако, достоверных различий по критерию χ2 по данному показателю между основными и контрольной группами не обнаружено. Через 3 месяца терапии изменения примерно такие же, как и до начала терапии. Через 6 месяцев терапии несколько увеличился удельный вес исследуемых субъектов с повышением Т3: в 1-й группе - с 5,3 до 10,5%, во 2-й - с 5,6 до 16,7%. В других основных группах наблюдалось уменьшение удельного веса исследуемых субъектов с повышением Т3: в 3-й группе - с 7,1 до 0%, в 4-й - с 35,0 до 5,0%, в 5-й - с 5,9 до 0%, в контрольной - с 13,6 до 0%. В 1-й и во 2-й группах появились лица со снижением уровня Т3 (15,8 и 5,6%, соответственно). Данные результаты свидетельствуют о том, что определенной взаимосвязи в динамике уровня трийодтиронина в группах не обнаружено. Достоверных различий по данному показателю между основными и контрольной группами также не обнаружено.
Через 1 месяц после отмены исследуемого препарата и / или плацебо сократился удельный вес исследуемых субъектов с повышением Т3: в 1-й, 3-й, 4-й, 5-й группах - до 0%, во 2-й - с 16,7 до 5,6%, в контрольной с 13,6 до 9,1%. Через год после отмены исследуемого препарата и / или плацебо наблюдалось сокращение удельного веса исследуемых субъектов с повышением Т3: в 1-й группе - до 0%, во 2-й - с 16,7 до 5,3%, в контрольной - с 13,6 до 9,1%. Достоверных различий по критерию Хи-квадрат по данному показателю между основными и контрольной группами не обнаружено.
Заключение. Результаты исследований позволяют констатировать, что ФС-1 так же, как и другие йодсодержащие лекарственные средства, у большинства субъектов исследования (55,6 - 73,7%) способствовал повышению уровня тиреотропного гормона и снижению уровня тироксина общего Т4 более, чем у 20 - 35%. После отмены ФС-1 ТТГ и Т4 постепенно восстанавливались до нормальных значений у большинства субъектов исследования.
Учитывая, что по другим показателям тиреоидных гормонов четкой динамики не наблюдалось, считаем, что ФС-1 в 55,6 - 73,7% случаев способствовал развитию транзиторного субклинического гипотиреоза, что согласуется с литературными данными [19].
С появлением высокочувствительных методов гормональной диагностики было сформировано понятие о субклинических формах дисфункции щитовидной железы. Термин «субклинический» означает, что имеются изменения уровня ТТГ в то время, как все остальные функциональные параметры щитовидной железы остаются в пределах нормы [20]. Субклинический гипотиреоз не требует заместительной терапии.
Вывод. Лекарственное средство ФС-1 в 55,6 - 73,7% случаев способствовал развитию транзиторного субклинического гипотиреоза.
