Введение. Стратификация кардиоваскулярного риска у пациентов, страдающих эссенциальной артериальной гипертензией (АГ), включает оценку гемодинамического компонента, выраженности факторов риска и наличия поражения органов-мишеней. Продолжается активное изучение факторов, инициирующих и поддерживающих ремоделирование сердечно-сосудистой системы [16, 31, 33, 34]. Выраженность структурно-функциональных изменений миокарда далеко не всегда соответствует степени АГ и является достаточно частой находкой среди лиц с отсутствием очевидных гемодинамических причин ее развития. Обсуждается генетическая предрасположенность к развитию ремоделирования сердца, которая реализуется в определенных гемодинамических и нейрогуморальных условиях [3, 38, 42]. В последние годы возросло внимание к проблеме состояния левого предсердия при гипертонической болезни. Своевременное выявление начальных признаков неблагополучия со стороны органов-мишеней позволяет значительно оптимизировать подходы к профилактике и лечению выявленных изменений, замедлению реализации сердечно-сосудистого континуума.
Цель исследования. Оценить состояние ренин-ангиотензин-альдостероновой системы (РААС), инкреторной функции поджелудочной железы и инсулинорезистентность у пациентов с эссенциальной АГ с учетом объемных характеристик левого предсердия.
Материал и методы. Обследовано 92 человека (50 мужчин и 42 женщины) без нарушений углеводного обмена, средний возраст которых составил 58,3±12,0 лет. На основании комплексного обследования, включающего данные трансторакальной эхокардиографии, испытуемых разделили на три группы в зависимости от особенностей нозологической принадлежности и объемных параметров левого предсердия (ЛП). В 1-ю группу (контроля) включили 30 нормотензивных субъектов (16 мужчин, 14 женщин), не имеющих клинически значимой патологии со стороны внутренних органов и характеризующихся нормальными геометрическими параметрами камер сердца. Во 2-ю группу включили 31 пациента (18 мужчин и 13 женщин) с эссенциальной артериальной гипертензией (АГ) с нормальным объемом левого предсердия, индексированным по площади поверхности тела (20,9±4,5 мл/м2). В 3-ю группу включили 31 пациента (17 мужчин и 14 женщин) с АГ, имеющих увеличенный индекс объема левого предсердия (34±7,3 мл/м2). Пациенты 2-й и 3-й групп представляли собой лиц с гипертонической болезнью II-III стадии без клинически значимой сопутствующей патологии со стороны эндокринной, дыхательной, пищеварительной систем. Диагноз АГ и степень повышения АД устанавливали в соответствии с рекомендациями экспертов ВНОК/РМОАГ [1]. Исходная характеристика обследованных лиц представлена в табл. 1. Группы были сопоставимы по возрасту, полу, индексу массы тела (ИМТ).
Таблица 1. Исходная характеристика обследованных лиц
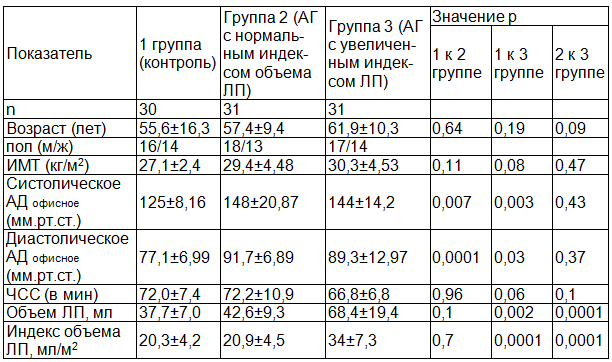
Испытуемые каждой группы не различались по показателю частоты сердечных сокращений (1-я к 2-й группе: р=0,96; 1-я к 3-й группе: р=0,06; 2-я к 3-й группе: р=0,1). Величины систолического и диастолического АД, оцененные в соответствии с существующими рекомендациями в офисных условиях, у пациентов 2-й и 3-й групп не различались между собой (p=0,43; p=0,37 соответственно), но закономерно превосходили таковые у лиц группы контроля (1-я ко 2-й группе: p=0,007; p=0,0001; 1-я к 3-й группе: p=0,003; p=0,03 соответственно). Абсолютный и индексированный по площади поверхности тела объем левого предсердия у пациентов 1-й и 2-й группы, исходя из дизайна работы, достоверно не различались (p=0,1; p=0,7 соответственно), но существенно уступали таковым у лиц 3-й группы (1-я к 3-й группе: p=0,002; p=0,0001; 2-я к 3-й группе: p=0,0001; p=0,0001 соответственно).
Эхокардиографию выполняли на ультразвуковом аппарате “ESAOTE, MY LAB 70” (Италия). Оценивали следующие геометрические параметры ЛП: переднезадний, вертикальный и горизонтальный размеры ЛП (мм), объем ЛП (мл) по методу Sympson и индексированный объем ЛП по площади поверхности тела (мл/м²).
Отнесение пациента к категории лиц с нормальным и увеличенным объемом левого предсердия осуществлялось на основании рекомендаций американского общества эхокардиографии [26]. В соответствии с последними, о нормальных объемных характеристиках левого предсердия свидетельствует величина расчетного объема ЛП, индексированная по площади поверхности тела, соответствующая 16-28 мл/м². Об увеличенном индексе объема ЛП свидетельствует величина данного показателя, равная или превышающая 29 мл/м². Указанные значения применимы как для мужчин, так и для женщин.
При помощи радиоиммунологического метода определяли содержание в плазме крови ангиотензина I (нг/мл) и альдостерона (пкг/мл) с использованием стандартных коммерческих наборов реактивов. Все исследования систематически контролировали на точность и воспроизводимость при помощи многокомпонентных сывороток фирмы “DRG” (США) и фирмы “CIS” (Франция-Бельгия-Италия). Исследование глюкозы в сыворотке венозной крови (ммоль/л) осуществляли натощак на биохимическом анализаторе “Adacus” c использованием метода кинетического фотометрирования. Уровень иммунореактивного инсулина плазмы (мЕ/мл) у обследованных лиц исследовали с помощью радиоиммунологических методов с использованием тест-набора Immunotech (Чехия-Франция). Образцы венозной крови, предназначенные для получения плазмы и исследования в ней уровня гормонов РААС и иммунореактивного инсулина, забирали натощак в период с 08 ч 30 минут до 09 ч 00 минут.
Инсулинорезистентность исследовали посредством оценки индекса HOMA-IR, который рассчитывали исходя из концентрации иммунореактивного инсулина и глюкозы плазмы по формуле: инсулин плазмы натощак (мЕ/мл) • глюкоза плазмы натощак (ммоль/л)/22.5. Верхней границей нормы индекса HOMA-IR считали значение 2.77. Величину глюкозы плазмы получали посредством пересчета содержания глюкозы в сыворотке венозной крови, используя формулу: -0,137+1,047 • глюкоза сыворотки венозной крови (ммоль/л) [2].
Обработку данных проводили с помощью программного обеспечения компании StatSoft, Inc. (2008) STATISTICA (data analysis software system), version 6.0 с учетом существующих рекомендаций по статистической обработке данных клинических и лабораторных исследований [12, 13]. Достоверность различия средних значений показателей оценивали с помощью t-критерия по Стьюденту. Различия считали достоверными, если вероятность нулевой гипотезы была меньше 0,05. Табличные данные представлены как средняя±стандартное отклонение (M±δ).
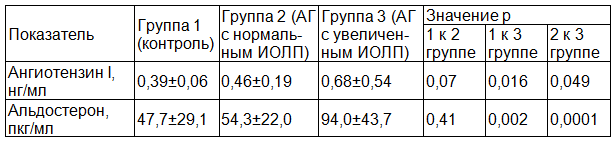
Результаты и обсуждение. Показатели секреции ангиотензина I и альдостерона у обследованных лиц представлены в табл. 2. Как следует из данных этой таблицы, величины показателей гормонов РААС в плазме крови лиц каждой группы соответствовали диапазону нормальных значений, приведенных в инструкциях, прилагаемых к диагностическим наборам, а также установленным у здоровых лиц в ряде других ранее выполненных исследований [5, 17]. Уровень секреции ангиотензина I у пациентов с АГ и нормальным индексом объема ЛП недостоверно превосходил таковой у лиц группы контроля (p=0,07) и существенно уступал ему у больных АГ с увеличенным индексом объема ЛП (р=0,049). Величины данного показателя у пациентов 1-й и 3-й групп различались значимо (p=0,016). Уровень секреции альдостерона оказался наибольшим у пациентов с АГ с увеличенным индексом объема ЛП, достоверно превосходя аналогичный показатель у лиц группы контроля (p=0,0001) и пациентов 2-й группы (p=0,002). Уровень секреции альдостерона у лиц 1-й и 2-й групп оказался сходным (p=0,41).
Таблица 2. Показатели активности РААС у обследованных лиц
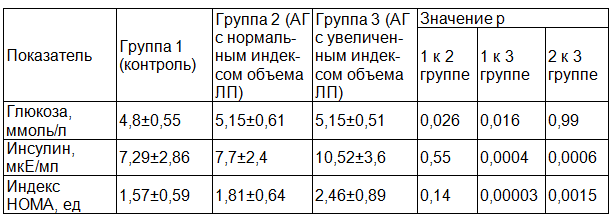
Как следует из данных, приведенных в табл. 3, величины натощаковой гликемии в каждой группе обследованных лиц соответствовали норме. Вместе с тем, у пациентов с АГ уровень глюкозы сыворотки достоверно превышал таковой у лиц группы контроля (1-я к 2-й группе: p=0,026; 1-я к 3-й группе: p=0,016). Уровень глюкозы у лиц 2-й и 3-й групп оказался сходным (p=0,99). Значения секреции инсулина у пациентов с АГ и нормальным объемом ЛП (2-я группа) существенно не отличались от таковых у лиц группы контроля (p=0,55) и заметно уступали аналогичному показателю у больных АГ с увеличенным объемом ЛП (3-я группа) (p=0,0006). Показатель натощаковой инсулинемии у лиц группы контроля значимо был меньше по сравнению с аналогичным показателем у пациентов 3-й группы (p=0,0004).
Индекс HOMA - показатель, по величине которого можно судить о факте наличия и степени выраженности инсулинорезистентности. У лиц с нормальным объемом левого предсердия (1-й и 2-й групп) его значения существенно не различались между собой (p=0,14), но значимо уступали таковому у больных 3-й группы (1-я к 3-й группе: p=0,00003; 2-я к 3-й группе: p=0,0015).
Таблица 3. Показатели состояния углеводного обмена и инсулинорезистентности у обследованных лиц
Полученные в результате настоящего исследования сведения подтверждают данные, полученными другими авторами [6, 18, 41], полагающими, что при АГ процессы морфофункциональной перестройки миокарда тесно связаны с повышением активности РААС. Значимость участия этой регуляторной системы в ремоделирующих процессах у пациентов с эссенциальной гипертензией доказана обнаружением практически линейной зависимости объемных характеристик левого предсердия от уровня секреции ангиотензина I и альдостерона. В ранее выполненных нами исследованиях [17] было также отмечено, что пациенты с АГ, имевшие более выраженное ремоделирование левых камер сердца, по сравнению с пациентами с АГ и несущественными отклонениями от нормы в объемно-размерных параметрах левых предсердия и желудочка характеризовались достоверно большими значениями секреции ангиотензина I и альдостерона.
В работе М.С. Таланцевой [13], изучавшей вопросы нейрогуморальной регуляции кровообращения у 57 пациентов (средний возраст 52,3±5,1 года) с неосложненной эссенциальной АГ в сочетании с хроническим обструктивным бронхитом или бронхиальной астмой в фазе ремиссии и 20 пациентов с АГ (средний возраст 49,5±4,1 лет), не имеющих клинически значимой сопутствующей патологии, было показано следующее. Пациенты с сопутствующей хронической бронхолегочной патологией, имевшие как эксцентрическую, так и концентрическую гипертрофию левого желудочка, характеризовались, в частности, большими величинами секреции альдостерона и передне-заднего размера левого предсердия по сравнению с лицами с изолированной АГ с преимущественно концентрической гипертрофией левого желудочка (альдостерон плазмы: 128±11,4; 98,5±6,1; 73,4±5,39 пкг/мл; левое предсердие: 4,15±0,40; 4,32±0,52; 3,12±0,31 см соответственно).
В соответствии с существующими представлениями [9, 20, 22], локально синтезирующийся в миокарде ангиотензин II активирует протоонкогены, регулирующие процессы клеточного роста и деления и вызывает развитие изменений архитектоники миокарда, а альдостерон является, по мнению ряда авторов [14, 19], не столько стимулятором клеточной гипертрофии, сколько фактором развития фиброза миокарда. В нашей работе у обследованных лиц с АГ в сочетании с увеличенным объемом ЛП подтверждена роль функциональной напряженности РААС в формировании ремоделирования этой камеры сердца.
Базальная секреция инсулина может отражать не только инкреторную функцию поджелудочной железы, но и свидетельствовать о степени чувствительности периферических тканей к этому гормону. Пациенты, страдающие АГ с дилатированным ЛП, характеризовались большими величинами секреции инсулина по сравнению с лицами, имеющими нормальные размеры ЛП. Полученные данные, возможно, подчеркивают информативность исследования натощаковой инсулинемии в отношении прогноза ремоделирования ЛП у пациентов с эссенциальной гипертензией без нарушений углеводного обмена. Пролиферативные свойства инсулина и инсулиноподобного фактора роста в отношении кардиомиоцитов считаются доказанными [24]. А.О. Конради и соавт. [11] также выявили взаимосвязь уровня инсулинемии натощак и выраженности ремоделирования миокарда у лиц страдающих АГ.
Следует отметить, что между АГ и инсулинорезистентностью существует тесная ассоциация. Пациенты с АГ по определению имеют более высокий уровень секреции инсулина, чем нормотензивные субъекты независимо от величины индекса массы тела или распределения жира [36]. Так, в исследовании Н.В. Иванова и соавт. [10] было показано, что мужчины с АГ без расстройств углеводного обмена имели уровень инсулина плазмы, достоверно превышающий таковой у нормотензивных мужчин аналогичного возраста (238 и 137 пмоль/л соответственно; p<0.001).
Показатель инсулинорезистентности (индекс HOMA) у обследованных нами пациентов с увеличенным объемом ЛП оказался достоверно выше, чем у больных АГ с нормальным объемом этой камеры сердца, несмотря на сопоставимость индекса массы тела. Инсулинорезистентность является одним из независимых факторов патогенеза ремоделирования миокарда. Её влияние может реализовываться как через прямые эффекты инсулина и инсулиноподобных факторов роста в отношении кардиомиоцитов, так и через активацию симпатического звена вегетативной нервной системы [27, 30, 39, 40, 43].
В опубликованной нами ранее работе, в которой были изучены объемные характеристики ЛП у 407 пациентов с АГ в возрасте от 40 до 80 лет, было показано, что по мере увеличения возраста увеличивался и индексированный по площади поверхности тела объем ЛП, причем у пациентов с сахарным диабетом 2 типа (большинство из которых характеризуется гиперинсулинемией) наблюдалась большая степень изменений объема ЛП в каждой возрастной группе [8].
Как было установлено в выполненном нами ранее исследовании, пациенты с эссенциальной АГ с выраженной (42 пациента) и умеренной гипертрофией левого желудочка (32 человека) характеризовались неодинаковой степенью инсулинорезистентности [6, 7]. При сопоставимости среднего возраста участников исследования (56,3±3,4 и 57,6±4,2 лет, p>0,05), величины ИМТ (28,5±2,97 и 26,2±1,90 кг/м2, p>0,05), показателей натощаковой гликемии (6,1±0,29 и 5,3±0,28 ммоль/л, p>0,05), больные с выраженной гипертрофией левого желудочка и дилатацией ЛП (индекс массы миокарда левого желудочка (ИММЛЖ) - 213±15,41 г/м2 и переднезадний размер ЛП – 47,7±4.31 мм) по сравнению с лицами с умеренной гипертрофией левого желудочка и незначительными отклонениями размеров ЛП (ИММЛЖ - 146±12,0 г/м2 и переднезадний размер ЛП – 40,6±3.91 мм), характеризовались достоверно большими значениями индекса HOMA-IR (3,58±0,32 и 1,82±0,19 ед; p<0,01).
Патофизиологическая роль РААС у пациентов с АГ, в том числе и с метаболическим синдромам, несомненна. В нескольких исследованиях была обнаружена тесная связь между повышением уровня активности ренина плазмы (АРП) и гиперинсулинемией [21, 32]. Механизмы, связывающие высокую АРП и инсулинорезистентность изучены недостаточно. Напротив, установлена очевидная взаимозависимость инсулинорезистентности, компенсаторной гиперинсулинемии и повышения АД. Механизмы, вовлеченные в эту взаимосвязь, включают инсулин-опосредованную задержку натрия, стимуляцию симпатической нервной системы, активацию роста гладкомышечных клеток сосудов, ухудшение продукции оксида азота эндотелиоцитами [35].
В развитии инсулинорезистентности важную роль играет функциональное состояние РААС [25]. У субъектов с абдоминальным ожирением отмечена повышенная активность РААС, сопровождаемая задержкой натрия и увеличением объема циркулирующей жидкости и ассоциируемая с возрастанием сердечно-сосудистого риска. Выраженный прирост массы тела ассоциирован с гиперсимпатикотонией, приводящей к увеличению продукции ренина и задержке натрия [29]. Ангиотензин-II также вовлечен в контроль адипогенеза в виде регуляции синтеза липидов и их накопления в адипоцитах [37].
Предполагается, что выделяемые жировой тканью жирные кислоты могут способствовать усилению синтеза альдостерона [23]. Имеются указания на существование в висцеральной жировой ткани собственной локальной ренин-ангиотензиновой системы, которая играет важную роль в жизнедеятельности адипоцитов. Предполагается, что ренин-ангиотензиновая система жировой ткани обладает прогипертензивными эффектами. Вполне логично предположить, что циркулирующий в кровотоке альдостерон, в определенной мере, обусловлен гиперпродукцией ангиотензина-II жировой тканью.
У пациентов с высоким риском сахарного диабета 2 типа подавление активности РААС способствует протекции почек, миокарда, снижает риск манифестации диабета, что было продемонстрировано в крупных клинических исследованиях. На клеточном уровне ангиотензин II и альдостерон индуцируют инсулинорезистентность посредством увеличения оксидативного стресса, нарушения паракринных механизмов действия инсулина, что приводит к изменению транспорта глюкозы в клетку. Ангиотензин II вносит вклад в поддержание воспаления, апоптоза в панкреатических бета-клетках. Альдостерон уменьшает стимулированную глюкозой секрецию инсулина in vivo и in vitro в ткани поджелудочной железы и культуре бета-клеток через механизмы, независимые от связи с минералокортикоидным рецептором [28]. Не исключено, что избыточная хроническая гиперактивация РААС у пациентов с сахарным диабетом 2 типа служит фактором, способствующим постепенному развитию у этих лиц абсолютной инсулиновой недостаточности.
Заключение. Положенный в основу исследовательской работы принцип исходного разделения пациентов с АГ без нарушений углеводного обмена на группы в зависимости от ремоделирования левого предсердия, предопределил выявление важных результатов, касающихся ренин-ангиотензин-альдостероновой системы, инкреторной функции поджелудочной железы и показателя инсулинорезистентности, позволяющих рассматривать категорию больных АГ с увеличенным объемом левого предсердия как группу риска с точки зрения раннего поражения органов-мишеней и, по-видимому, неблагоприятного прогноза дальнейшего течения заболевания.
