Введение. Сосудистые заболевания являются лидирующей причиной смертности во всем мире. По статическим данным, ежегодно фиксируется 4,35 млн. смертей в 53 странах-членах Всемирной организации здравоохранения (ВОЗ) Европейского региона и более 1,9 млн. смертей ежегодно в Европейском союзе. От сердечно-сосудистых заболеваний погибает экономически активная часть населения − люди трудоспособного возраста, имеющие профессиональный опыт, что наносит существенный урон экономике и социальной сфере. В основе патогенеза многих заболеваний сердечно-сосудистой системы, в т.ч. ишемической болезни сердца (ИБС), лежит атеросклероз, стенозирующий просвет коронарных артерий [1]. Для восстановления коронарного кровотока, наряду с другими методами реваскуляризации активно применяется коронарное шунтирование [2]. С целью оценки течения атеросклероза в послеоперационном периоде рекомендовано исследование концентрации С-реактивного протеина (СРП) в сыворотке крови [3]. Тем не менее, вопросы применения многих других маркеров течения послеоперационного периода больных, перенесших коронарное шунтирование, не изучались.
Липидвысвобождающая способность лейкоцитов (ЛВСЛ) представляет собой белок синтезирующую функцию, реализуемую в условиях тесного межклеточного контакта в тканях или in vitro, в результате которой синтезируются белки, связывающие холестерин, способные откладываться в интиме сосудистой стенки и других тканях. Метод определения липидвысвобождающей способности лейкоцитов представляет собой экспериментальную индивидуальную модель атеросклероза in vitro, в которой воспроизводится белок− синтезирующая способность нейтрофилов и оценивается количество общего холестерина в супернатанах 3-х суточных культур лейкоцитов, связанного синтезированными белками [4]. Величина ЛВСЛ коррелирует с некоторыми клиническими проявлениями ИБС, течением атеротромботического мозгового инсульта, и рассматривается авторами как независимый фактор риска развития атеросклероза и маркер активности атеросклеротического процесса. Доказано, что увеличение высвобождения белково-липидных комплексов in vitro сочетается с более выраженным атеросклерозом магистральных сосудов [5]. Величина ЛВСЛ и активность белоксинтезирующей функции нейтрофилов у больных в послеоперационном периоде ранее не изучались.
Целью работы являлось изучение патогенетического значения некоторых синтезируемых лейкоцитами воспалительных белков, и ЛВСЛ у больных с ИБС в раннем послеоперационном периоде.
Материалы методы. Набор пациентов проходил на базе кардиологического (гериартрического) отделения Городской клинической больницы №4, г. Пермь. Исследование ЛВСЛ выполнено на базе Центральной научно-исследовательской лаборатории Пермской государственной медицинской академии им. акад. Е.А. Вагнера. Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинской Декларации. Протокол исследования был одобрен Этическим комитетом участвующего клинического центра. До включения в исследование у всех участников было получено письменное информированное согласие.
Для достижения поставленной цели обследовано 30 пациентов, из которых сформировано 2 группы.
Первая группа – пациенты с ИБС (стенокардия напряжения II-III функционального класса - ФК) после операции коронарного шунтирования - КШ (n=15).
Вторая группа − контрольная, в которую вошли практически здоровые лица (n=15). Средний возраст больных первой группы составил – 61,5 год, от 40 до 75 лет, во второй – 50,5 лет, от 39 до 57 лет.
При формировании групп были введены следующие критерии исключения: сахарный диабет, нарушения толерантности к глюкозе, бронхиальная астма, хроническая обструктивная болезнь легких, кардиомиопатии, миокардиты, пороки сердца, нарушение функции щитовидной железы, острые воспалительные заболевания или обострения хронических респираторных заболеваний в течение 2-х недель до включения в группы исследования, значимые нарушения ритма сердца и проводимости. Критерии включении: пациенты с ИБС, обследованные в сроке 2 недель и более после коронарного шунтирования. В группе больных с ИБС у 10 (66,6%) из 15 пациентов имели в анамнезе инфаркт миокарда (ИМ), у трех (33,4%) из них ИМ был повторный. Все пациенты имели артериальную гипертензию III стадии, риск 4, 33 % больных (5 человек) имели хроническую сердечную недостаточность 2 функционального класса и 67% (10 человек) – хроническую сердечную недостаточность 3-го функционального класса. 13 пациентов (85,7%) из 15 имели стенокардию напряжения на уровне III ФК, 2 пациента соответственно (14,3%) нестабильную стенокардию. Среднее количество шунтов составило 2,5±1,7. Все шунты были венозные, у одной пациентки к тому же имелся венозный гомографт.
Дизайн исследования. Выполнено 3 этапа исследования (рис. 1).
1. Предоперационное обследование больных.
2. Обследование через 2 недели после операции КШ.
3. Обследование через 3 месяца после операции КШ.
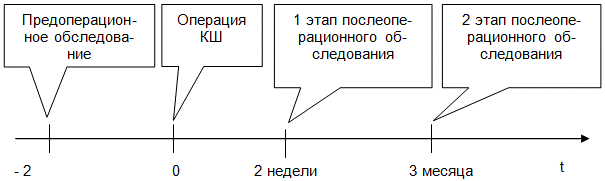
Рис. 1. Дизайн исследования
На 1-м этапе обследование включало: сбор анамнеза (применялась анкета), объективное обследование пациентов, общие клинические методы обследования (общий анализ крови, мочи, определение концентрации глюкозы, общего белка, креатинина, активности трансаминаз в сыворотке крови; электрокардиография - ЭКГ, эхокардиография - ЭхоКГ).
На 2-м этапе выполнялись: анкетирование, осмотр пациентов, контрольные общие клинические исследования, а также специальные методы: определение ЛВСЛ, концентрации общего холестерина в сыворотке крови холестериноксидазным методом, с использованием стандартных наборов фирмы Human.
На 3-м этапе выполняли следующие специальные методы: анкетирование, определение общего холестерина, ЛВСЛ, концентрации липопротеина а - ЛП(а), СРП, и предшественника «мозгового» натриуретического пептида - proBNP в супернатанах 3-х суточной культуры нейтрофилов. Исследовали концентрацию СРП в сыворотке крови больных.
Все пациенты после коронарного шунтирования принимали стандартную терапию: препараты группы ингибиторов АПФ (иАПФ) (рамиприл 2.5 мг или эналаприл 10 мг в сутки или престариум 5 мг), бета-блокаторы (беталок ЗОК 50-100 мг в сутки), статины (аторвастатин 40 мг или крестор 20 мг в сутки), двойная антиагрегантная терапия (100 мг аспирин-кардио и 75 мг плавикс), диуретики.
С целью стандартизации метода опроса больных на всех этапах исследования применяли анкету, которая включала 19 вопросов. Анкета помогла определить относительные жалобы пациентов, оценить основные клинические проявления заболевания, анамнез развития симптомов и факторы риска.
Определение ЛВСЛ проводили согласно методу, предложенному А.В. Туевым и В.Ю. Мишлановым [6]. Метод осуществляли следующим образом. Исследовали образцы венозной крови. Кровь забирали из локтевой вены в количестве 10 мл в стерильную пробирку, содержащую раствор гепарина (500 ЕД). Клеточную суспензию, содержащую лейкоциты, выделяли методом отстаивания в растворе полиглюкина. Соотношение цельной венозной крови и раствора полиглюкина составляло 5:3. Клеточную суспензию дважды отмывали (однократно в физиологическом растворе натрия хлорида и однократно в среде Игла-МЕМ), ресуспендировали в культуральной среде, подсчитывали количество лейкоцитов и эритроцитов в камере Горяева, доводили концентрацию лейкоцитов до 50 000 в 1 мкл (количество эритроцитов не более 0,6-0,8 млн в 1 мкл) и помещали в стерильные флаконы по 0,4 мл. Инкубировали в течение 62 ч при 370 С. Определяли количество общего холестерина (ХС) в надсадочной жидкости холестериноксидазным методом с помощью наборов фирмы Human.
Для изучения белоксинтезирующей функции нейтрофилов, на 3 стуки культивирования в нейтрофильных супернатанах определялись концентрации ЛП(а) (набор фирмы Assa Pro), СРП (набор фирмы Biomerica), натриуретического пептида (proBNP) (набор фирмы Biomedica Slovakia) в супернатанах трехсуточных нейтрофильных культур методом иммуноферментного анализа (ИФА). Исследования выполнены в дублях. Данные, полученные в результате исследования, обрабатывали общепринятыми методами вариантной статистики с применением статистического программного пакета «Statistica 6.0». Количественные признаки, имеющих правильное распределение, представлены в виде М±σ. Оценка достоверности различий между группами наблюдения проводилась на основании определения критерия t Стьюдента для парных сравнений, непараметрического критерия Манна-Уитни. Достоверность различий устанавливалась при р<0,05. Корреляционный анализ осуществлялся методом Спирмена (R).
Результаты. Состояние больных ИБС в послеоперационном периоде характеризовалось удовлетворительным самочувствием. При этом, 3 человека (20%) предъявляли жалобы на небольшую слабость и головокружение при физической нагрузке; у 1 пациента (6,6%) возникали перебои в работе сердца. В 20% случаев (3 человека) пациенты жаловались на одышку, которая возникала при подъеме по лестнице на 2 этажа и более. Все пациенты принимали назначенные препараты (иАПФ, бета-блокаторы, антиагреганты, статины, диуретики). У 2 человек из 15 цифры артериального давления (АД) превысили 140/90 мм рт.ст, им была проведена коррекция терапии. Все пациенты сохраняли полную способность к самообслуживанию. Обращений за медицинской помощью по экстренным показаниям не было. В раннем послеоперационном периоде посткардиотомный синдром развился в послеоперационном периоде у 1 пациента (6,6%).
Таблица 1. Результаты показателей общего анализа крови у больных ИБС до и после оперативного лечения
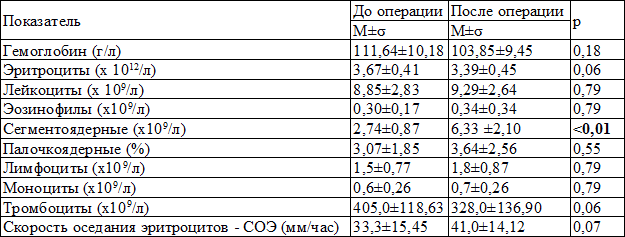
Примечание: здесь и далее р – определено методом сравнения двух групп по количественному признаку (критерий Манна-Уитни), жирным шрифтом выделены достоверные различия показателей в сравниваемых группах
Представленные в табл. 1 результаты обследования больных до и после операции свидетельствуют о наличии анемии легкой степени и нейтрофильного лейкоцитоза с достоверным повышением в послеоперационном периоде. Согласно дизайну исследования ЛВСЛ определялась в послеоперационном периоде. Через 2 недели после коронарного шунтирования ЛВСЛ составила 0,15±0,06 ммоль/л. Корреляционный анализ установил прямую взаимосвязь ЛВСЛ и количества установленных в процессе операции коронарных шунтов (r=0,32, p<0,050). Через 3 месяца – 0,12±0,04 ммоль/л, что соответствовало средней величине данного показателя в контрольной группе 0,12±0,02 ммоль/л. В 80% случаев (12 человек) значения показателя оставались в пределах нормы и лишь в 20% (3 человека) выявлено увеличение показателя. Белок синтезирующая функция нейтрофилов изучалась путем определения концентрации ЛП(а), СРП, proBNP в супернатанах трехсуточных нейтрофильных культур методом иммуноферментного анализа (ИФА).
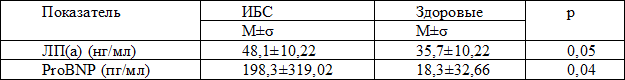
Выявлена достоверная разница между концентрацией СРП в супернатанах трехсуточных нейтрофильных культур у больных ИБС и здоровых лиц. У больных ИБС среднее значение составило 5,1± 3,4мкг/л, что в 3 раза выше, чем у здоровых – 1,88±2,1 мкг/л (p=0,04). Аналогичные различия выявлены между средними величинами концентраций СРП в сыворотке крови. У здоровых средняя концентрация СРП в крови составила 10,3± 10,3мкг/л, у больных ИБС – 44,7±42,7 мкг/л. Разница между группами близка к достоверной (p=0,05). Методом корреляционного анализа установлена прямая корреляционная связь между концентрацией СРБ в сыворотке и супернатанах трехсуточных нейтрофильных культур у обследованных больных ИБС (r=0,64, p=0,0020). У здоровых лиц установлена прямая взаимосвязь между уровнем липопротеина(а) в культуральной жидкости и показателем ЛВСЛ (r = 0,16, p<0,050). Выявлена достоверная разница между двумя группами по величине концентраций ЛП(а) и pro-BNP в супернатанах клеточных культур (табл. 2).
Таблица 2. Концентрации ЛП(а) и ProBNP в супернатанах нейтрофильных культур у больных с ИБС и контрольной группы (нг/мл)
Обсуждение. Непременными участниками атеросклеротического процесса являются лейкоциты. Роль моноцитов, лимфоцитов достаточно хорошо изучена. Мало исследованной остается роль в процессах атерогенеза самой многочисленной фракции лейкоцитов – нейтрофилов. Не смотря на короткий период своей жизни, лейкоциты за счет своей многочисленности и функциональной активности составляют основную линию защиты человека против бактериальных агентов, участвуют в механизмах врожденного иммунитета. Среди многих механизмов противомикробной защиты, осуществляемой нейтрофилами, в последние годы активно изучается роль катионных пептидов, кининов, ангиотензин II и антимикробных протеинов (дефензины, лактоферрин и др.), синтезируемых нейтрофилами. Представляется вероятным активное участие различных белков и пептидов, синтезируемых нейтрофилами в процессах атерогенеза [9]. Результаты проведенного исследования указывают на увеличение ЛВСЛ сразу после коронарного шунтирования до 0,15 ммоль/л и нормализацию его в течение 3 месяцев послеоперационного периода у большинства обследованных больных ИБС (80% случаев). У 3-х больных (20%) отмечено увеличение ЛВСЛ в послеоперационном периоде. Согласно ранее проведенным исследованиям, стабильная форма ИБС не сопровождается увеличением ЛВСЛ больше 0,150 ммоль/л, в связи с чем, увеличение ЛВСЛ более 0,150 ммоль/л предложено использовать ЛВСЛ как критерий нестабильного течения ИБС [8].
Результаты проведенного исследования установили факт синтеза СРП нейтрофилами больных ИБС в послеоперационном периоде, выявлено увеличение концентрации СРП в сыворотке крови больных ИБС и культурах нейтрофилов по отношению к контрольной группе практически здоровых лиц. Следовательно, увеличение ЛВСЛ в раннем послеоперационном периоде и нормализация показателя в течение 3-х месячного периода наблюдения отражает роль воспалительной реакции. Высокое клиническое значение ЛП(а) при ИБС является известным фактом [10]. Результаты настоящего исследования показали, что при воспалительных процессах ЛП(а) высвобождается в культуре лейкоцитов in vitro, что подтверждает мнение о нестабильном течении заболевания в раннем послеоперационном периоде [4]. Изложенные результаты указывают на высокое прогностическое значение ЛВСЛ у больных с ИБС, после коронарного шунтирования. Величина ЛВСЛ, видимо, в большей степени зависит от количества белка, синтезируемого лейкоцитами, обладающего способностью образовывать белково-липидные комплексы [7,8]. Исследование выполнено с использованием средств гранта РФФИ №11-04-96021.
Выводы
1. Выявлено увеличение ЛВСЛ в послеоперационном периоде в 53,3% случаев. Через 3 месяца после операции коронарного шунтирования величина ЛВСЛ снижается и остается в пределах нормы в 80% случаев. В 20% выявлено увеличение показателя.
2. Величина ЛВСЛ напрямую зависит от количества шунтированных сосудов и активности воспалительной реакции организма в послеоперационном периоде.
3. Состав белково-липидных комплексов, освобождаемых нейтрофилами больных ИБС в условиях 3-суточного культивирования, включает СРП, ЛП(а), pro-BNP.
4. Концентрация СРП в сыворотке у пациентов ИБС достоверно выше, чем в контрольной группе.
