В течение двух последних десятилетий значительно возрос интерес к изучению взаимосвязи метаболических нарушений и ожирения с ростом сердечно-сосудистых заболеваний. По данным Фремингемского исследования было установлено, что избыточный вес является достоверным независимым прогностическим фактором сердечно-сосудистых заболеваний у мужчин и женщин [1].
Рассмотрение проблемы метаболического синдрома (МС) началось еще в 1966 г., когда J. Camus предположил возможность анализа взаимосвязи между развитием гиперлипидемии, сахарного диабета 2-го типа (СД 2 типа) и подагры [2]. В 1988 г. G. Reaven описал симптомокомплекс, включавший гиперинсулинемию, нарушение толерантности к глюкозе (НТГ), гипертриглицеридемию, низкий уровень липопротеидов высокой плотности и артериальную гипертензию, под названием синдром X [3].
Позже был выявлен целый ряд состояний, которые ассоциируются с синдромом инсулинорезистентности: гипертрофия левого желудочка с нарушением диастолической дисфункции, повышение внутрисосудистой свертываемости крови и др. В настоящее время наиболее употребляемым термином является «метаболический синдром». Учитывая ведущий патогенетический механизм его развития, нередко в качестве синонима используют термин «синдром инсулинорезистентности». Понятие «метаболический синдром» (МС) было предложено в качестве способа выделения группы людей, имеющих повышенный риск развития сердечно-сосудистых заболеваний (ССЗ) и СД 2 типа, а также для принятия решения о тактике ведения такого пациента, благодаря которой можно добиться исчезновения или, по крайней мере, уменьшения выраженности основных проявлений МС [4]. При этом распространенность ожирения и ассоциированного с ним МС неуклонно растет и в настоящее время носит характер пандемии. Согласно результатам ряда проспективных исследований, у пациентов с МС и нормальной толерантностью к углеводам риск развития сердечно-сосудистых заболеваний и смертности от них повышается в 2-4 раза, а риск развития сахарного диабета в 5-9 раз [5-7]. Таким образом, изучение инсулинорезистентности тканей заставляет включать в зону ее патологического влияния все большее количество сердечно-сосудистых заболеваний. В этой связи, желудочковые нарушения ритма сердца могут стать одним из таких заболеваний.
Желудочковые нарушения ритма сердца (ЖНР) – одна из наиболее распространенных и одновременно недостаточно изученных проблем современной кариологии. Согласно данным различных авторов частота встречаемости идиопатических ЖНР колеблется от 30 до 70%. Существует достаточно большое количество классификаций ЖНР, из которых наиболее часто в клинической практике применяются по B. Lown и M. Wolf в модификации М. Ryan (1975), учитывающие количество и частоты желудочковых эктопий, а также по Т.Bigger (1984), в зависимости от наличия органического поражения сердца [8]. Сформировавшееся мнение, что ЖНР у совершенно здоровых людей являются прогностически благоприятными и относятся к группе неопасных для жизни и здоровья, является не таким уж и очевидным. В частности, опубликованное в 1992 году проспективное исследование Framingeham Heart Study показало, что у мужчин с ЖНР высоких градаций, хотя и без признаков заболевания сердца, в последующем отмечено двукратное увеличение частоты возникновения инфарктов миокарда и внезапной сердечной смерти [9]. А эпидемиологическое исследование MRFIT указывает на повышение риска внезапной сердечной смерти у лиц, на 2-х минутной электрокардиограмме (ЭКГ) которых регистрируются ЖНР [10]. Кроме того A. Kuhn и соавт. приводят случаи развития аритмогенной дисплазии правого желудочка (АДПЖ) через 15 лет от начала появления у больных желудочковой экстрасистолии без видимой патологии миокарда [11].
Метаболический синдром и ЖНР ассоциированы с повышенным риском развития сердечно-сосудистых заболеваний и смертности от них. Однако вопрос взаимоотношения ЖНР и МС не затрагивается большинством исследователей. Проблема желудочковых аритмий у пациентов без ишемической болезни сердца (ИБС), но с наличием метаболического синдрома и других факторов риска практически не изучена. Также не определено значение терапии МС у пациентов с ЖНР, ее влияние на эффективность антиаритмического лечения. Одним из решений усиления эффективности антиаритмической терапии ЖНР является сопутствующая терапия МС, включающая как медикаментозные, так и немедикаментозные методы лечения. Известные механизмы воздействия на МС могут иметь точки приложения и при терапии ЖНР.
Материалы и методы. В исследование включено 60 человек с желудочковыми нарушениями ритма и метаболическим синдромом. Критериями включения в исследование были ЖНР не ниже II градации (по B. Lown, M. Wolf в модификации М. Ryan, 1975) и наличие критериев МС (диагностические критерии Всероссийского научного общества кардиологов по МС) [16].
В число основных ассоциируемых заболеваний входили:
- артериальная гипертензия (АГ) – 56 (93%);
- ИБС (стенокардия напряжения) – 10 (16,7%);
- хроническая сердечная недостаточность I ФК – 42 (70%);
- хроническая сердечная недостаточность II ФК – 18 (30%);
- нарушение толерантности к углеводам (НТУ) – 24 (40%);
- ожирение – 27 (45%).
В исследование не включали лиц с:
- перманентной фибрилляции предсердий,
- атриовентрикулярной блокады 2,3 степени,
- наличием дополнительных пучков проведения,
- острый коронарным синдромом,
- гемодинамически значимыми врожденными или приобретенными пороки сердца,
- инфарктом миокарда в анамнезе,
- хронической сердечной недостаточностью III-IV ФК,
- сахарным диабетом,
- нарушением функции щитовидной железы,
- суб- и декомпенсированным синдромом слабости синусного узла.
Всем пациентам после обследования на исходном фоне (эхокардиоскопия, холтеровское мониторирование ЭКГ, тредмилл-тест) подбиралась эффективная антиаритмическая терапия. Согласно рандомизированным исследованиям в качестве анитаритмической терапии использовались бета-адреноблокаторы, соталол, амиодарон или их комбинации [12-14].
Антиаритмическая терапия считалась эффективной, если общее количество одиночных желудочковых экстрасистол уменьшалось в 4 раза и более, а количество желудочковых эктопий высоких градаций (IVA и выше по B. Lown, M. Wolf в модификации М. Ryan, 1975) не менее, чем в 10 раз или таковые отсутствовали [15]. Все пациенты, участвующие в исследовании и имевшие показания для катетерной аблации ЖНР, категорически от неё отказались. В соответствии с рекомендациями по МС Всероссийского научного общества кардиологов (2009) после проведенного лабораторного обследования применялась антигипертензивная, гиполипидемическая терапия, беседы по коррекции образа жизни, назначался метформин (стремились к суточной дозе 2000 мг) [16].
Важное значение придавалось как снижению веса, так и приему метформина в терапевтической дозе. Несмотря на это, часть пациентов не принимала метформин на этапе наблюдения в связи с плохой переносимостью, либо недостаточной приверженностью к терапии.
В связи с этим, в дальнейшем при анализе результатов, общая группа группа пациентов с ЖНР и МС была разделена на 2 подгруппы в зависимости от получаемой терапии:
- 1-я подгруппа с ЖНР и МС, получавшая наряду с антиаритмической терапией, метформин в терапевтической дозе в течение 3 месяцев (n=42, 22 мужчины и 20 женщин, средний возраст 61,45±10,19),
- 2-я подгруппа с ЖНР и МС, не получавшие метформин в терапевтической дозе в течение 3 месяцев в связи с недостаточной приверженностью к терапии (n=18, 3 мужчин и 15 женщин, средний возраст 65,83±8,1).
Группы были сопоставимы по ассоциированным заболеваниям и сопутствующей терапии (табл. 1).
Таблица 1. Распределение пациентов (абс. %) в зависимости от получаемой исходно терапии
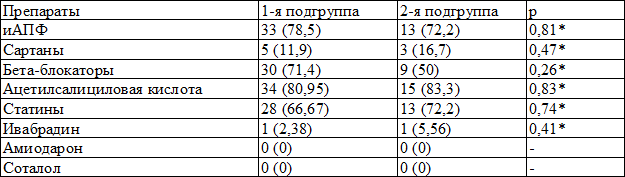
Примечание: иАПФ – ингибиторы ангиотензинпревращающего фермента, * - χ²
Всем пациентам, наряду с клиническим осмотром и определением антропоментрических параметров, проводилось лабораторное обследование, при котором определялось содержание общего холестерина (ОХ, ммоль/л), триглицеридов (ТГ, ммоль/л), холестерина липопротеидов высокой плотности (ЛПВП, ммоль/л) стандартным ферментативным методом с последующим расчетом липопротеинов низкой плотности по формуле Friedewald, расчитывался индекс атерогенности (ИА). Уровень гликемии определяли глюкозооксидазным методом на аппарате КФК-3-01 (Россия), инсулина – иммунохемилюминесцентным методом на аппарате Immulite 2000 (США). Рассчитывали индекс инсулинорезистентности HOMA-2 с помощью компьютерной модели HOMA-2, отражающей логарифмическую зависимость функции бета-клетки поджелудочной железы и чувствительности к инсулину периферических тканей. Пациенты были сопоставимы по лабораторным и клиническим характеристикам (табл. 2).
Таблица 2. Исходные клинические и лабораторные показатели (M±m)
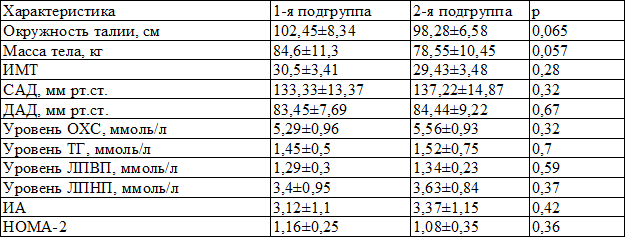
Примечание: САД – систолическое артериальное давление, ДАД – диастолическое артериальное давление, ИМТ – индекс массы тела
Для оценки структурно-геометрических и функциональных показателей миокарда проводили эхокардиоскопию (ЭХОКС) на аппарате ViVID 3 Pro (США). Пациенты были сопоставимы по показателям ЭХОКС (табл. 3).
Таблица 3. Исходные показатели ЭХОКС в группах сравнения (M±m)
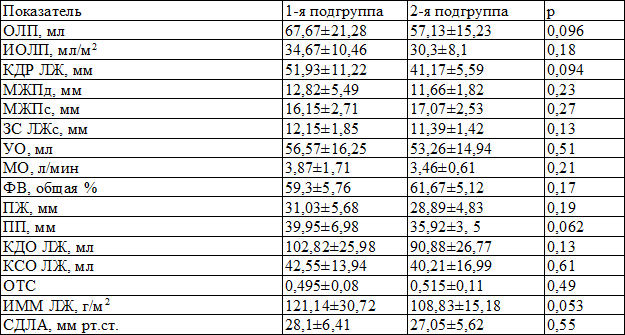
Примечания: ОЛП – объём левого предсердия, иОЛП – индекс объёма левого предсердия, КДРЛЖ – конечно-диастолический размер левого желудочка, МЖПд – межжелудочковая перегородка в диастолу, МЖПс – межжелудочковая перегородка в систолу, ЗСЛЖс – задняя стенка левого желудочка в систолу, УО – ударный объём, МО – минутный объём, ФВ – фракция выброса, ПЖ – правый желудочек, ПП – правое предсердие, КДОЛЖ конечно-диастолический объём левого желудочка, КСОЛЖ – конечно-систолический объём левого желудочка, ОТС – относительная толщина стенок, иММЛЖ – индекс массы миокарда левого желудочка, СДЛА – систолическое давление в легочной артерии
Градация желудочковых эктопий оценивалась с помощью холтеровского мониторирования ЭКГ системы Kenzo 301 (Япония), диагноз ИБС и толерантность к физической нагрузке (ТФН) определялись при проведении тредмилл-теста Schiller (Швейцария) Здесь также не было выявлено достоверно значимых различий исходно (табл. 4).
Таблица 4. Исходные показатели инструментального обследования и показатели ТФН (Me [25;75], M±m)
![Таблица 4. Исходные показатели инструментального обследования и показатели ТФН (Me [25;75], M±m) Таблица 4. Исходные показатели инструментального обследования и показатели ТФН (Me [25;75], M±m)](/images/articles/2013/3.1/13135/t4.png)
Примечания: ЖЭС один. – одиночные желудочковые эктопии по ХМ-ЭКГ, ЖЭС куплеты – парные желудочковые эктопии по ХМ-ЭКГ, ТФН – толерантность к физической нагрузке выполненная на тредмилл-тесте, • - критерий Манна-Уитни
Динамическое наблюдение проводили в течение 3 месяцев, после чего было выполнено повторное обследование. Выбранная длительность наблюдения, с нашей точки зрения, была достаточной для оценки эффекта антиаритмической терапии, эффективности терапии МС и оценки клинических и лабораторных показателей.
Показатели, имеющие нормальное или близкое к нормальному распределение, представлены в виде (M±m), где М – выборочная средняя величина, m - выборочное стандартное отклонение; при отличии выборочного распределения от нормального – в виде медианы и интерквартильного (процентильного) интервала ( Ме [25;75]). При анализе динамики изменений проводился расчет в виде Δ%. Основным критерием в оценке значимости различий количественных показателей между обеими группами был критерий Стьюдента: 2-й тип критерия для равных дисперсий, 3-й тип для двухвыборочного теста с неравными дисперсиями. Для выявления существующих различий в группах, отличных от нормального распределения и при порядковых признаках использовали непараметрические критерии Манна-Уитни. Критический уровень значимости принимали равным 0,05.
Результаты и обсуждение. Через 3 месяца наблюдения установлено, что пациенты, получавшие метформин в рекомендуемой дозировке, а также соблюдающие рекомендации по немедикаментозному контролю (подгруппа 1), имели достоверно значимое улучшение в клинических, лабораторных и инструментальных показателях. Данные показатели отражены в табл. 5.
Таблица 5. Клинические, лабораторные и инструментальные показатели через 3 месяца наблюдения (Δ%, M±m, Me [25;75])
![Таблица 5. Клинические, лабораторные и инструментальные показатели через 3 месяца наблюдения (Δ%, M±m, Me [25;75]) Таблица 5. Клинические, лабораторные и инструментальные показатели через 3 месяца наблюдения (Δ%, M±m, Me [25;75])](/images/articles/2013/3.1/13135/t5.png)
Примечания: ИМТ – индекс массы тела, ЖЭС один. – одиночные желудочковые эктопии по ХМ-ЭКГ, ЖЭС куплеты – парные желудочковые эктопии по ХМ-ЭКГ, ТФН – толерантность к физической нагрузке выполненная на тредмилл-тесте, • - критерий Манна-Уитни
Показатели табл. 5 свидетельствуют, что у пациентов подгруппы 1 наблюдается значимая положительная динамика в клинических показателях (окружность талии, масса тела, ИМТ) и толерантности к физической нагрузке. На фоне улучшения клинических показателей также отмечается статистически достоверное улучшение показателей липидного обмена (ЛПВП, ИА) и индекса инсулинорезистентности. Кроме того пациенты подгруппы 1 имели достоверно меньшее количество одиночных желудочковых эктопий, что можно расценивать как большую эффективность антиаритмической терапии.
Обе подгруппы пациентов через 3 месяца наблюдения были сопоставимы по сопутствующей терапии. Единственным различием в принимаемых препаратов был метформин, который подгруппа 1 принимала в средней дозе 1960±78 мг. Пациенты подгруппы 2 не принимали метформин на этапе наблюдения в связи с плохой переносимостью, либо недостаточной приверженностью к терапии.
В основе патогенеза МС лежит инсулинорезистентность[17]. При выраженной инсулинорезистентности на миокард воздействуют множественные факторы, в том числе свободные жирные кислоты, инсулиноподобный фактор роста. Наблюдается значимое влияние на развитие патологических изменений на уровне кардиомиоцита, связанное с низкой эффективностью синтеза АТФ. Они приводят к ремоделированию миокарда и формированию его электрической нестабильности. Все это в конечном итоге может приводить к развитию различных нарушений ритма сердца, в т.ч. и ЖНР. С учетом того, что инсулинорезистентность может быть одним из ключевых моментов в развитии ЖНР у пациентов с МС, все терапевтические мероприятия должны быть направлены на лечение компонентов МС и прежде всего инсулинорезистентности. В данном исследовании пациенты получали комплексную терапию МС, включая немедикаментозные методы, антигипертензивные и гиполипидемические препараты, а также метформин. В результате комплексного воздействия на ключевые звенья патогенеза МС, происходило улучшение клинических и лабораторных показателей, что в конечном счете позволяло повысить эффективность антиаритмической терапии ЖНР.
Заключение. Сопутствующая терапия метаболического синдрома у пациентов с желудочковыми нарушения ритма сердца приводит к достоверному улучшению клинических (окружность талии, масса тела и ИМТ) и лабораторных показателей (ЛПВП, индекс атерогенности), толерантности к физической нагрузке, эффективности антиаритмической терапии.
