Актуальность. Инсулинорезистентность, которая часто манифестирует при инфаркте миокарда, в настоящее время рассматривается как независимый предиктор госпитальной летальности, позволяющий осуществлять раннюю стратификацию риска повторных острых коронарных событий [1]. На сегодняшний день не существует единого представления о патогенетических взаимосвязях ИР и осложненного течения ИМ. В качестве маркеров рассматривается ряд показателей, из которых традиционными являются гиперинсулинемия и гипергликемия [2]. Кроме того, в последнее время активно дискутируется гипотеза о том, что ряд медиаторов жировой ткани и эндокринных клеток желудка могут иметь важное значение в развитии ИР [3, 4]. Имеющиеся немногочисленные данные о важной роли грелина в регуляции углеводного и липидного обмена, а также энергетического гомеостаза позволяют предполагать его участие в формировании ИР [4]. Несмотря на активное изучение широкого ряда показателей ИР, поиск и внедрение новых подходов к оценке ИР для прогнозирования риска развития ИМ и его осложнений остается по-прежнему актуальным.
Целью настоящего исследования явилась оценка уровня грелина и его взаимосвязи с маркерами инсулинорезистентности у пациентов с инфарктом миокарда в динамике госпитального периода.
Материалы и методы. Обследовано 133 пациента (90 мужчин и 43 женщины в возрасте 60,8±1,69 лет) с диагнозом ИМ с подъемом сегмента ST. Диагноз устанавливался согласно рекомендациям Всероссийского научного общества кардиологов (ВНОК) 2007 г [5]. Критерии исключения из исследования: наличие сахарного диабета 2 типа (СД), тяжелые заболевания, влияющие на прогноз, онкологические и инфекционно-воспалительные в период обострения, аутоиммунные заболевания.
Оценка уровня ИР проводилась на 1-е и 12-е сутки госпитализации с помощью структурной математической модели на основе определения инсулина и глюкозы плазмы натощак с вычислением индекса QUICKI (Quantitative Insulin Sensitivity Chek Index) [2] по формуле:
QUICKI=1/[log (I0)+log (G0),
где I0 – базальная инсулинемия (мМЕ/мл), G0 – базальная гликемия (мг/дл). По данным A. Katz et al. (2000), среднее значение QUICKI, равное 0,382±0,007, соответствует нормальной тканевой чувствительности к инсулину; значение QUICKI, равное 0,331±0,010 и 0,304±0,007 – умеренной и выраженной степени тканевой ИР [2].
С учетом индекса все пациенты были разделены на две группы – без ИР и с наличием ИР. Пациенты данных групп были сопоставимы по полу и возрасту. В группе пациентов с ИР чаще встречались такие факторы сердечно-сосудистого риска, как артериальная гипертензия, гиперхолестеринемия, избыточная масса тела и отягощенный семейный анамнез по ишемической болезни сердца (ИБС). В анамнезе пациентов с ИР фиксировалось больше случаев стенокардии и хронической сердечной недостаточности (ХСН). Наличие ИР у пациентов с ИМ было ассоциировано с преобладанием Q-образующего ИМ передней стенки левого желудочка. Среди госпитальных осложнений ИМ у пациентов с ИР часто встречались II класс острой сердечной недостаточности (ОСН), нарушения ритма сердца и ранняя постинфарктная стенокардия. Количество курящих пациентов в обеих группах составило около 50 % от общего числа обследованных. Лечение больных ИМ проводили с учетом рекомендаций ВНОК 2007 года [5]. Контрольную группу составили 33 человека без заболеваний сердечно-сосудистой системы, сопоставимые по полу и возрасту с пациентами основных групп.
На 1-е и 12-е сутки развития ИМ сыворотке крови определяли концентрацию грелина, инсулина и С-пептида иммуноферментным методом с помощью наборов фирм Bachem Group (США), BCM Diagnostics (Германия), концентрацию глюкозы – с помощью стандартной тест-системы фирмы Thermo Fisher Sientific (Финляндия). Статистическую обработку результатов проводили c использованием пакета программ Statistica 6.0, SPSS 17.0 for Windows.
Результаты. У 30 пациентов индекс QUICKI составил 0,38 (1-я группа), что соответствует нормальной тканевой чувствительности к инсулину, у 103 пациентов данный показатель составил 0,308, что соответствует умеренной и выраженной степени тканевой ИР (2-я группа). Частота выявления ИР среди обследованных пациентов составила 77%. В группе больных с ИР отмечалось повышение концентрации глюкозы на всем периоде наблюдения. Нарушение толерантности к глюкозе при ИМ проявлялось возрастанием постпрандиального уровня глюкозы в 1,5 раза, инсулина – в 1,4 раза и С-пептида – в 1,9 раза относительно показателей практически здоровых лиц. У пациентов с ИМ без ИР уровень глюкозы был незначительно увеличен на 1-е и 12-е сутки на фоне нормального содержания инсулина и С-пептида (табл. 1).
Ведущей причиной развития ИР при ИМ может явиться изменение уровня грелина, обладающего регуляторными кардиоваскулярными и иммунотропными эффектами. При анализе результатов настоящего исследования было установлено, что в отличие от других исследуемых показателей, концентрация грелина существенно снижалась (табл. 2).
У пациентов с ИМ без ИР и с ИР концентрация грелина на 1-е сутки была ниже контрольных значений в 3,0 и 3,7 раза соответственно по сравнению со здоровыми лицами. При этом наблюдались статистически значимые различия между группами пациентов с ИМ. Результаты корреляционного анализа свидетельствуют о наличии у пациентов с ИМ обратной зависимости между уровнем грелина и инсулина (-0,54 р=0,002); грелина и глюкозы (-0,31 р=0,002).
Для определения наиболее значимых показателей при развитии ИР был использован метод пошагового отбора, в результате которого для построения логистических регрессий были отобраны инсулин, С-пептид, грелин и глюкоза. Для оценки эффективности используемых параметров применен ROC-анализ, который показал, что площади под кривой (AUG) выбранных показателей соответствуют моделям хорошего качества – для инсулина AUG=0,76 p=0,02, для грелина AUG=0,87 p=0,0001, для глюкозы AUG=0,58 p=0,09 (табл. 3).
Таблица 1. Базальный и постпрандиальный уровень маркеров инсулинорезистентности на 1-е и 12-е сутки развития инфаркта миокарда
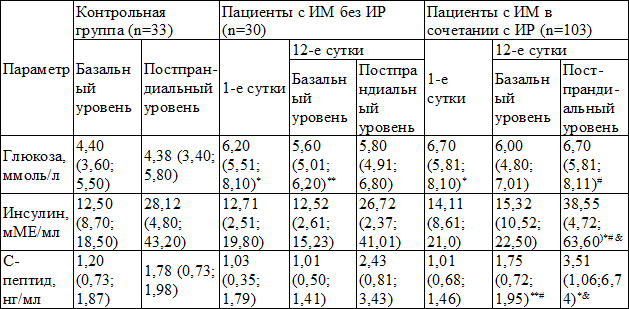
Примечания: здесь и далее * - статистически значимые отличия параметров от группы контроля, (р≤0,05); ** - статистически значимые различия параметров на 1-е и 12-е сутки, (р≤0,05); # - различия между группами на 1-е сутки; & - различия между группами на 12-е сутки
Таблица 2. Динамика концентрации грелина у пациентов с инфарктом миокарда в госпитальном периоде
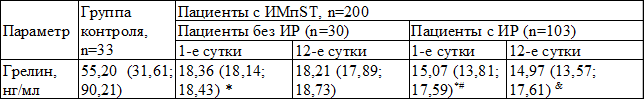
Таблица 3. Отношение шансов (ОШ) развития инсулинорезистентности в госпитальном периоде инфаркта миокарда
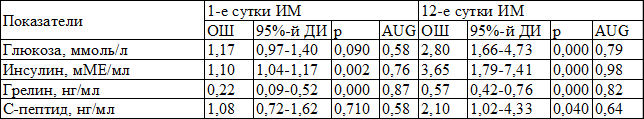
Следовательно, наиболее чувствительным и специфичным маркером ИР явился грелин, по своей диагностической значимости превосходящий инсулин, особенно в остром периоде ИМ. Низкий уровень грелина на 1-е сутки ИМ увеличивал шансы развития ИР на 78%. Из изучаемых признаков углеводного метаболизма ценность в отношении ИР имело определение концентрации глюкозы и инсулина и С-пептида на 12-е сутки: повышение глюкозы увеличивало риск ИР в 2,8 раза, а инсулина – в 3,65 раза, а С-пептида – в 2 раза.
Обсуждение результатов. Изучение механизмов развития ИР при ИМ является актуальным, поскольку, по данным P. J. Stubbs et al. (2006), наличие ИР у пациентов с ИМ имеет прогностическую ценность в отношении развития неблагоприятного исхода заболевания в течение 3-х – летнего периода [6]. В результате настоящего исследования наличие ИР было впервые выявлено у 77 % пациентов с ИМ в госпитальном периоде инфаркта миокарда. При этом ИР была сопряжена с более тяжелым течением госпитального периода заболевания, о чем свидетельствуют высокая частота выявления Q-образующего ИМ с обширным повреждением миокарда и наличие госпитальных осложнений.
В проведенном исследовании для диагностики ИР использовали традиционные маркеры – концентрация инсулина и глюкозы в сыворотке крови больных ИМ, а также определение индекса ИР [2]. Выявленная базальная и постпрандиальная гипергликемия, высокий постпрандиальный уровень инсулина в крови в раннем восстановительном периоде, сниженный индекс QUICKI указывали на наличие ИР. При этом увеличение уровня глюкозы и инсулина сопровождалось повышением риска развития ИР в 2,8 и 3,65 раза соответственно (табл. 3).
В последнее время в патогенезе ИР активно обсуждается роль грелина – гастроинтестинального эндокринного пептида, важного регулятора секреции гормона роста, индукции приема пищи и энергетического гомеостаза [7]. Установлено, что кардиомиоциты способны синтезировать грелин, который оказывает различные протективные эффекты, в частности, подавляет апоптоз кардиомиоцитов, эндотелиальных клеток и улучшает функционирование левого желудочка при ишемии/реперфузии [7].
Известно, что грелин модулирует секрецию инсулина и в силу этого рассматривается как перспективный молекулярный маркер ИР. Показано, что грелин способствует экспрессии α- и β-субъединиц рецептора инсулина. В то же время инсулин в концентрациях 1-10 нм/л ингибирует базальную и стимулированную норадреналином секрецию грелина, но не влияет на экспрессию матричной рибонуклеиновой кислоты (мРНК) гормона [8]. Кроме того, у пациентов с СД терапия метформином, улучшающим тканевую чувствительность к инсулину, сопровождалась увеличением уровня грелина в крови [9]. В данном исследовании содержание грелина было существенно снижено у пациентов с ИМ на протяжении всего госпитального периода, причем у пациентов с ИР изменения носили более выраженный характер. Ранее показано снижение уровня грелина у пациентов с ИМ, что, по мнению авторов, обусловлено усиленным связыванием грелина с рецептором при ишемии/реперфузии [10]. Можно предположить, что при ИМ подавление секреции грелина может быть обусловлено дисфункцией инсулин-секретирующих клеток поджелудочной железы и манифестацией ИР. Подтверждением этого предположения являются результаты корреляционного анализа, установившие для пациентов с ИМ отрицательные зависимости между уровнем грелина и инсулина (-0,54 р=0,002). Кроме того, уровень грелина был более информативным показателем ИР по сравнению с традиционными маркерами ИР как в остром, так и раннем восстановительном периодах ИМ. Следует отметить высокую диагностическую чувствительность и специфичность грелина как маркера ИР при ИМ (82-87%). По своей диагностической значимости грелин превосходил инсулин в остром периоде ИМ.
Заключение. Таким образом, инсулинорезистентность наблюдается у 77% больных с инфарктом миокарда и ассоциирована с наличием в анамнезе факторов сердечно-сосудистого риска, неблагоприятным клиническим течением заболевания, нарушением липидного обмена. Наиболее информативным показателем, с высокой специфичностью и чувствительностью для выявления инсулинорезистентности в остром периоде инфаркта миокарда является концентрация грелина. Снижение содержания грелина в среднем в 4 раза повышает риск развития инсулинорезистентности на 78%.
