Введение. Значительная распространённость хронической сердечной недостаточности ведёт к высокой смертности кардиологических больных и требует больших затрат на лечение. Лечение больных с хронической сердечной недостаточность (ХСН) III-IV функционального класса (ФК) по классификации Нью-Йоркской кардиологической ассоциации (NYHA) в основном заключается в медикаментозной терапии или же в хирургическом вмешательстве (кардиомиопластика, имплантация искусственного желудочка, трансплантация сердца и др.). Медикаментозная терапия, к сожалению, не всегда оправдывает надежды в этой сложной группе пациентов, а хирургические методы лечения не нашли широкого применения у данной группы больных по причине недостаточной эффективности, либо невозможности охвата большого круга пациентов при необходимоcти трансплантации сердца.
Одним из перспективных способов лечения ХСН III-IV ФК (NYHA) является сердечная ресинхронизирующая терапия (СРТ) с помощью бивентрикулярной электрокардиостимуляции, которая изучалась в целом ряде многоцентровых исследований -— CARE-HF, COMPANION, PAVE, SCD-HeFT и др [7, 9, 14, 20, 25]. Исследования показали улучшение качества жизни и увеличение толерантности к физической нагрузке после имплантации CРT. Кроме того, было продемонстрировано, что CРТ снижает число госпитализаций по поводу СН и повышает выживаемость [13, 15].
Но одинаково ли воздействие СРТ на больных с ишемической болезнью сердца (ИБС) и дилятационной кардиомиопатией (ДКМП)? Ответ на этот вопрос до сих пор остается дискутабельным.
Цель исследования: оценить влияние сердечной ресинхронизирующей терапии на течение сердечное недостаточности у больных с дилятационной кардиомиопатией и ишемической болезнью сердца.
Материалы и методы исследования. В «ФЦССХ Минздрава России» г. Пензы в период с 2009 по 2012 г. имплантировано 90 аппаратов СРТ-P. Результаты проанализированы у 64 пациентов с ХСН после имплантации СРТ в периоде с 6 до 12 месяцев. Из них 50 мужчин и 14 женщин в возрасте от 34 до 74 лет, средний возраст 55,6±9 лет. Больные разделены на две группы. Первую группу составили 50 пациентов с ДКМП из них 38 мужчин, средний возраст 54,9±9,7 лет, во вторую группу вошли 14 больных с ИБС из них 13 мужчин, средний возраст 58±5,8 лет. Больные, включенные во вторую группу, имели трех сосудистое поражение коронарных артерий; всем больным выполнялось реваскуляризация миокарда: коронарное шунтирование (КШ) (2 человека), стентирование (7 человек) и КШ + пластика аневризмы ЛЖ (5 человек). Все пациенты имели ХСН III-IV ФК по классификации (NYHA). Отбор на ресинхронизирующую терапию проводился согласно рекомендациям Американской ассоциации сердца (AHA), Американского колледжа кардиологов (ACC) и Всероссийского научного общества аритмологов (ВНОА). Основными критериями отбора были: ХСН с ФК II-IV NYHA, устойчивая к оптимальной стандартной медикаментозной терапии, сниженная фракция выброса левого желудочка (ФВ ЛЖ) <35%, наличие полной блокады левой ножки п. Гиса (длительность комплекса QRS>120 мс). Диагнозы были верифицированы с помощью комплекса исследований, включающих в себя: клиническую характеристику, электрокардиографию, холтеровское мониторирование, эхокардиграфию (ЭхоКГ), коронаровентрикулографию.
Имплантация СРТ проводилась по стандартной методике с установкой электродов: предсердный электрод – в область ушка правого предсердия, в правом желудочке – в область межжелудочковой перегородки или его верхушки, и в левый желудочек устанавливался электрод, проведенный через коронарный синус в одну из вен сердца (чаще латеральную).
Клинически больные оценивались на основании результатов теста 6-минутной ходьбы, оценки ФК СН исходно. Из лабораторных методов применяли имуносерологический метод для определения натрий-диуретического пептида (NT - pro BNP), нарастание которого выше 125 пг/мл свидетельствовало о СН. Контроль и программирование имплантируемого устройства выполняли через 1-3 дня после операции. Далее наблюдали больных спустя 3-6-12-24 месяца. Результаты эффективности СРТ в нашем исследовании проанализированы спустя 6 месяцев и 12 месяцев после имплантации.
Для оценки гемодинамических параметров использовались ультразвуковые диагностические системы (General Electric) Vivid 9, Vivid 7 Dimenshin, Vivid 7 Pro, с изменяемой частотой датчиками от 1,5/3, до 2,3/4,6 МгГц - для торакальных исследований. ЭхоКГ- исследование проводилось согласно рекомендациям ASE.
Измерялись следующие эхокардиографические параметры: конечно – диастолический объем (КДО) левого желудочка (ЛЖ), конечно-систолический объема (КСО), фракция выброса (ФВ), ударный объём к (УО) по Симпсону (измерения производятся в апикальных позициях, во взаимно перпендикулярных плоскостях, в четырех- и двухкамерной проекциях; вычислялись их индексированные показатели: индекс конечно–диастолического объема (ИКДО) левого желудочка (ЛЖ), индекс конечно-систолического объема (ИКСО), и ударный индекс (УИ); индекс сферичности (ИС); передне-задний размер левого предсердия (ЛП); фиброзное кольцо митрального клапана (ФК); площадь эффективного отверстия регургитации (ERO); объем митральной регургитации (Vмр) за один сердечный цикл с помощью PISA на основании которого рассчитывался эффективный ударный объем (УОэф) =УО - Vмр и эффективная фракция выброса (ФВэф) =УОэф/КДО; Dp/Dt- скорость нарастания давления в ЛЖ в начале систолы; степень митральной регургитации (МРс) оценивалась по показателям vena contracta (VC), ERO, площади струи регургитации в левом предсердии.
Дополнительно оценивались показатели внутрижелудочковой и межжелудочковой диссинхронии миокарда:
- - задне-септальная (внутрижелудочковая) задержка проведения в М-режиме (ВЖЗ);
- - периоды предизгнания (пресистолические интервалы) трансаортального и транспульмонального потоков, межжелудочковая потоковая задержка проведения (МЖЗ) в импульсно-волновой допплерографии потоков;
- - внутрилевожелудочковая механическая задержка проведения (ВЛМЗ), межжелудочковая механическая задержка проведения (МЖМЗ) методом тканевой допплерографии миокарда (ТД).
База данных составлялась в виде электронных таблиц в программе Microsoft Office Excel 2007.
Для определения достоверности изменений и межгрупповых различий по параметрическим показателям использовали дисперсионный анализ (Anova Table, Multiple Range Test, Kruskal-Wallis Test), при оценке непараметрических показателей - критерий χ². Статистически значимыми считали различия при уровне p<0,05. Результаты представлены в виде M ± SD, где M – среднее значение, SD – стандартное отклонение для симметричных распределений; и с указанием медианы, 5-го и 95-го процентилей для ассиметричных распределений. Для расчетов использовалась программа StatGraphics plus 3.
Результаты. Исходные ЭхоКГ показатели у пациентов первой группы, такие как иКДО, иКСО и параметры митральной регургитации, достоверно были выше (p<0,05), чем аналогичные параметры во второй группе. Показатели NT - pro BNP и тест с 6-ти минутной ходьбой достоверно не отличались (табл. 1).
Различий по возрастным показателям, по половому признаку и по площади поверхности тела не было. Так как, все больные с ИБС имели в анамнезе перенесенный обширный инфаркт миокарда (ИМ), то отличались от больных с ДКМП выраженными рубцовыми изменениями.
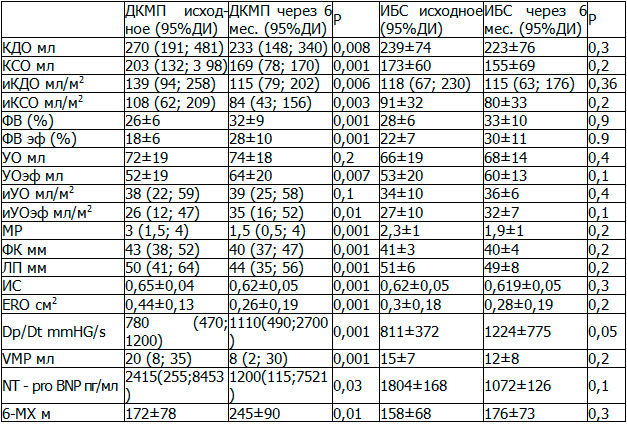
Спустя 6 месяцев после имплантации СРТ у больных с ДКМП отмечалось улучшение как ЭХОКГ, так и клинико-лабораторных показателей, что отражено в табл. 2.
Так, отмечено достоверное уменьшение объемных показателей сердца КДО с 270 (191-481; [95%ДИ]) до 232 мл (134-315; [95%ДИ]) (p=0,008), КСО с 203 (132-398; [95%ДИ]) до 169 мл (78-170; [95%ДИ]) (р=0,001) и их индексированных показателей КДО c 139 (94-258; [95%ДИ]) до 118 мл/м² (67- 230; [95%ДИ]) (p=0,006) и индекса КСО от 108 (62-209; [95%ДИ]) до 84 мл/м² (43-156; [95%ДИ]) (p=0,003), что соответственно сопровождалось возрастанием ФВ с 18±6 до 28±10 % (p=0,001) и подтверждалось возрастанием показателей Dp/Dt с 780 (470-1200; [95% ДИ]) до 1110 mmHG/s (490;2700; [95% ДИ]) (p=0,001) (табл. 2).
При анализе динамики митральной регургитации как самостоятельного показателя прослеживалось снижение показателей ERO 0,44±0,13 до 0,26 ±0,19 см2 (p=0,001), объема митральной регургитации с 20 (8-35; [95%ДИ]) до 8 мл (2-30; [95%ДИ]) (p=0,001) и соответственно степени митральной регургитации с 3 (1,5-4; [95%ДИ]) до 1,5 (0,5-4; [95%ДИ]) (p=0,001). Вследствие чего возрастал УОэф с 26 (12-47; [95%ДИ]) до 35 мл (16-52; [95%ДИ]) (p=001) и ФВэф с 18±6 до 28±10 % (p=0,001), на фоне регрессирования митральной недостаточности и уменьшения нагрузки на левое предсердие уменьшались размеры ЛП с 50 (41-64; [95%ДИ]) до 44 мм (35-56; [95%ДИ]) (p=0,001) и ФК 43 (38-52; [95%ДИ]) до 40 мм (37-47; [95%ДИ]) (p =0,001). Положительная динамика всех выше перечисленных показателей отражалась на глобальном ремоделирование миокарда у данной группы больных со снижением ИС с 0,65±0,04 до 0,62±0,05 (p=0,001)). Все это проявлялось уменьшением явлений ХСН отражающихся снижением маркера сердечной недостаточности NT- pro BNP с 2415 (255-8453; [95%ДИ]) до 1200 пг/мл (115-7521; [95%ДИ]) (p=0,03) и повышением толерантности к физическим нагрузкам. Показатель теста с 6-ти минутной ходьбой увеличивался в среднем с 172±78 до 245±90 м (p=0,01).
Таблица 1. Морфометрическая характеристика ремоделирования сердца больных до ресинхронизирующей терапии по группам.
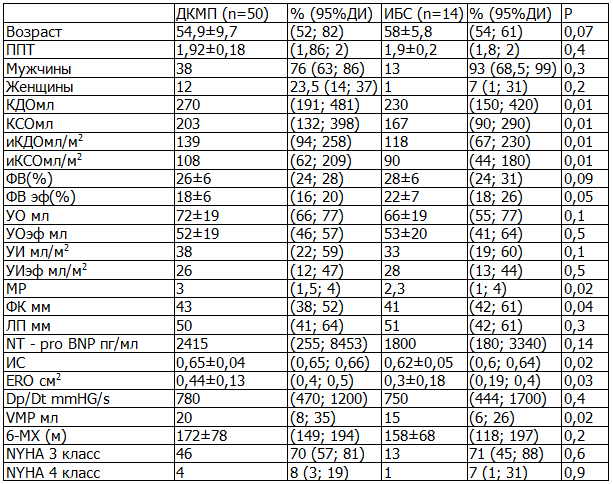
Примечания: здесь и далее КДО - конечно-диастолический объем ЛЖ, КСО - конечно-систолический объем ЛЖ, ФВ - фракция выброса ЛЖ, УО - ударный объем, ERO - площадь эффективного отверстия регургитации, Vмр - объем митральной регургитации, Dp/Dt - скорость нарастания давления в ЛЖ в начале систолы, МР - степень митральной регургитации, ЛП – передне-задний размер левого предсердия, ФК – размер фиброзного кольца митрального клапана, иКДО – индекс конечно-диастолического объема левого желудочка, иКСО – индекс конечно-систолического объема ЛЖ, УИ- ударный индекс, УИэф – эффективный ударный индекс; ИС - индекс сферичности, Pro BNP – натрий -диуретический пептид, 6-МХ – Тест 6-ти минутной ходьбы.
Таблица 2. Динамика морфометрических по данным ЭХОКГ и клинико-лабораторных показателей у пациентов ДКМП и ИБС через 6 месяцев после имплантации ресинхронизирующей системы по группам.
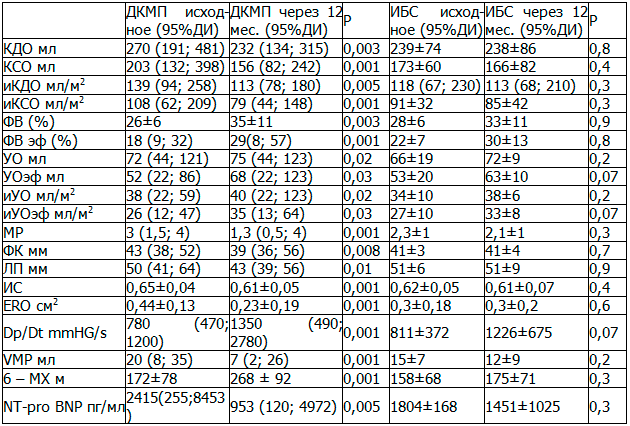
Продолжение СРТ до 12 месяцев привело к дальнейшей положительной динамике данных ЭХОКГ показателей сердца и улучшению клинических и лабораторных показателей (табл. 3), однако эффект в 12 месяцев оказался менее выраженным по сравнения с 6 месяцами.
Оценивая динамику, в группе больных ИБС не было выявлено достоверного отличия с исходными показателями как в 6 месяцев, так и сроке до 12 месяцев года (см. табл. 2, 3).
Однако, несмотря на то, что у данной группы пациентов на протяжении периода наблюдения не было выявлено достоверной положительной динамики, прогрессирования явлений СН, в группе так же не наблюдалось, о чем свидетельствовали стабильные показатели индекса КДО исходно 118 (67-230; [95%ДИ]), через год 115 мл (63-176; [95%ДИ]) (p=0,8), ФВ 28±6 через год 33±11 % (p=0,9) и индекса эффективного УО исходно 27±10 через год 32±7 мл (p=0,2). Так же отмечалось отсутствие роста в крови NT - pro BNP исходно 1804±168 через год 1451±1025 пг/мл (p=0,3), как маркера ХСН. Это можно считать положительным результатом применения СРТ у данного контингента больных.
Обсуждение. В России в 2002 г. было зарегистрировано 8,1 млн. больных сердечной недостаточностью (СН), из которых 3,4 млн. имели III-IV функциональный класс (ФК) заболевания [1]. По данным исследования ЭПОХА-ХСН, распространенность СН I-IV ФК в Европейской части РФ составила 12,3% (мужчины - 9,8%, женщины - 14,2%), III-IV ФК СН встречался в 2,3% случаев. Среди пациентов, обращавшихся в лечебно-профилактические учреждения, СН выявлена в 36,8% случаев, где мужчины составили 52%. Средний возраст больных с хронической СН составил 60,0 лет. Основное число больных приходится на возраст 41-60 лет (43,5%) и 61-80 лет (49,4%) [5, 6]. Однолетняя смертность больных с клинически выраженной СН достигает 26-29%, то есть за один год в Российской Федерации умирает от 880 до 986 тыс. больных СН [3].
Таблица 3. Динамика морфометрических по данным ЭХОКГ и клинико-лабораторных показателей у пациентов ДКМП и ИБС через 12 месяцев после имплантации ресинхронизирующей системы по группам.
Положительное влияние СРТ - терапии на систолическую способность миокарда и течении ХСН общеизвестно [8, 12]. Это происходит благодаря синхронизации сокращений сегментов стенок ЛЖ, за счет чего улучшается эффективное сокращение и уменьшается потребления миокардом кислорода в расчете на одно сокращение [23]. Несмотря на увеличение сократительной способности миокарда, интенсивность окислительных процессов миокарда остается неизменной [24]. Кроме этого, уменьшается регионарная неравномерность потребления миокардом кислорода, которая характерна для сердца при сердечной недостаточности, а также усиление перфузионного резерва миокарда [18, 19]. Все эти позитивные эффекты, реализуемые на клеточном уровне, в конечном итоге отражаются положительным эффектом улучшения глобального показателя насосной функции.
За счет устранения асинхронной работы папиллярных мышц происходит уменьшение объема митральной регургитации, как следствие происходит уменьшение КДО, КСО, ИС. В дальнейшем это проявляется улучшением клинических показателей и соответственно снижением степени сердечной недостаточности. Что отражается в показателях первой группы пациентов с ДКМП в сроке наблюдения 6 месяцев (таблица 2).
В соответствии с исследованиями PROSPECT «клиническими» респондерами являются пациенты с уменьшением класса ХСН на 1 и более функциональный класс, а «эхокардиграфические» респондеры – это пациенты со снижением КСО на 15% и более [17]. Так, в нашем исследовании за период наблюдения показатели иКСО уменьшились с 108 (62-209; [95%ДИ]) до 79 мл/м2 (44- 148; [95%ДИ]) (p=0,001) что составляет 22% и совпадает с исследованием PROSPECT.
По данным исследования PROSPECT клинический ответ наблюдается у 69% пациентов и экокардоиграфический ответ у 56% пациентов. Тогда как, у исследованных нами пациентов первой группы клинический ответ получили у 75%, а эхокардиграфический ответ 58%.
Однако, несмотря на тщательный отбор пациентов, около 20-30% пациентов не отвечает на ресинхронизирующую терапию [12, 22, 13,]. Причинами этого считаются: несовершенство критериев отбора больных, большой объем рубцового поражения миокарда и низкий микардиальный контрактильный резерв, неоптимальная позиция левожелудочкового электрода [10]. По этой причине для минимизации количества не-респордеров необходимо опираться на такие показатели, как длительность комплекса QRS равная или превышающая 120мс, использование эхокардиографии в диагностике диссинхрониии и эхокардиграфических показателей, а также использовать магнитно-резонансную томографию (МРТ) для определения масштабов и локализации рубцовой ткани.
Немаловажную роль для оценки положительного влияния СРТ на течение СН в нашем исследовании мы уделили NT - pro BNP, как одному из маркеров СН. В многоцентровом исследовании «The International NT - pro BNP Consensus Panel» было выявлено, что NT - pro BNP является важным и независимым прогностическим индикатором в диагностике СН. Результаты исследования показали, что уровень гормона NT - pro BNP от 300 до 1591 пг/мл определялся у больных с ФК ΙΙ, от 1591 до 3438 пг/мл при ФК ΙΙΙ и более 3438 пг/мл верифицировался у больных с ФК ΙV. Кроме того NT - pro BNP используют в качестве контроля за эффективностью лечения больных с диагностированной ХСН [16, 4]. В нашем исследовании, после положительного влияния СРТ уменьшалась концентрация в крови показателей NT - pro BNP в период наблюдения с 2415 (255-8453; [95%ДИ]) до 953 пг/мл (120-4972; [95%ДИ]) (p=0,001), что свидетельствует об уменьшении, как минимум, на один ФК у исследуемых нами больных СН. Необходимо отметить, что высокий уровень NT - pro BNP, сохраняющийся несмотря на полноценное лечение, указывает на плохой прогноз [4].
У больных с ИБС неполноценное влияние СРТ во многом зависит от масштаба рубцовой ткани, т.к. при выраженных рубцовых изменениях происходит резкое уменьшение сократительного резерва ЛЖ, кроме того расположение рубцовой ткани в области задне - латерального сегмента способствует неэффективному навязыванию электрического импульса [11, 21]. Не меньшее значение у больных с ИБС имеют процессы локального ремоделирования, когда рубцовая деформация стенок ЛЖ с вовлечением одной или нескольких папиллярных мышц вызывает апикальное смещение створок митрального клапана относительно линии фиброзного кольца и деформацию митрального аппарата, что не позволяет СРТ полноценно устранить митральную регургитацию при синхронизации стенок ЛЖ [2].
Вероятно, все вышеперечисленные процессы ишемической кардиомиопатии не позволяют получить значимых результатов после применения СРТ у больных с ИБС по сравнению с больными ДКМП, однако отсутствие отрицательной динамики и летальных исходов у исследованных пациентов с ИБС в течении анализируемого срока, имеющих вышеперечисленные ограничения для полноценного воздействия СРТ, можно расценивать как положительный результат.
Выводы:
1) СРТ-терапия у больных ДКМП при соблюдении критериев отбора больных является эффективным методом лечения тяжелой ХСН с максимальным эффектом через 6 месяцев;
2) При соблюдении критериев отбора и адекватной реваскуляризации у больных с ИБС, имеющих крайне ограниченный сократительный резерв, СРТ замедляет прогрессирование сердечной недостаточности.
