Введение. В течение последних лет лечение больных стенокардией пополнили новые методы лекарственной терапии, а также расширились и возможности инвазивных вмешательств [1,2,8]. Одной из самых часто применяемых медицинских процедур стало чрескожное коронарное вмешательство (ЧКВ) со стентированием коронарных артерий (КА), что требует внедрения соответствующего медицинского сопровождения [1,5,10].
В ряду самых актуальных осложнений при вмешательствах на артериях сердца первое место занимают тромбозы и рестенозы. Еще 30 лет назад частота значимых тромбозов стента достигала 24 %, при последующем совершенствовании методов стентирования и появлении двойной антиагрегантной терапии частота тромбозов стента снизилась в среднем до 1–2 % по данным зарубежной литературы [1,6,11]. Согласно данным российских исследований, в нашей стране данная ситуация остается неутешительной, рецидив острого коронарного синдрома (ОКС) вследствие тромбоза стента развивается в среднем у 8% пациентов [2,7].
Мета-анализ, включавший 9 исследований влияния полиморфизма генов CYP2C19 на развитие серьезных сердечно-сосудистых событий при терапии клопидогрелем после ЧКВ, выявил, что носители аллели CYP2C19*2 имеют достоверно более высокий риск развития кардиоваскулярных событий, например тромбоза стента [3,9,13].
Пациенты высокого кардиоваскулярного риска имеют в анамнезе модифицируемые (артериальная гипертензия, сахарный диабет, стресс, гиподинамия, дислипидемии) и немодифицируемые (пол, возраст, наследственность) факторы риска. Среди «классических» клинических факторов риска (ФР) наиболее значимыми для обсуждаемой категории больных в плане прогноза развития тромбозов коронарных стентов считаются: метаболические факторы, распространенный атеросклероз, курение [1,3,6,11].
Известно, что у лиц, страдающих СД 2-го типа, риск развития сосудистой патологии, в том числе поражений коронарных артерий, возрастает в 2-4 раза. В свою очередь, сочетание СД 2-го типа и коронарной недостаточности более чем в 4 раза повышает риск летального исхода.
Влияние никотина на сосудистую систему многофакторное, оно отражает активность центральных и периферических никотиновых рецепторов, а также прямое влияние на синтез вазоактивных медиаторов.
Обладая липофильностью, никотин проникает в клетку и взаимодействуя с ядерными рецепторами вызывает экспрессию новых генов [3,9,14]. Под влиянием курения наблюдается повышение адгезивности и способности тромбоцитов к агрегации; экспрессия генов, отвечающих за высокую активность тромбообразования [2,5,7,11].
Улучшив как непосредственные, так и отдаленные результаты ангиопластики, стент, к сожалению, не решил проблему возникновения тромбозов стентов, ограничивающих долговременную эффективность метода.
Известно, что значительное влияние на гемостаз оказывают мутации в генах свертывающей системы крови:FGB, ITGA2, ITGB3, PAI–1, связанные с известными генетическими маркерами: FGB G -455A, ITGA2 C807T, ITGB3 Т1565C, PAI–1 5G(675)4G [6,12,13]. Полиморфные варианты гена CYP2C19 определяют как скорость метаболизма препаратов, так и их терапевтическую эффективность. Аллель А полиморфного локуса с.681G>A (rs4244285) в гомо- и гетерозиготном состоянии снижает ферментативную активность цитохромов печени, приводя к возникновению резистентности к клопидогрелю [2,4,8,11].
В связи с этим, несомненно, актуальным является дальнейшее совершенствование технологии стентирования, поиск факторов риска развития тромбозов стентов и способов их коррекции. Все вышеперечисленное определяет актуальность проблемы тромбозов стентов КА и необходимость её дальнейшего изучения.
Цель исследования: изучение прогностической значимости традиционных и генетических факторов, способствующих развитию тромбозов стентов у пациентов после стентирования КА.
Материалы и методы. В ходе проведения исследования нами обследовано 100 пациентов (65 мужчин и 35 женщин) в возрасте от 50 до 70 лет, перенесших ЧКВ со стентированием КА. Все они имеют в анамнезе следующие факторы риска (ФР): курение, дислипидемия, артериальная гипертензия (АГ), сахарный диабет 2 типа (СД 2 типа), нарушение толерантности к глюкозе (НТГ), ожирение, избыточная масса тела, отягощенный наследственный анамнез по раннему развитию сердечно-сосудистых заболеваний (ССЗ) среди лиц первой линии родства.
Период наблюдения всех больных составил 2 года.
В первые 12 месяцев, после стентирования КА, проспективного наблюдения телефонное анкетирование проводилось 1 раз в 3-4 месяца. Плановые визиты в клинику осуществлялись через 6, 12 и 24 месяцев после выполнения ЧКВ и раннее указанных сроков при прогрессировании ИБС. На фоне обострения ИБС проводилась повторная коронароангиография (КАГ). В случае возникновения тромбоза стента проводились следующие исследования: экстренная КАГ, электрокардиография (ЭКГ), исследовались биомаркеры некроза (тропонины I и T, миоглобин, МВ-КФК (креатинфосфокиназа)).
После окончания приема ДААТ плановые визиты в клинику осуществлялись 1 раз в 12 месяцев.
Нами были определены следующие группы: основная: 14 пациентов с развившимся тромбозом стента, контрольная: 86 пациентов без тромбоза стента. Определена группа здоровых лиц из 100 человек.
Всем пациентам и здоровым лицам были проведены клинические исследования (общий анализ крови и биохимическое исследование крови, ЭКГ, суточное мониторирование ЭКГ, ЭХО-КС), а также проведено генетическое исследование с целью выявления полиморфизмов некоторых генов (G(-455)A (rs1800790) гена FGB, C807T (rs1126643) гена ITGA2, T1565C (rs5918) гена ITGB3), 5G(675)4G гена PAI–1, (CYP2C19*2 rs4244285) гена CYP2C19.
Выделение ДНК и изучение полиморфизмов генов проводили методом полимеразной цепной реакции в реальном времени с использованием тест-систем производства ЗАО «Синтол» (Россия) на приборе CFX96 Touch (США). Для каждого из изучаемых ДНК-маркеров проводили оценку соответствия распределения генотипов ожидаемым значениям при равновесии Харди-Вайнберга. Для сравнения распределений частот аллелей и генотипов в выборках больных и здоровых использовали критерий χ2. Силу ассоциаций оценивали с помощью показателя отношения шансов Odds Ratio (OR) и указанием 95% доверительного интервала (ДИ), критерий Фишера.
Результаты и обсуждение. Нашим больным в 46 случаях ЧКВ выполнялось в связи с наличием у пациента ОКС, в остальных случаях — в связи с наличием выраженного стенозирования КА (по данным КАГ). 43 больным имплантирован 1 стент, остальным имплантировано 2 и более стентов. Во всех случаях ЧКВ достигнут удовлетворительный результат, кровоток TIMI 3 градации. Однако у 14 пациентов развился тромбоз стента: у 6 (43%) больных - острый тромбоз стента, у 3(21%) - поздний и у 5 (36%) - очень поздний тромбоз стента.
Как известно, АГ является одним из главных неблагоприятных ФР в отношении ухудшения прогноза после ЧКВ со стентированием КА. В группе с развившимся тромбозом АГ наблюдалась в 100%, тогда как во II группе (без тромбозов) в 62%. Средний уровень систолического артериального давления (САД) в I группе до проведения стентирования выше, чем во II (157±5 мм рт. ст. и 136±3 мм рт. ст.). Уровень диастолического давления (ДАД) до стентирования выше в I группе 94±2 мм рт. ст. против 82±3 мм рт. ст. За период наблюдения после стентирования контроль АД до целевого уровня достигали в I группе 58% больных, во второй группе-46% (р<0,05).
Курение до проведения стентирования КА в I группе встречалось в 43% против 37,2% пациентов группы без тромбозов. После стентирования количество курящих больных в обеих группах уменьшилось, но не имело достоверных отличий.
Из общего числа обследуемых СД 2 типа страдают в I группе -43%, во II группе -15%. НТГ наблюдалось в 38% случаев в группе тромбозов стентов и в 27% в группе без тромбозов.
При исследовании липидного обмена у пациентов были получены результаты, свидетельствующие о выраженных дислипидемиях особенно в группе с тромбозами. Показатели холестерина (ХС), ХС ЛПНП(липопротеины низкой плотности) выше в группе тромбозов как до, так и после стентирования, несмотря на прием статинов: средний уровень ХС в I группе до стентирования 7,3±1,4 ммоль/л, во II группе - до стентирования – 6,8±1,5 ммоль/л (p<0,05). Показатели общего ХС после стентирования в группах существенно не отличались (5,4±1,2 ммоль/л против 4,7±1,4 ммоль/л , p>0,05). Уровень ХС ЛПНП так же был выше в I группе до стентирования 4,6±0,34 ммоль/л против 3,8±0,67 ммоль/л во II группе. Уровни ТГ, ХС ЛПВП не имели прогностического значения у исследуемых больных (табл.1).
Таблица 1. Частота встречаемости некоторых факторов риска у пациентов, до проведения ЧКВ со стентированием КА
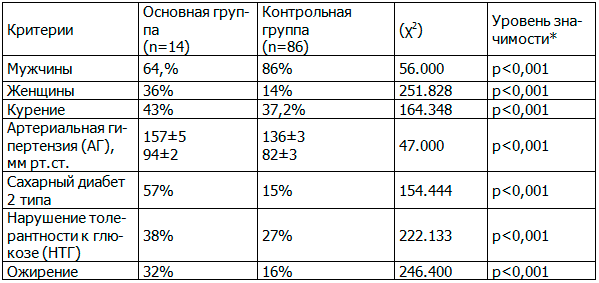
* Значение χ2 при уровне значимости p=0.01 6.635. Связь между факторным и результативным признаками статистически значима при уровне значимости р<0.01.
Генетическое исследование показало высокую частоту встречаемости полиморфизмов системы гемостаза исследуемых генов: FGB G -455A, ITGA2 C807T, ITGB3 Т1565C, PAI – 1 5G(675)4G, в неблагоприятных вариантах (гетерозиготном и «патологическом» гомозиготном), как в группах лиц, перенесших ЧКВ со стентированием КА, так и в группе здоровых лиц (р<0,05) (рис. 1 и рис. 2).
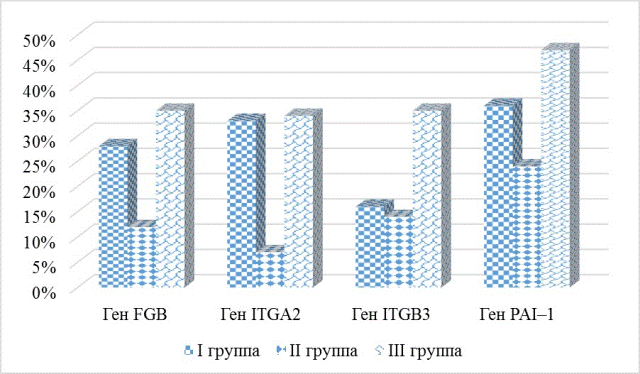
Рис. 1. Встречаемость полиморфизмов некоторых генов гемостаза в гетерозиготном варианте в исследуемых группах.
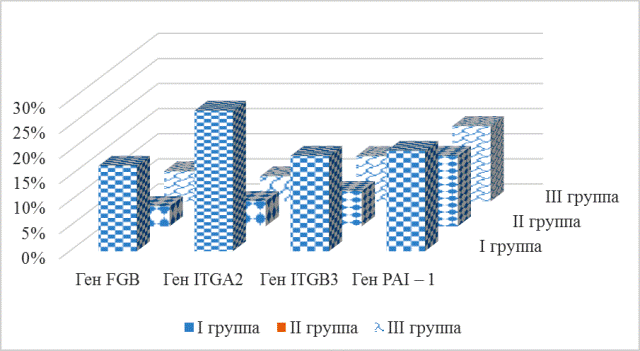
Рис. 2. Встречаемость полиморфизмов некоторых генов гемостаза в «патологическом» гомозиготном варианте в исследуемых группах.
При исследовании гена CYP2C19 (CYP2C19*2 rs4244285) мутация которого, заключается в замене гуанина (G) на аденин (A) в 681 (681G-A) положении, что приводит к синтезу нефункционального белка с низкой метаболической активностью, приводя к возникновению резистентности к клопидогрелю, были получены следующие результаты: в 40% случаев пациенты I группы с СД 2 типа являются носителями генотипа 681GA, ассоциированного с повышенным риском тромботических осложнений на фоне приема клопидогреля, 38% лиц с тромбозом стента, помимо неблагоприятного генетического фона имели НТГ, 32% пациентов с ожирением также являются носителями генотипа 681GA (Р=0.03514, p<0,05). Проведенные нами исследования показали, что носительство генотипа 681GG не является протективным фактором в плане резистентности к клопидогрелю при наличии метаболических предикторов.
Таким образом, проведенные нами исследования показали, что у большинства исследуемых нами лиц, определяется генетически заложенная повышенная и умеренно повышенная агрегационная способность тромбоцитов. Носительство генотипа 681GG гена CYP2C19, (CYP2C19*2 rs4244285) не является протективным фактором в плане резистентности к клопидогрелю при наличии метаболических нарушений. Учитывая высокую распространенность тромбогенных полиморфизмов, представляется целесообразным проводить данные исследования пациентам до проведения чрескожного коронарного вмешательства.
