Введение. Преимуществом операции аортокоронарного шунтирования (АКШ) на работающем сердце, без искусственного кровообращения (ИК) признана меньшая частота развития острого почечного повреждения (ОПП). Однако дальнейшее течение кардиоренального синдрома исследовано недостаточно. В крупном проспективном исследовании мужчин среднего возраста (465 случаев, 1076 контролей) была показана связь сывороточной матричной металлопротеиназы-9 (MMP-9) с возникновением коронарной болезни сердца в общей популяции [8]. Циркулирующие MMP-2, -3 и -9 также были независимо ассоциированы с последующим прогрессированием болезни почек у больных ишемической болезнью сердца (ИБС) без сахарного диабета [6]. Будущие исследования предполагают изучение механизмов хронической болезни почек (ХБП) и поиск возможности улучшения скрининга, лечения и предупреждения. Цистатин С исследован в качестве раннего биомаркера ОПП у пациентов, подвергнутых ИК [4, 7], представляет интерес определение его у пациентов после операции АКШ на работающем сердце в ближайшем и отдаленном периодах и поиск ассоциаций с другими биомаркерами прогрессирования атеросклероза и ХБП.
Цель работы: оценить функцию почек и выявить взаимосвязи новых биомаркеров оксидативного стресса, ремоделирования и почечного повреждения с цистатином С в раннем послеоперационном периоде и через год после АКШ на работающем сердце.
30 больным выполнена операция изолированного АКШ без ИК в 2012 - 2013 гг. Средний возраст больных составил 57,9±4,7 г., мужчин было 23 (76,7%), женщин – 7 (23,3%). «Syntax Score», отражающий тяжесть коронарного атеросклероза, составил 25,5±6,9. Количество шунтов: 1 –у 2 (6.7%) пациентов, 2 – у 11 (36.6%), 3 – у 15 (50.0%), 4 – у 2 (6.7%) больных. Исходная сердечная недостаточность: средняя дистанция 6-минутной ходьбы 320,6±117,1 м., до операции функциональный класс (ФК) 2 (NYHA) – у 13 пациентов (43,3%). Фракция изгнания левого желудочка (ФИ ЛЖ) – 57,6 ±7,4%. Исходная функция почек: скорость клубочковой фильтрации (СКФ) 91,2±23,0 мл/мин/1,73м2. СКФ < 60 мл/мин/1,73м2 имела место у 4 (13,3%) пациентов.
Дизайн исследования. Больным до операции, через 48 часов и год после операции определяли сывороточный креатинин (сКр), СКФ по формуле Modification of Diet in Renal Disease (MDRD) и сывороточный цистатин С.
В сыворотке крови всех исследуемых лиц трехкратно (до операции, через 48 часов и 7 дней после операции) исследовали сывороточные уровни молекулы почечного повреждения-1 (KIM-1), галектина-3 (Gal-3) и MMP-9.
Концентрацию цистатина С в сыворотке крови больных определяли методом иммуноферментного анализа (ИФА) с использованием коммерческого набора Biovendor (Чехия) для количественного определения цистатина С человека. Результаты представляли в виде общей концентрации цистатина С в расчете на 1 мл биологического образца (нг/мл), затем переводили в мг/л. Сывороточные уровни KIM-1, Gal-3 и MMP-9 определяли методом ИФА на автоматическом анализаторе ANTHOS LABTEC INSTRUMENTS 2020 c использованием коммерческих наборов антител (Life Science Inc., USA; Bender MedSystem GmbH, Austria).
Трансторакальная эхокардиоскопия выполнялась в одно-, двух- и четырехкамерном режимах на аппарате GE Vivid i (Израиль, 2007) кардиологическим датчиком с частотой 1,7 – 3,4 МГц по стандартным методикам. ФИ ЛЖ оценивалась по Teicholc.
Многопроекционная коронарная ангиография выполнялась на ангиоскопическом комплексе Allura Xper FD20 фирмы Philips до операции.
ОПП определялось согласно «RIFLE» классификации [3] по изменению сКр (максимальное значение в течение 48 часов после операции сравнивалось с исходным уровнем) и снижению темпа мочеотделения (МО): «RIFLE-R (риск)» в случае повышения содержания сКр в 1,5 раза (до 100%) или МО < 0,5 мл/кг/час х 6 час.; «RIFLE-I (повреждение)» – повышение содержания сКр в 2 раза (до 200%) или МО < 0,5 мл/кг/час х 12 час.; «RIFLE-F (недостаточность)» – повышение сКр в 3 раза или содержание сКр ≥ 350 мкмоль/л. МО < 0,3 мл/кг/час х 24 час.; утрата функции («Loss») – персистирующая острая почечная недостаточность более 4 недель; терминальная стадия почечного заболевания («End-stage») – персистирование почечной недостаточности более 3 месяцев.
Анализ полученных данных выполнен с использованием программы медицинской статистики SPSS, версия 17.0. Количественные переменные представлены как M ± SD в случае нормального распределения и Me (25, 75 percentile) при иных распределениях. При сравнении средних значений двух зависимых групп использован непараметрический двусторонний критерий Вилкоксона, трех групп – тест Фридмана. Статистическая значимость устанавливалась при p<0,05. Применялись метод повторных измерений ANOVA для сравнения биомаркеров и СКФ в различных временных точках до после операции. Использован однофакторный и множественный линейный регрессионный анализ для выявления предикторов концентрации цистатина С.
Результаты и обсуждение. Проведена оценка функции почек в раннем послеоперационном периоде (через 48 часов) и отдаленном (через год) после АКШ на работающем сердце по сКр., СКФ и цистатину С.
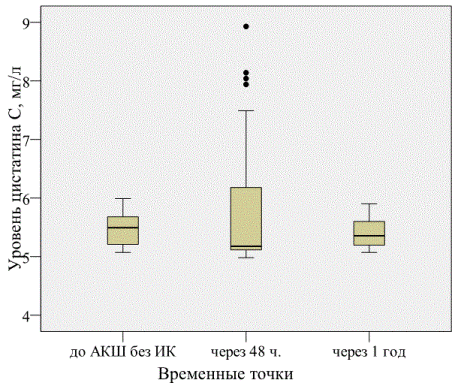
Рис. 1. Содержание цистатина С до и после операции АКШ на работающем сердце.
До операции сКр составил 81,0±18,3 мкмоль/л, через 48 часов после операции – 75,9±20,4 мкмоль/л, через год после операции – 75,3±22,0 мкмоль/л, p=0,772. СКФ в этих же точках составила 90,6±23,0; 103,2±47,7 и 101,3±26,7 мл/мин/1,73м2,соответственно, p=0,495. Содержание цистатина С до операции было 5,47±0,29 мг/л, через 48 часов после операции 5,81±1,13 мг/л, через год после АКШ – 5,42±0,25 мг/л, p=0,596 (рис.1).
В раннем послеоперационном периоде ОПП в стадии «R» (Risk) была диагностирована у 3 пациентов (10,0%), более тяжелых стадий ОПП и потребности в заместительной почечной терапии не было. Наше исследование еще раз подтверждает мнение, что одним из преимуществ техники «Off-pump» является снижение риска развития ОПП. Так, по данным Б.Г. Искендерова и О.Н. Сисиной [1] после АКШ с ИК в раннем послеоперационном периоде ОПП развилось у59,4% пациентов с ХБП и у 25,1% больных без признаков ХБП, что, несомненно, выше полученных нами данных. В отдаленном периоде через год после АКШ без ИК значимой динамики показателей функции почек выявлено не было.
Исходный уровень KIM-1 – 30,8 (11,0; 65,6) нг/мл. Определена динамика KIM-1 в 3-х точках: до операции 29,1 (11,0; 64,5) нг/мл, через 48 часов после операции – 39,0 (23,7; 98,7) нг/мл, через 7 дней 36,2 (10,8; 58,5) нг/мл (Fridman Test, p=0,030).
Анализ повторных измерений также показал достоверное повышение lgKIM-1 через 48 часов. Определен значимый эффект для фактора времени Wilks’Lambda= 0,608, F=7,422; p=0,003 (рис. 2).
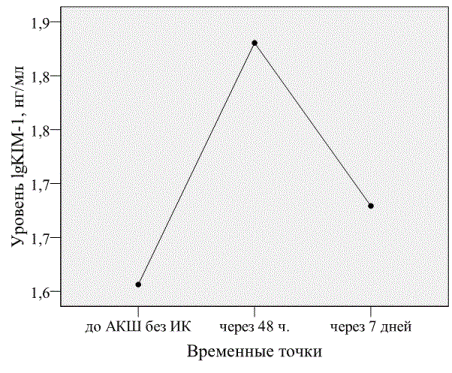
Рис. 2 . Динамика сывороточной KIM-1 до и после АКШ без ИК.
Уровни Gal-3 в те же временные сроки составили 9,1 (2,3;15,7) нг/мл, 10,5 (4,8;18,1) нг/мл 14,6 (3,8;29,0) нг/мл. Выявлен линейный тренд повышения Gal-3 в раннем послеоперационном периоде (F=4,741; p=0,039).
Отмечено также повышение содержания MMP-9 через 48 часов после операции и сохранение повышенного уровня через 7 дней (рис.3). Различие исходного значения и уровня через 7 дней после операции значимо (11,43±5,57 против 14,12±7,06 нг/мл, соответственно; p=0,030).
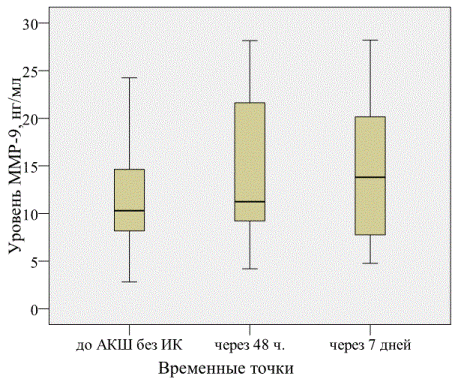
Рис. 3. Содержание сывороточной MMP-9 до и после АКШ без ИК.
Методом линейной регрессии выявлена зависимость дооперационной концентрации цистатина С от систолического артериального давления (сАД): F=9,803, p=0,006; сАД В (SE) 0,013 (0,004), β=0,605, p=0,006, R2=0,366, скорректированный R2=0,328, константа В (SE) 3,688 (0,555), p<0,001.
Уровень цистатина С в раннем периоде после операции (через 48 часов) был ассоциирован с содержанием MMP-9 (48 час). Gal-3 (48 час) усиливал прогностическую значимость модели: F =4,811, p=0,017, MMP-9 (48 час) В (SE) 0,059 (0,027), β=0,382, p=0,040; Gal-3 (48 час) В (SE) 0,035 (0,020), β=0,309, p=0,092; R2=0,286, скорректированный R2=0,227, константа В (SE) 4,532 (0,473), p<0,001. Роль Gal-3 – атипичного представителя семейства галектинов, обсуждается на страницах научных изданий [2], есть сведения об его участии в фиброзе, ремоделировании сердца, иммунологическом ответе и воспалительных реакциях.
Выявлена зависимость концентрации цистатина С через год после операции АКШ без ИК от содержания сывороточной KIM-1, определенной через 48 часов после операции: F =8,108, p=0,009; KIM-1 (48 час) В (SE) -0,182 (0,064), β=-0,495, p=0,009, R2=0,245, скорректированный R2=0,215, константа В (SE) 5,747 (0,120), p<0,001. Есть данные о том, что KIM-1 значительно ускоряет процесс восстановления функции почек после их повреждения [5]. KIM-1 воздействует на сохранившие жизнеспособность эпителиальные клетки и превращает их в фагоциты, способные поглощать погибшие клетки. Таким образом, KIM-1 является не только диагностическим маркером, но и повышает интенсивность процессов восстановления структуры и функции почечной ткани.
Заключение. После АКШ на работающем сердце частота ОПП в стадии риска составила 10%, значимого изменения функции почек по результатам исследования СКФ по MDRD, сывороточных креатинина и цистатина С через год после операции не произошло, что говорит о преимуществах этого метода реваскуляризации миокарда у пациентов с дисфункцией почек. Выявлены новые взаимосвязи биомаркеров оксидативного стресса, ремоделирования, почечного повреждения, важные для объяснения патогенеза кардиоренального синдрома.
