Введение. Известно, что старение является одним из факторов, ведущих к уменьшению уровня мелатонина в организме. С возрастом снижение содержания мелатонина в крови, а также уменьшение секреторной способности эпифиза имеет место у разных видов млекопитающих [11]. Аналогичная ситуация наблюдается при исследовании уровня мелатонина и его конечных продуктов в крови у человека [12]. Зародыши и новорожденные млекопитающие, включая человека, не образуют мелатонин, а пользуются поступающим через плаценту гормоном. С возрастом синтез мелатонина в эпифизе резко увеличивается и достигает максимума в зрелом возрасте, а затем в течение всей жизни постепенно и плавно снижается. Снижение уровня мелатонина вносит значительный вклад в развитие нейродегенеративных заболеваний при старении [13]. Во время старения параллельно с изменением морфологической структуры, возникают нарушения в физиологии процессов памяти, мышления, поведения [15].
Одним из наиболее подверженных возрастным структурным изменениям отделов мозга является гиппокамп [17]. В зубчатой извилине, СА1, СА3 регионах гиппокампа локализуются МТ1 и МТ2 рецепторы к мелатонину [2]. Эндогенный мелатонин обладает антиоксидантными свойствами, а его метаболиты являются сильнодействующими поглотителями свободных радикалов [3, 4], также известно его действие при нейровоспалительных процессах [5, 6]. Кроме того, мелатонин защищает клетки от экзогенного осаждения β-амилоида, возникающего вследствие митохондриальной дисфункции, что было доказано на модели нейродегенеративных заболеваний [7, 8]. В настоящей работе использована модель преждевременно стареющих крыс OXYS. Этих животных отличает раннее развитие фенотипических проявлений старения мозга, в том числе нарушение способности к ассоциативному обучению, повышенная тревожность, сниженная поисково-исследовательская активность [8]. С помощью магнитно-резонансной томографии определялись демиелинизированные очаги в головном мозге 3-месячных крыс OXYS, которые прогрессировали с возрастом [7].
В связи с этим целью исследования стало изучение влияния мелатонина на состояние пирамидных нейронов гиппокампа регионов СА1, СА3, зубчатой извилины крыс Wistar и преждевременно стареющих крыс OXYS.
Материалы и методы. Исследования выполнены на 10 преждевременно стареющих крысах OXYS в возрасте 5 месяцев и 10 крысах линии Wistar того же пола и возраста. Животные были получены из центра коллективного пользования «Генофонды лабораторных животных» Института цитологии и генетики СО РАН (г. Новосибирск). Все животные содержались в одинаковых условиях вивария. При содержании и умерщвлении животных руководствовались «Правилами проведения работ с использованием экспериментальных животных» (приложение к приказу МЗ СССР №755 от 12.08.1977 г.). Животные были распределены на 4 группы. В первую входили крысы линии OXYS, получавшие мелатонин (Мелаксен Unipharm, США) с 3-х месячного возраста по 0,04 мг/кг массы тела — дозу, эквивалентную рекомендуемой людям, вторая группа - крысы Wistar получавшие аналогичную дозу мелатонина, третья группа крысы OXYS - интактные, четвертая группа Wistar - интактные.
Животные были ингаляционно анестезированны СО2 и транскардиально перфузированны 10% раствором формалина на фосфатном буфере (рН 7,4). Мозг извлекали и дополнительно фиксировали в том же растворе в течение суток. После фиксации материал обезвоживали в спиртах возрастающей концентрации и заливали в парафин по стандартной методике. С помощью санного микротома готовили фронтальные срезы головного мозга толщиной 5 мкм. Для выявления хроматофильного вещества в перикарионах нейронов гиппокампа срезы окрашивали 0,1% крезиловым фиолетовым по Нисслю в соответствии с прописью НИИ мозга РАМН. При световом микроскопировании СА1, СА3, зубчатой извилины гиппокампа подсчитывали нейроны с очаговым, тотальным хроматолизом, гиперхромные сморщенные нейроны, гиперхромные без сморщивания.
На снимках, полученных при помощи программы Carl Zeiss Axio Vision 8.0 при увеличении 10х100, определяли среднюю площадь тел и ядер нейронов (мкм2).
Статистический обработку полученных данных выполняли методами описательной статистики с вычислением медианы Ме и интерквартильного интервала Q1-Q3. Для оценки достоверности различий использован непараметрический критерий Манна-Уитни. Различия между показателями в разных группах считались значимыми при р<0,05.
Результаты и обсуждение. Возрастные изменения головного мозга морфологически обусловлены увеличением числа измененных нейронов, уменьшением количества нервных клеток и замещением их глиальными элементами [16]. Изменения пирамидных нейронов характеризуются в основном хроматолизом различной степени выраженности от обратимого очагового с частичным растворением хроматофильного вещества в перикарионе, до необратимого тотального, сопровождающегося утратой синтетических функций, ограничением питания и гибелью клетки. Также наблюдается появление гиперхромных сморщенных нейронов, характеризующихся уменьшением объёма и деформацией перикариона, наличие гиперхромных нейронов без сморщивания с увеличением степени базофилии, укрупнением глыбок хроматофильного вещества и образованием конгломератов.
При светомикроскопическом исследовании гиппокампа интактных животных было выявлено, что у крыс OXYS в сравнении c линией Wistar, в СА1 регионе достоверно больший процент нейронов с признаками тотального хроматолиза (рис. 1), гиперхромных нейронов без сморщивания (рис. 2), в СА3 регионе более высокий показатель гиперхромных сморщенных нейронов (рис. 3), в зубчатой извилине значительно больше гиперхромных нейронов без сморщивания (табл.1).
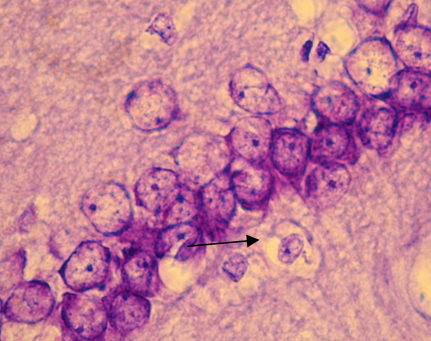
Рис. 1. СА1 регион гиппокампа крысы OXYS – интактные (стрелкой указан нейрон с тотальным хроматолизом). Окраска крезиловым фиолетовым по Нисслю. Об. 100, ок. 10.
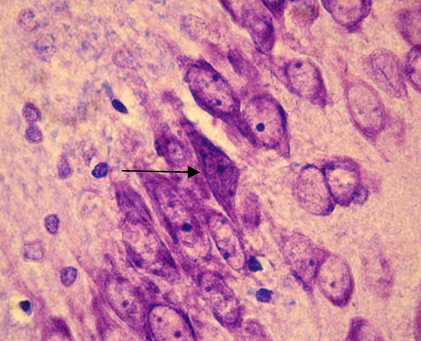
Рис. 2. СА1 регион гиппокампа крысы OXYS– интактные (стрелкой указан гиперхромный нейрон без сморщивания). Окраска крезиловым фиолетовым по Нисслю. Об. 100, ок. 10.
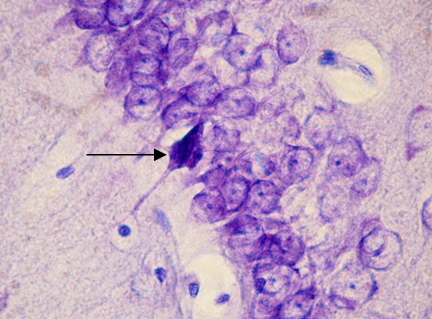
Рис. 3. СА1 регион гиппокампа крысы OXYS– интактные (стрелкой указан гиперхромный сморщенный нейрон). Окраска крезиловым фиолетовым по Нисслю. Об. 100, ок. 10.
У крыс линии Wistar получавших мелатонин в СА3 регионе процент гиперхромных нейронов без сморщивания был значимо меньше, чем у интактных крыс аналогичной линии, в остальных регионах достоверных отличий по числу измененных нейронов обнаружено не было. При сравнении интактных крыс Wistar и группы OXYS с применением мелатонина, изменения нарастали в большей степени у линии Wistar. Так, в СА1 регионе крыс Wistar достоверно выше процент нейронов с признаками тотального хроматолиза, гиперхромных сморщенных и гиперхромных нейронов без сморщивания, в СА3 регионе был значительно увеличен процент гиперхромных сморщенных нейронов, в зубчатой извилине было достоверно больше гиперхромных нейронов без сморщивания. Сравнивая между собой линии Wistar и OXYS с применением препарата, у последних в СА1 регионе больший процент нейронов с тотальным хроматолизом, гиперхромных сморщенных и гиперхромных нейронов без сморщивания, в СА3 регионе определялось значительное увеличение всех изучаемых видов измененных нейронов, в зубчатой извилине наблюдалось увеличение гиперхромных нейронов без сморщивания.
Таблица 1. Содержание пирамидных нейронов с различными морфологическими изменениями в гиппокампе крыс OXYS и Wistar, (Ме (Q1-Q3)), %
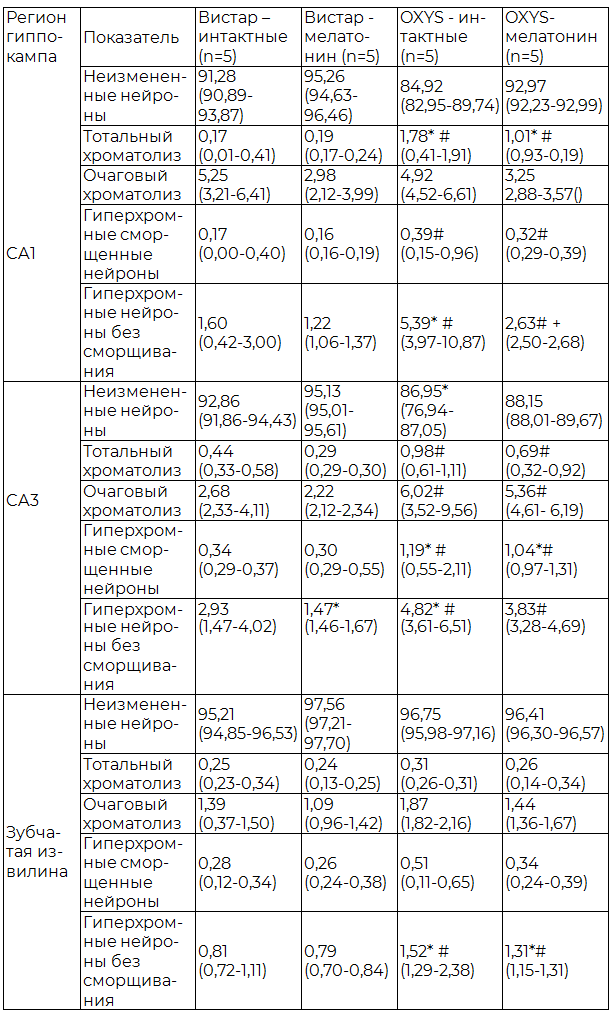
Примечания: здесь и далее n - количество животных; * - показатели статистически значимо отличаются от группы Wistar – интактные при р<0,05; # - показатели статистически значимо отличаются от группы Wistar с применением мелатонина при р<0,05. Критерий Манна-Уитни; + - показатели статистически значимо отличаются от группы OXYS- интактные при р<0,05. Критерий Манна-Уитни.
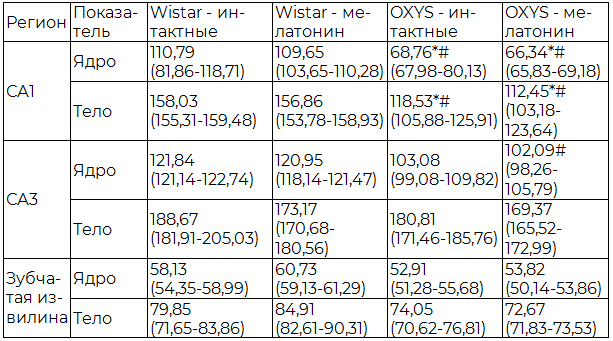
Проведенный морфометрический анализ показал, что между интактными животными линий OXYS и Wistar существуют значимые отличия по показателям средней площади тел и ядер нейронов в различных регионах гиппокампа. У животных линии OXYS в СА1 регионе определялась достоверно меньшая средняя площадь ядер и тел нейронов, при этом в остальных регионах гиппокампа существенных различий выявлено не было. Также достоверное увеличение исследуемых показателей в СА1 регионе наблюдалось у животных линии Wistar, получавших мелатонин, в сравнении с линией OXYS и группой крыс OXYS с применением мелатонина (табл. 2).
Таблица 2. Средняя площадь тел и ядер нейронов в гиппокампе крыс OXYS и Wistar, (Ме (Q1-Q3)), мкм2
Ряд исследований установил улучшение функции памяти на фоне приема мелатонина [9,10]. Эксперименты, проведенные ранее, выявили нарушения суточного ритма секреции мелатонина у крыс OXYS уже в возрасте 3 мес., что по времени совпадает с формированием признаков ускоренного старения мозга (пассивного типа поведения, повышенной тревожности, снижение способности к обучению и памяти).
Полученные нами результаты согласуются с опубликованными данными, подтверждающими, что при старении происходит увеличение числа измененных нейронов, с которыми коррелирует выраженность поведенческих и когнитивных нарушений [14]. Кроме того, исследования, проведенные ранее показывают, что характерные для процесса старения изменения развиваются у крыс OXYS существенно раньше, чем у крыс Wistar. Так, развивающаяся у крыс OXYS уже в молодом возрасте ретинопатия по клиническим проявлениям и морфологическим признакам соответствует «сухой», атрофической форме возрастной макулярной дегенерации у пожилых людей [1]. С помощью МРТ исследования были обнаружены демиелинизированные очаги в головном мозге 3-месячных крыс OXYS, которые прогрессировали с возрастом, у молодых крыс линии Wistar такие повреждения не наблюдались. С возрастом демиелинизированные поражения обнаруживаются у крыс Wistar, но у зрелых и старых животных количество очагов меньше, чем в аналогичных по возрасту группах крыс OXYS [16].
Выводы. Морфологические изменения нейронов гиппокампа животных получавших мелатонин, сходны с изменениями, наблюдаемыми у интактных крыс, различия выявлялись только на уровне количественного анализа. Введение препарата оказало аналогичный положительный эффект на состояние пирамидных нейронов СА1, СА3 и зубчатой извилины гиппокампа крыс Wistar и OXYS. Таким образом, результаты настоящего исследования демонстрируют перспективность использования мелатонина в качестве нейропротектора, способного предупреждать и замедлять развитие проявлений ускоренного старения мозга.
